Method Article
Nanobody ve Antikor Temelli Doğrulama
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Özet
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Giriş
Bu yazıda, ex vivo disseke ksenograft tümörlerinin flow sitometri ve floresan mikroskop kullanılarak in vivo ksenogref görüntüleme deneyleri onaylanması için yakın-kızılötesi fluorofor etiketli prob uygulanmasını açıklar. Tek bir etki nanobody (s + 16a, 17 kDa), 1 ve in vivo olarak belirli aynı hedef antijene karşı yönlendirilen tek klonlu bir antikoru (Nika102, 150 kDa), 2,3 karşılaştırın yakın kızıl ötesi bir lenfoma ksenogreft modelinde floresan görüntüleme. Hedef antijeni ADP-riboziltransferaz ARTC2.2 lenfoma hücreleri 4-9 tarafından bir GPI-ankorlu hücre yüzeyi ekto-enzim olarak ifade edilir.
Camelid türetilen nanoantikorlar ağır zincir sadece antikorlar en küçük antijen bağlanma fragmanları, 10,11 vardır. Sadece ~ 15 kDa, bu küçük antikor fragmanları, çözünür, çok stabil olan ve böbrek yoluyla dolaşım 8,10 temizlenir. These özellikleri, in vivo 12-20 tümör antijenlerinin spesifik ve etkin bir hedefleme için özellikle uygun hale gelir. Mevcut nanoantikorlar ortak antijen hedefleri (EGFR1 veya HER-1), insan epidermal büyüme faktörü tip 2 (HER-2 veya CD340), karsinoembriyonik antijen (CEA) ve vasküler hücre yapışma molekülü-1 (VCAM-1, epidermal büyüme faktörü reseptörünün ) 21. Nanobody birleşikleri enflamatuar hastalıklar 22 kanseri immünoterapisi ve tedavisi için gelecek vaat eden araçlar.
Son zamanlarda yapılan çalışmalar, daha yüksek tümör-zemin (T / B) 'de in vivo moleküler görüntüleme uygulamalarında 8,17,19 geleneksel antikorlara göre -ratios nanoantikorlar izin göstermiştir. Bu hedefli olmayan dokularda 23 geleneksel antikorlar dolaşımdan yavaş açıklık ve uzun tutma nispeten zayıf ve yavaş doku penetrasyonu ile ağırlıklı olarak açıklanmıştır. Ayrıca, geleneksel antikor fazla spesifik olmayan birikimi i açarGelişmiş geçirgenlik ve tutma (EPR) neden n hedef antijen-negatif tümörler 24,25 etkilemektedir. Bu durum, bilinen antikor yüksek dozlarda bu şekilde elde edilebilen maksimum tümör-zemin oranını daha da azaltmak, belirli sinyallerini değil, aynı zamanda non-spesifik sinyaller sadece artış anlamına gelir. Bunun aksine, nanoantikorlar dozunun artırılması, normal dokuda değil veya antijen negatif tümör (yayınlanmamış veriler) antijen pozitif tümörlerinin sinyalleri arttırır.
Nanoantikorlar ve konvansiyonel antikorlarla karşılaştırılması ötesinde, bağlı EPR etkisi, spesifik ve spesifik olmayan sinyallerin doğrudan bir karşılaştırma için, aynı farelerde antijen pozitif ve negatif ksenograftlarının bir bireyin kendi içindeki değerlendirme özetlemektedir. yakın kızılötesi fluorofor konjuge sondalar bize, yakın kızıl ötesi floresan görüntüleme kullanılarak yapılan in vivo ve ex vivo tek bir prob yararlanma akış sitometrisi, ve floresan mikroskobu bırakıldı. Bizim protokolleri uygulamak dışı için izin verirBu tür spesifik tümör hedefleme için yeni antikor yapıları değerlendirilmesi gibi in vivo moleküler görüntüleme deneyler, radyoaktif, son derece hassas ve ucuz bir optimizasyonu.
Bu öğretici çalışmanın amacı klinik öncesi moleküler görüntülemede yeni antikor yapılarının değerlendirilmesi için NIRF-görüntüleme kullanımını vurgulamak için.
Bu protokol, tüm deneyler, bir küçük hayvan NIRF-görüntüleme sistemi ile yapıldı, bir floresan aktive hücre ayırıcı (FACS) akış sitometresi ve konfokal mikroskop.
Protokol
NOT: Deneyler hayvanların etik kullanımı ile ilgili uluslararası kurallar çerçevesinde yapıldı ve Üniversite Tıp Merkezi, Hamburg yerel hayvan refahı komisyonu tarafından kabul edildi.
Tümör hücreleri, Fareler ve antikor yapılan hazırlanması 1.
- Lenfoma Hücreleri hazırlanması ve Bodrum Matrix aliquoting (Matrigel).
- Tümör hücrelerinin enjeksiyonundan bir gün önce steril bir ucu kutusu (1.000 ul ipuçları) ve -20 ° C derin dondurucuda uygun pipet koydu.
- 4 ° C buzdolabı O / N buz üzerinde bodrum matrisi ile şişeyi çözülme.
- Enjeksiyon gününde bir buz kovası doldurmak ve pipet, ipuçları ile birlikte bodrum matris yerleştirin ve buz üzerinde 30 G iğne ile 1 ml şırınga.
- 1.5 ml mikrosantrifüj tüpleri içinde, RPMI ortamı, 100 ul lik bir hacim içinde kısım lenfoma hücreleri ve bazal matris 100 ul ile iyice karıştırın. Önceden soğutulmuş içine çizinşırıngalar ve enjeksiyon kadar buz koymak.
NOT: İyi steril tekniği kullanın ve buz üzerinde bodrum matris tıkanmasını önlemek için bütün zaman çalışmak.
- Fareler Hazırlık
- 8-10 haftalık atimik çıplak farelere (NMRI- Foxn1 n u) kullanın.
- Bağırsak otofloresansı önce in vivo görüntüleme 1 hafta için bir yonca-serbest diyet fareler tutmak azaltmak için.
- Lenfoma enjeksiyon için hücreler bir indüksiyon odasında 2% izofluran ile etkilemek için fareler uyutmak. Bir izofloran manifoldu kullanılarak prosedür süresince% 1-2 izofluran koruyun.
- Omuz yanları içine deri lenfoma hücrelerini enjekte edilir. Doğrudan içi bireysel karşılaştırma için sırasıyla, sağ ve sol tarafta antijen-pozitif ve negatif antijen-hücreleri enjekte.
- Fare cilt çimdik ve fare vücuttan uzak çekmek için bir başparmak ve işaret parmağı kullanın. Yavaş yavaş ve eşit enjektederinin altında hücrelerin tek bir küme oluşturarak parmakları tarafından oluşturulan kese. temel matris yerine enjekte hücreleri kalmasına yardımcı olur.
- Antikor Yapıların Hazırlanması
- Üreticinin talimatlarına uygun olarak bir floresan boya AlexaFluor-680 (AF680) (eksitasyon dalga boyu = 679 nm, emisyon dalga boyu = 702 nm), bir ticari olarak temin edilebilen bir protein etiketleme kiti ile monoklonal antikorlar ve tek alanlı nanoantikorlar etiketleyin. 15.720 mol -1 cm -1 ve 203.000 mol -1 cm -1, sırasıyla molar tükenme katsayıları kullanılarak nanobody ve geleneksel antikor başına boyaların sayısını hesaplayın. SDS-PAGE boyutu fraksiyonlaşması ve Coomassie parlak mavi boya ile antikor yapıları saflığını değerlendirin.
- Gerçek görüntüleme çalışmalarında önce in vitro bir dizi deney yapılarak etiketli konjugelerin özgünlüğünü olun. Etiketli An özgünlüğünü testtibody bloke çalışmaları ile, in vitro olarak oluşturur ve spesifik olmayan izotip 8,20 kontrol eder.
NOT: adımda antijen-negatif ve antijen-pozitif hücreler (veya farklı hücreler hatları) için 1.2.4 hücre sayıları farklı büyüme oranlarına göre adapte edilmesi gerekebilir. Bu deneyler için, 0.5x10 6 DC27.10 ARTC2 negatif ve 1.5x10 6 DC27.10 ARTC2 pozitif hücreler, benzer büyüklükteki tümörlerin elde edilmesi için kullanılmıştır. Aşama 1.3.1 fluorophores antikor probları etiketleme ve etiketleme etkinliğinin yöntemde, kullanılan etiketleme kiti göre farklı olabilir.
2. In vivo görüntüleme
- 50 ug 2 boyalar / molekülü tümörlerin çapı ~ 8 mm 'ye ulaşmak zaman 7-9 gün sonra, AlexaFluor680 50 ug intravenöz fare kuyruk damarından (mAb AF680, 200 ul serum fizyolojik bir hacimde olan antikor yapılarını etiketli enjekte ≈ ~ 4 ^ 14 fluorokromun ≈ -0.8 ug fluorokromun; Nanobody-AF680: 50 μ0.3 boyalarla g / molekül ≈ ~ 5.6 ^ 14 fluorokromun ≈ ~ 1.1 ug fluorokromun).
- Görüntüleme sistemi başlatmak ve% 3 izofluran önce görüntüleme indüksiyon odasında bir XGI-8 anestezi sistemi kullanarak etkilemek için fareler uyutmak. Görüntüleme odacık izofluran manifoldu kullanılarak görüntüleme işlemi süresince% 1-2 izofluran koruyun.
- Kameraya yönelik tümörü olan ısıtılmış görüntüleme sahnede Pozisyon fareler. Ayak veya hayvanın kuyruk kısma doğru anesthetization Monitör; hayvanın her hangi bir reaksiyon anestezi çok açık olduğunu göstermektedir.
- Solunum hızını izlemek; anestezi solunum hızı artar eğer çok hafif ve çok derin solunum hızı azalmış ise, derin ya da düzensiz olduğunu. Anestezi altında iken kuruluğu önlemek için göz merhemi ile hayvanın kornealar koruyun.
- Uyarılması için 615-665 nm, emissio için 695-770 nm floresan filtre kümesi seçn ve 51 2x 512 piksel matris boyutu ile arka plan çıkarma için 580-610 nm uyarma. Orta otomatik pozlama süresini, piksel binning ayarlayın ve F / 2 durdurun.
NOT: Daha kısa pozlama süreleri daha hızlı çerçeve oranları sağlar; uzun pozlama süreleri daha hassasiyet sağlar. Binning CCD kamera piksel boyutunu kontrol eder. Binning Artan piksel boyutu, duyarlılık ve kare hızını artırır, ancak uzaysal çözünürlüğü azaltır. F / Stop kamera diyafram boyutunu ayarlar. delik boyutu tespit ışık miktarını ayarlar ve cihaz ve deney seti yukarı görüntüleme farklılık olabilir field.Note derinliğini kontrol eder. En iyi sonuçlar için üreticinin kılavuzuna başvurun.- Görüntüleme yazılımı optimize pozlama süresi ise, F / durdurma ve piksel binning hücre hattının ifade seviyesine göre. Kantitatif sonuç etkilemeden bir deney sırasında herhangi bir zamanda bu ayarları değiştirin. Alternatif olarak, Görüntü Sihirbazı yazılımı otomatik olarak belirlemesine izinparametreler.
- Görüntü enjeksiyondan önce fareler ve antikor yapıları enjeksiyonundan sonra 6 saat.
NOT: etiketleme etkinlik optimum görüntüleme sonuçları için gereken tüm dozunu etkileyebilir. Uygun görüntüleme sonuçlar için gerekli antikor yapısının Bu nedenle bir miktar ampirik olarak belirlenmelidir. Bu etiketleme etkinliği ve boyut yapısının yanı sıra, tümör modeli ve hedef antijen ekspresyonuna bağlı olarak değişebilir.
3. Hasat ve Tümörleri Hazırlanması
- Bir buz kovası doldurun ve% 4 paraformaldehit (PFA), fosfat tamponlu salin (PBS) / proteaz inhibitörü (AEBSF), ve buz üzerinde, PBS /% 0.2 sığır serum albümini (BSA) yerleştirin.
- Görüntüleme oturumu bittikten sonra,% 4 izofluran konsantrasyonu artırır. Hayvan nefes durur sonra, görüntüleme aşamasında çıkarın ve servikal dislokasyon gerçekleştirin.
- Dağı bir Strafor blok üzerinde fare ve% 70 etanol ile sprey.
- Kullanım makass ve forseps dış derisini kesip tümörleri ortaya çıkarmak için dikkatlice geri çekin. Tümör dokusu bozulmadan kalmasını sağlamak için neşter ile tümörlerin çıkarın.
- Bir neşter kullanılarak yarısında Kes tümörler. PBS / FACS için AEBSF'in analizleri ve immünohistokimya için% 4 PFA ile 50 ml tüp içinde diğer yarısı ile bir toplama tüpüne bir buçuk yerleştirin.
- Immünohistokimya için hazırlık
- 24 saat süre ile 4 ° C'de bir buzdolabı içerisinde% 4 PFA içinde tümör tutun. PBS /% 30 sakaroz ile bir tübe tümörleri aktarın ve tüpün alt tümör lavabolar kadar 4 ° C sıcaklıkta buzdolabında saklayın.
- Cryomolds için uygun parçalar halinde tümörler kesilir. Cryomolds tümörleri koyun ve tümörler kaplıdır böylece Ekim bileşiği ile doldurun.
- Kuru buz kalıpları koymak ve bileşik tamamen donmuş kadar bekleyin. Dondurulmuş tümörler -80 ° C dondurucu transfer ve immünohistokimya için saklayın.
- Kesme bir mikrotom ile 8 um bölümler tümörleri donduruldu. Standart immunhisto kullanınkimya protokol çekirdekleri görselleştirmek için kan damarlarını ve diamidino-fenilindol (DAPI) görselleştirmek için CD31-AF488 karşı antikor ile leke.
NOT: zaten floresan işaretli antikorlar içerdiğinden Tümör bölümleri ışığa çok duyarlı. Mümkün olduğunca ışık maruziyeti en aza indirmek.
- FACS analizi için hazırlanması
- Buz üzerinde petri yerleştirin ve 2.0 ml şırınga pistonu çıkartın. Hücre süzgecinden tümörü koyun ve bir neşter kullanılarak 3-4 parçaya hafifçe kesti. Petri ilk PBS dökün ve hücre süzgecinden içinde tümör püre için piston düz ucunu kullanın.
- 10 ml pipet ile tüm hücreleri yıkayın için ilk PBS ile hücre süzgeç yıkayın. 5 dakika boyunca 500 xg'de yeni bir tüp ve spin hücre süspansiyonu aktarın. Süpernatant atılır ve 10 ml PBS /% 0.2 BSA içinde tekrar süspansiyon hücreleri. Hücreleri saymak.
- 5 ml'lik bir FACS tüpü içinde Kısım 1-5 x 10 6 lenfoma hücreleri. Yine Spin hücreleri (500xg), 100 ul PBS /% 0.2 BSA içinde supernatant ve tekrar süspansiyon atın.
- İsteğe bağlı olarak, kullanarak bloğu FcR, bir anti-CD16 / 10 dakika süreyle buz üzerinde FcyR bağlanan CD32 mAb (FcgR3 / 2). Bir kez PBS ile yıkayın hücreleri /% 0.2 BSA.
- Diğer hücrelerden gelen lökositler ayırt anti-CD45-mAb ekleyin. PBS /% 0.2 BSA ile iki yıkama ve ardından karanlıkta buz üzerinde 20 dakika boyunca inkübe edin.
- Sağ propidyum iyodürle FACS analizi leke önce buz üzerinde 15 dakika düz PBS ile iki kez yıkanmasından sonra, ölü hücreleri ayırt etmek için. FACS analizi için, 150 ul içinde süspanse.
NOT: adım 3.7.4 ve 3.7.5 adım diğer antikorlar tümör varlık bağlı kullanılabilir.
4. FACS analizi
- CD45 pozitif hücreler için yolluk ve antijen-pozitif hücreler için yolluk, geniş dağılım, çiftli ayrımcılık, ölü hücrelerin dışlanma şeklinde kapısına ilgi nüfusu yolluk araçları bir dizi kullanın.
- İlk başta, kapı dışarı hücreiki parametre arsa kullanarak yan saçılım (SSC-A) karşı bir ileri dağılım (FSC-A) enkaz. Sonraki ıskarta hücre çiftlerin. Son olarak, kapı dışarı olmayan (CD45), CD45-antijen-pozitif ve ölü / hücreleri ölüyor (LD - canlı / ölü-leke).
- Tüm deneyler için aynı şablonu kullanarak Tutanak örnekleri.
NOT: donanım ve analitik yazılım kullanımı ile ilgili teknik danışmanlık için üreticinin protokolüne bakın.
5. mikroskobik analizi
- Bir yağ daldırma lens (40X objektif) bir konfokal mikroskop kullanılarak lekeli tümör cryosections analiz. AF680 Bir O-Neon 633 nm lazer uyarma, AF488 için bir Argon Lazer ve DAPI için 405-Diyot kullanın.
- Mikroskop ile uyumlu bir yazılım kullanılarak ham görüntü verileri işlemek. Background-düzeltme ve gürültü gerekirse filtreleme gerçekleştirin. Böyle, kesit kırpma yanı sıra parlaklık ve kontrast ayarlamaları gibi ek görüntü ayarlamaları yapın.
- Sonunda geTüm algılama kanalları tek bir kompozit görüntü bindirme nerate. Bireysel katmanların parlaklığını ve kontrastını ayarlayın. kompozit görüntüler hücreleri (yeşil AF488-leke) (DAPI-leke, mavi), etiketli antikor yapıları (kırmızı AF680-leke) ve kan damarlarının dağılımı lokalizasyonu gösterecektir.
İn vivo Analizi 6.
- Görüntüleme yazılımı açın görüntü dosyaları ve floresan görüntü verileri ile fotoğraf görüntü verileri birleştirerek bir bindirme görüntü oluşturmak. Belirli floresan sinyalin doku otofloresans arka plan sinyali kaldırarak görüntü ekranı optimize. Bu izleyici için özel ayarlanmış filtre ile elde edilen görüntüden ayarlanmış bir arka plan filtresi ile elde edilen görüntüyü çıkarılarak yapılabilir.
- Antijen-pozitif tümör ve antijen-negatif tümör çevresinde ilgi (ROI) aynı dairesel ölçüm bölgeleri çizin. Arka sinyal yoğunluğunu belirlemek için, dairesel bir yatırım getirisi yerleştirinfloresans sinyali (örneğin, bacak hind) düşük olması beklenmektedir, hayvanın bir bölgede.
- Tüm zaman noktalarında tüm hayvanlar için aynı ROI kullanın. Konumlandırma için, tümör marjları tanımlamak için fotoğraf siyah-beyaz ve-resimler kullanın.
- Bir ölçüm tablosunda Ekran ROI verileri. Ileri istatistiksel analizler için floresan sinyalleri daha nicel karşılaştırma sağlayan ortalama radyant verimlilik verilerini kullanın.
- Ekran ve mutlak sinyal şiddetleri gibi verileri karşılaştırmak ya da hedeflenen doku ve arka plan dokusu ölçülen yatırım getirisi verilerini kullanarak sinyal-arka oranını hesaplamak. Arka bacak belirlenen plan değeri ile tümör alım değeri bölerek tümör-zemin oranı hesaplayın.
- Kontroller olarak, aynı zamanda in vivo olarak sinyallerin özelliğinin değerlendirilmesi için etiketli izotip kontrolleri enjekte antijen negatif ve antijen pozitif aynı hayvanlarda tümörlerin yanı sıra hayvanların analiz eder.
Sonuçlar
Floresan etiketli prob farklı NIRF-görüntüleme teknikleri (Şekil 1A) birleştirilmesine olanak sağlar. Bu in vivo görüntüleme (Şekil 1B) yer alan spesifik için floresan etiketli nanoantikorlar ve monoklonal antikorları karşılaştırmak amacıyla in vivo NIRF-görüntüleme gerçekleştirmek akış sitometrisi, ve floresan mikroskobu sekans amaçlanmıştır.
Fareler in vivo görüntüleme için floresan işaretli yapıların özgüllüğünün değerlendirilmesi nanobody ve monoklonal antikor 50 ug enjekte edilmiştir. Sonuçlar, enjeksiyondan sonra 6 saat (Şekil 2) nanobody ve monoklonal antikor hem de antijen pozitif tümörlerinin belirli etiketleme göstermiştir. İB monoklonal antikor için ~ 6'ya göre nanobody için çok daha yüksek bir T / B oranı ~ 12 gösterdi antijen pozitif tümörlerinin analiz eder. Ayrıca, nanobody ise antijen negatif tümör herhangi bir spesifik olmayan sinyal gösterdimonoklonal antikor, antijen negatif tümör spesifik olmayan karıştırıcı sinyalleri göstermiştir.
Negatif tümörlerin spesifik olmayan sinyal yanında, monoklonal antikor, aynı zamanda tüm hayvanda spesifik olmayan arka plan sinyalleri endüklemişlerdir. Bu, böbrek yoluyla atılır kadar büyük olan aşırı serbest dolaşan antikorlar için olasıdır. Tersine, nanoantikorlar enjekte hayvanlar sadece küçük nanoantikorlar renal eliminasyonu nedeniyle böbreklerde nonspesifik sinyalleri gösterdi.
Sitometrisi tümör hücre süspansiyonları analiz akış enjeksiyonundan sonra AF680-konjugatları 6 saat, her iki antijen pozitif tümör hücrelerinin spesifik etiketleme göstermiştir. monoklonal antikor etiketlenir hücrelere kıyasla nanobody işaretli hücrelerin güçlü bir floresan sinyali, in vivo NIRF görüntüleme sonuçlarını yansıtmaktadır. Önemli olarak, akış sitometrik analizi iki ya da antijen negatif hücrelerin herhangi bir spesifik olmayan etiketleme olduğunu ortaya koymaktadıryapıları (Şekil 3).
Tümör cryosections floresans mikroskopisi enjeksiyonundan sonra nanobody 6 saat antijen pozitif hücrelerin güçlü ve hemen hemen homojen bir etiketleme göstermiştir. Tersine, monoklonal antikor, daha zayıf ve daha çok homojen olmayan bir boyama (Şekil 4A) göstermiştir. Antijen negatif tümör ara boşluk (Şekil 4B), geleneksel antikor göstermek spesifik olmayan dağılmış boyama enjekte ise antijen negatif tümör nanobody enjeksiyonundan sonra boyanma 6 saat göstermektedir.
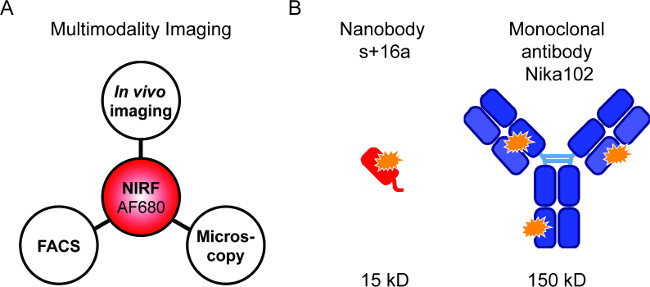
Şekil 1: floresan görüntüleme ve antikor yapıları. Akış sitometrisi ve floresan mikroskobu ardından in vivo NIRF-görüntüleme: AF680-konjugatlarının değerlendirilmesi için, (A) Görüntüleme düzeneği. (B ) AlexaFluor680 şematik nanobody s + 16a (kırmızı) ve monoklonal antikor Nika102 (mavi) etiketli. Turuncu yıldızlı AlexaFluor680 fluorochromes göstermektedir.
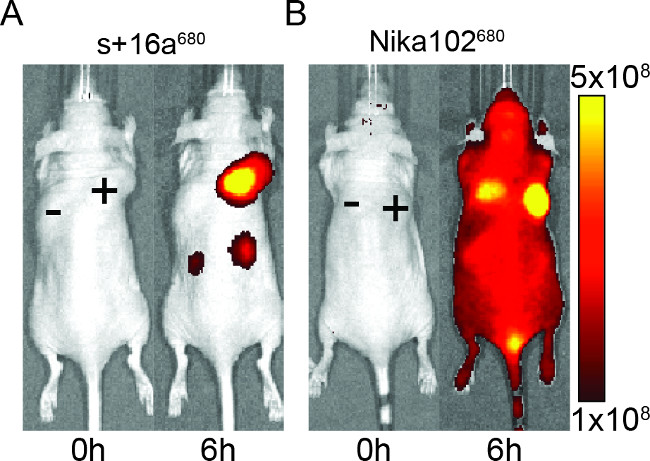
Şekil 2: in vivo NIRF görüntüleme floresans sinyali görüntüleri antijen pozitif (+) ve antijen negatif (-) nanobody s + 16a (A) ve monoklonal antikor Nika102 (B) enjekte edilmiş farelerde tümörler. . in vivo görüntüleme (0 saat) ve enjeksiyondan sonra 6 saat önce yapıldı. Sinyal yoğunluk radyant verimi (s / s / cm2 / sr) / (uW / cm2) olarak gösterilir.
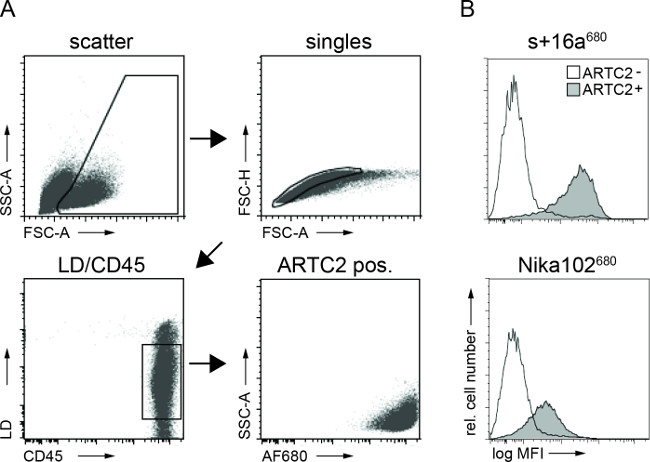
Şekil 3:FACS için ex vivo, FACS analizi, tümör hücre süspansiyonları, hücre bağlı antikor yapıları (A). Ayırıcı strateji, tümör hücrelerinin analiz eder. (B) Histogramlar, özellikle in vivo olarak tümör hücrelerine bağlı, damar içinden enjekte AF680-konjüge nanobody s + 16a ve antikor Nika102 miktarını gösterir. Antijen-negatif tümörleri doldurulmayan histogramlar ve antijen pozitif tümörler olarak gösterildi dolu hıstogramlar olarak gösterilir.
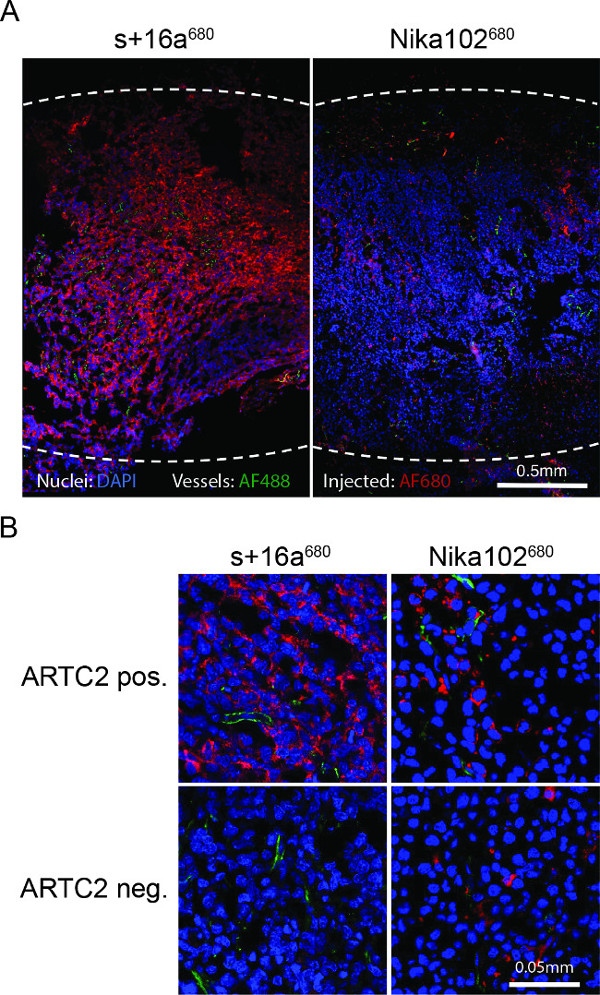
Şekil 4:. 6 saat s + 16a 680 veya Nika102 680 enjeksiyonundan sonra tüm antijen pozitif tümör cryosections ex vivo floresan mikroskobu (A) Genel floresan mikroskobu. In vivo olarak, intravenöz olarak sinyal yoğunluklarıherhangi bir ikincil-etiketleme ajanlar olmadan maruz kalanlar AF680-Konjügatlar kırmızı görüntülenir. ex vivo zıt çekirdekler yeşil, mavi ve damarlarda görüntülenir. Noktalı çizgiler tüm tümörlerin dış kenar boşluklarını göstermektedir. (B) antijen pozitif ve negatif antijen-tümörlerin Close-up floresan mikroskobu.
Tartışmalar
Bu, in vivo ve ex vivo analizler çok yönlü bir karşılaştırma için limfoma hücreleri üzerinde aynı hedefe karşı yakın kızılötesi flüorofor etiketli nanoantikorlar ve konvansiyonel monoklonal antikorlar kullanılır. Biz nanoantikorlar de lenfomaların hızlı ve spesifik in vivo tespiti için tanı araçları olarak uygun olduğunu göstermiştir.
İn vivo olarak, + 16a 680 ARTC2 pozitif ksenograftlarının hızlı ve daha özel saptanmasına olanak s. Apart in vivo iyi tümör görselleştirme için farklı kinetik, Nika102 680 büyük dezavantajı ARTC2-negatif tümörler ve spesifik olmayan arka plan sinyalleri yüksek nonspesifik sinyal oldu.
Kesilmiş tümör enjekte AF680-konjugatlarının ARTC2 negatif lenfoma hücrelerine herhangi bir spesifik olmayan bağlanma gösterdi gelen ex vivo akış sitometrik dağılmış hücrelerin analiz eder. Ex vivo floresan hemen hemen homojen güçlü ortaya çıktı venanobody 6 saat sonra tümör içinde hatta uzaktan bölgelere ulaşmak mümkün olduğunu teyit nanobody s + 16a durumunda ART2C-pozitif tümör bölümlerinde hücrelerin lı boyama. Bunun tersine, tek klonlu antikor, 6 saat sonra ARTC2-pozitif tümörlerde hücre artmış ve homojen olmayan bir lekelenme göstermiştir. Geleneksel antikor ile daha iyi görüntüleme sonuçları 24 saat ya da 48 saat sonra elde edilebilir (veri gösterilmemiştir). Iki farklı boyutlu yapıların tam bir karşılaştırma yapmak için, farklı zaman noktalarında (seri görüntüleme) ile görüntüleme, her bir yapı için en uygun görüntü zaman noktasını tanımlamak üzere gerçekleştirilebilir zorundadır.
Önceki diğer çalışmalarda olduğu gibi, burada bildirilen sonuçlar in vivo etiketli nanoantikorlar moleküler görüntüleme yüksek tümör-zemin oranları 12-15,17-19 ile hızlı ve spesifik aynı gün tümör görüntüleme sağlar vurgulamak. Tersine, geleneksel antikorlar düşük tümör-to-arka oranları ve anti-gelen nonspesifik sinyallerine nedennedeniyle vücuttan onların yavaş açıklık erken enjeksiyondan sonra jeneratör negatif tümörler. Konvansiyonel antikorlarla uygun görüntüleme sonuçları elde etmek için, bir görüntüleme süresi 24 saat ya da enjeksiyon çok ihtiyaç duyulan sonra da 48 saat işaret eder. Bu bulgular, kanıtlanmış terapötik bir fayda ile, geleneksel antikorlar moleküler görüntüleme 17,19,26 kullanıma sınırlı olduğunu ileri sürmüşlerdir önceki çalışmalar ile uyum içindedir. Nanoantikorlar bağlı dolaşımından hızlı bir temizlenme için görüntüleme amaçları için oldukça uygundur iken Bu nedenle, geleneksel antikorlar nedeniyle uzun plazma yarı-ömrü için terapötik amaçlar için oldukça uygun olabilir. Bu farklılıklar, daha büyük, konvansiyonel antikorlarla (150 kDa), fazla dolaşımdan tutulmaya devam edildiği halde daha küçük nanoantikorlar (15-17 kDa) herhangi bir aşırı hızlı bir şekilde renal eliminasyon yoluyla temizlenir olmasından kaynaklanmaktadır. Yani moleküler görüntüleme için nanoantikorlar büyük avantajı erken görüntüleme zaman noktalarında düşük arka plan sinyali regardlenjekte edilen dozun ess. Aynı gün görüntüleme sağlar ve klinik bir ortam. Tersine çevrilebilir olabilir, geleneksel antikorlar tam olarak hedef dokuya (yayınlanmamış veriler) yeterli belirli bir sinyal korurken spesifik olmayan arka plan sinyalleri en aza indirmek için titre edilmelidir.
In vivo NIRF-görüntüleme tekniği sınırlamalardan biri, genel değil ortotopik tümör modellerinin deri altı tek görüntüleme izin veren düşük penetrasyon derinliği. Ancak, bu sınırlama fareler 27 yaşam tüm vücut görüntüleme izin son zamanlarda geliştirilen tomografik fotoğraf-akustik teknikler ile deneysel bir ortamda üstesinden olabilir. Radyonüklid-aracılı görüntüleme ile karşılaştırıldığında NIRF-görüntüleme tekniği başka sınırlama doku doz değerlendirilmesidir. Ancak, nanoantikorlar ksenogref modelleri ve tam kantitatif değerlendirme pozitron emisyon tomografisi (PET) görüntüleme için radyo-etiketli olabilirizleyici biyodağılımı. Gerçekten de, NIRF görüntüleme sonuçları nanoantikorlar PET görüntülemesi için geleneksel antikor göre yeni bir çalışma ile uygun olarak sunulmuştur. Yazarlar ayrıca nanoantikorlar yüksek tümör-zemin oranları 15 ile aynı gün görüntüleme izin sonuca geldi.
Ancak, yakın-kızılötesi floresan boya AF680 ile antikor yapılarının yalnızca etiketleme in vivo, in vitro bize kapsamlı izin ve ex vivo yakın kızılötesi floresan görüntüleme karşılaştırma, akım sitometri floresan mikroskopi ve NIRF-görüntüleme kullanarak. O, radyoaktif olmayan ucuz, son derece hassas ve nispeten kolay üretmek hedeflenen problar kullanır, çünkü bu nedenle, ve biz preklinik moleküler görüntülemede yeni antikor yapılarının değerlendirilmesi için NIRF-görüntüleme tekniği kullanımını savunmaktadırlar.
Açıklamalar
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Teşekkürler
Bu çalışma, Deutsche Forschungsgemeinschaft İşbirlikçi Araştırma Merkezi 877 (Friedrich Koch-Nolte) tarafından okuldan mezun 'Enflamasyon ve rejenerasyon' Deutsche Forschungsgemeinschaft İşbirlikçi Araştırma Merkezi 841 (Alexander Lenz, Valentin KUNICK, William Fumey) olarak, tarafından desteklenen Wilhelm Sander Vakfı tarafından Werner Otto Vakfı (Peter bannas), (Peter bannas, Friedrich Koch-Nolte), tarafından ve Deutsche Forschungsgemeinschaft (Martin Trepel Çağlar'la, Friedrich Haag ve Friedrich Koch-Nolte) tarafından. Biz Vivo Optik Görüntüleme Çekirdek Tesisi ve personel Uke de istişare ve yüksek kaliteli hizmet Üniversite Kanser Merkezi Hamburg (UCCH) teşekkür ederim. Çekirdek Tesisi Deutsche Krebshilfe (Alman Kanser Yardım) hibe tarafından kısmen desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Referanslar
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır