Method Article
Validação de nanocorpo e Antibody Based
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Resumo
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introdução
No presente relatório, nós descrevemos a implementação do fluoróforo sondas marcadas do infravermelho próximo para validação de experimentos in vivo de imagem xenograft usando ex vivo citometria de fluxo e microscopia de fluorescência dos tumores de xenotransplante dissecados. Nós comparar um único nanocorpo domínio (s + 16a, 17 kDa) 1 e um anticorpo monoclonal (Nika102, 150 kDa) 2,3 dirigido para o mesmo antigénio alvo específico para in vivo no infravermelho próximo de imagens por fluorescência em um modelo de xenotransplante de linfoma. O antigénio alvo ADP-ribosiltransferase ARTC2.2 é expressa como uma GPI ancoradas na superfície celular ecto-enzima em células de linfoma de 4-9.
Nanobodies derivados de camelídeo de cadeia pesada-anticorpos só são os menores fragmentos de ligação ao antigénio disponíveis 10,11. Com apenas ~ 15 kDa, estes pequenos fragmentos de anticorpo são solúveis, e são muito estáveis eliminada da circulação pelos rins 8,10. Tpropriedades stas tornam particularmente adequado para o direcionamento específico e eficiente de antígenos tumorais in vivo 12-20. Antigénios alvos comuns de nanocorpos disponíveis são o receptor do factor de crescimento epidérmico (EGFR1 ou HER-1), factor de crescimento epidérmico humano tipo 2 (HER-2 ou CD340), antigénio carcinoembrionário (CEA) e molécula de adesão celular vascular-1 (VCAM-1 ) 21. Nanocorpo conjugados são ferramentas promissoras para a imunoterapia do cancro e tratamento de doenças inflamatórias 22.
Estudos recentes têm mostrado que nanocorpos permitir maior tumor-para-fundo (T / B) -ratios de anticorpos convencionais em aplicações de imagiologia in vivo moleculares 8,17,19. Isso é explicado, principalmente, pela penetração do tecido relativamente pobre e lenta de anticorpos convencionais, desembaraço lento da circulação e longo retenção nos tecidos não-alvo 23. Além disso, o excesso de anticorpos convencionais conduz a acumulação não específica itumores de antigénio-negativas alvo n causados pela permeabilidade aumentada e retenção (EPR) efectuar 24,25. Isto significa que as doses mais elevadas de anticorpos convencionais pode aumentar não só sinais específicos, mas também sinais não específicos, reduzindo, assim, a proporção máxima possível do tumor-para-fundo. Em contraste, o aumento da dose de nanocorpos aumenta os sinais de tumores antigénio-positivo mas não de tumores ou tecido normal de antigénio-negativo (dados não publicados).
Para além da comparação de nanocorpos e anticorpos convencionais, que descrevem intraindividual uma avaliação de xenoenxertos de antígeno positivos e negativos no mesmo ratos para comparação directa de sinais específicos e não-específicos, devido ao efeito EPR. Os near-infrared fluoróforo sondas conjugadas nos permitiu explorar uma única sonda in vivo e ex vivo usando imagens de fluorescência de infravermelho próximo, citometria de fluxo e microscopia de fluorescência. Aplicando nossos protocolos permite nãootimização radioativo, altamente sensível, e barato de experimentos in vivo de imagem molecular, tais como avaliação de novas construções de anticorpo para tumor direcionada.
O objetivo deste estudo tutorial é destacar o uso de NIRF-imaging para avaliação de novas construções de anticorpo em imagem molecular pré-clínica.
Neste protocolo, todas as experiências foram realizadas com um sistema de pequenos animais NIRF-Imaging, um classificador de células activadas por fluorescência (FACS) citómetro de fluxo, e um microscópio confocal.
Protocolo
NOTA: Os experimentos foram realizados em conformidade com as diretrizes internacionais sobre o uso ético de animais e foram aprovados pela comissão de bem-estar animal local do Centro Médico da Universidade de Hamburgo.
1. Preparação de células tumorais, ratos, e do anticorpo Construções
- Preparação de células de linfoma e de alíquotas de Basement Matrix (Matrigel).
- O dia antes da injeção de células tumorais colocar uma caixa esterilizada ponta (1.000 dicas ul) e a pipeta apropriada em freezer -20 ° C.
- Descongelar o frasco com a matriz de porão no gelo no frigorífico a 4 ° C O / N.
- No dia da injecção de encher um balde de gelo e colocar a matriz de porão junto com pipeta, pontas, e seringas de 1 ml com 30 agulhas G em gelo.
- Células de linfoma alíquota num volume de 100 ul de meio RPMI em tubos de microcentrífuga de 1,5 ml e mistura-se cuidadosamente com 100 ul da matriz basal. Elaborar em pré-arrefecidosseringas e colocar em gelo até injeção.
NOTA: Use boa técnica estéril e para trabalhar em gelo o tempo todo para evitar o entupimento da matriz porão.
- Ratos Preparação
- Use 8-10 semanas de idade ratos pelados atímicos (NMRI- Foxn1 n U).
- Para reduzir a autofluorescência do intestino em ratos manter uma dieta livre de alfafa durante 1 semana antes da imagiologia in vivo.
- Para a injecção de células de linfoma anestesiar ratos para efectuar com 2% de isoflurano em uma câmara de indução. Manter 1-2% de isoflurano durante a duração do processo usando um colector de isofluorano.
- Injetar células de linfoma subcutaneamente nos flancos do ombro. Para efeito de comparação intra-individual direta injetar células antígeno-positivo e antígeno-negativo no lado direito e esquerdo, respectivamente.
- Use o dedo polegar e indicador para apertar a pele do rato e puxe-o para longe do corpo do mouse. Injetar lentamente e uniformemente ema bolsa criada pelos dedos, a criação de um único agrupamento de células abaixo da pele. A matriz porão ajuda a manter células injetadas no lugar.
- Preparação de anticorpos Constructos
- Rotular anticorpos monoclonais e nanocorpos de domínio único com um kit de marcação de proteínas disponível comercialmente para o corante fluorescente AlexaFluor-680 (AF680) (comprimento de onda de excitação = 679 nm, comprimento de onda de emissão = 702 nm) de acordo com as instruções do fabricante. Calcula-se o número de corantes por nanocorpo e anticorpo convencional, utilizando coeficientes de extinção molar de 15.720 mol -1 cm -1 e 203.000 mol -1 cm -1, respectivamente. Avaliar a pureza de construções de anticorpo por tamanho SDS-PAGE fracionamento e azul brilhante de Coomassie mancha.
- Assegurar a especificidade dos conjugados marcados através da realização de uma série de experiências in vitro antes dos estudos de imagiologia reais. Testar a especificidade de um marcadotibody constrói in vitro por meio de estudos de bloqueio e isótipo inespecífica controla 8,20.
NOTA: No passo 1.2.4 do número de células para células de antigénio-negativas e antigénio-positivo (ou linhas de células diferentes) pode ter que ser adaptadas de acordo com diferentes taxas de crescimento. Para estas experiências, as células positivas 0,5x10 6 DC27.10 ARTC2 negativo e 1,5x10 6 DC27.10 ARTC2 foram usadas para obter os tumores de tamanho semelhante. Na etapa 1.3.1 o processo de etiquetagem e rotulagem eficácia de sondas de anticorpos com fluorophores podem diferir pelo kit rotulagem usado.
2. Imagem In Vivo
- Depois de 7-9 dias, quando os tumores atingem ~ 8 mm de diâmetro, 50 ug de injectar AlexaFluor680 marcado construções de anticorpo num volume de 200 ul de solução salina por via endovenosa na veia da cauda do rato (mAb-AF680: 50 ug com dois corantes / molécula ≈ ~ 4 ^ ~ 14 fluorocromos ≈ 0,8 ug fluorocromos; nanocorpo-AF680: 50 μcom 0,3 g de corantes / molécula ≈ ~ 5.6 ^ 14 fluorocromos ≈ ~ 1,1 ug fluorocromos).
- Inicializar o sistema de imagem e anestesiar os ratos para efetuar com 3% de isoflurano usando um XGI-8 sistema de anestesia na câmara de indução antes da imagem. Manter 1-2% de isoflurano durante a duração do procedimento de imagiologia utilizando o colector de isoflurano alojado na câmara de imagem.
- Camundongos posição sobre estágio imaging aquecida com tumores voltadas para a câmera. Monitorar o anesthetization adequada por beliscar o dedo do pé ou da cauda do animal; qualquer reação do animal indica que a anestesia é muito clara.
- Monitorar a taxa de respiração; A anestesia é muito clara, se a taxa de respiração aumenta e muito profundo, se a taxa de respiração é diminuída, profunda ou irregular. Proteja córneas do animal com uma pomada para evitar a secura e sob anestesia.
- Escolha conjuntos de filtros fluorescentes de 615-665 nm para excitação, 695-770 nm para emission, e 580-610 nm de excitação para a subtração de fundo com um tamanho de 51 2x 512 matriz de pixel. Definir o tempo de exposição ao auto, pixel binning a médio e F / Parar a 2.
NOTA: os tempos de exposição mais curtos permitir taxas de quadros mais rápidos; longos tempos de exposição proporcionar uma maior sensibilidade. Bins controla o tamanho do pixel na câmara CCD. Aumentar o binning aumenta o tamanho do pixel, sensibilidade e taxa de quadros, mas reduz a resolução espacial. F / Stop define o tamanho da abertura da lente da câmera. O tamanho da abertura controla a quantidade de luz detectada e da profundidade da field.Note que as configurações podem diferir por dispositivo e experimental set up de imagem. Consulte o manual do fabricante para obter os melhores resultados.- No software de imagem optimize o tempo de exposição, F / paragem e de pixel bins com base no nível da linha de células de expressão. Alterar essas configurações a qualquer momento durante um experimento sem impactar o resultado quantitativo. Como alternativa, deixe o software Assistente de imagem determinar automaticamenteos parâmetros.
- Camundongos imagem antes de injeção e 6 horas após a injeção de construções de anticorpo.
NOTA: A eficácia rotulagem pode afectar a dose é necessário para o resultados de imagem ideal. Por conseguinte, a quantidade de anticorpo necessária-construto para óptimos resultados de imagem tem de ser determinada empiricamente. Ela pode variar dependendo eficácia rotulagem e tamanho da construção, bem como o modelo de tumor e a expressão de antigénio-alvo.
3. Colheita e Preparação de Tumores
- Encher um balde de gelo e colocar 4%, paraformaldeído (PFA) tampão fosfato salino (PBS) / inibidor da protease (AEBSF) e PBS / 0,2% de albumina de soro bovino (BSA) em gelo.
- Uma vez que a sessão de imagem tiver terminado, aumentar a concentração de isoflurano a 4%. Depois de animais deixa respirar, retire-o da fase de imagem e executar luxação cervical.
- Mount do mouse sobre um bloco de isopor e spray com etanol 70%.
- Use tesouras e uma pinça para cortar a pele exterior e puxe-o para trás com cuidado para expor tumores. Remover tumores com bisturi para garantir tecido tumoral permanece intacta.
- Tumores cortado pela metade, utilizando um bisturi. Coloque uma metade de um tubo de recolha com PBS / AEBSF para análises de FACS e a outra metade em um tubo de 50 ml com PFA a 4% para imuno-histoquímica.
- Preparação para imuno-histoquímica
- Manter tumores em PFA a 4% no frigorífico a 4 ° C durante 24 horas. Transferir para um tubo de tumores com PBS / 30% de sacarose e manter no frigorífico a 4 ° C até os dissipadores de tumor para o fundo do tubo.
- Corte os tumores em peças adequadas para os cryomolds. Colocar os tumores em cryomolds e encher com o composto de outubro de modo que os tumores são cobertas.
- Coloque moldes em gelo seco e aguarde até que o composto é completamente congelado. Transferir tumores congelados para freezer -80 ° C e armazenar por imuno-histoquímica.
- Cut tumores congelados em secções de 8 mm com um micrótomo. Use imuno padrãoquímica protocolo para manchar com anticorpo contra CD31-AF488 para visualizar os vasos sanguíneos e diamidino-phenylindole (DAPI) para visualizar núcleos.
NOTA: secções de tumor são muito sensíveis à luz, como eles já contêm anticorpos marcados com fluorescência. Minimizar a exposição à luz tanto quanto possível.
- A preparação para a análise por FACS
- Coloque placa de petri em gelo e remover o êmbolo de uma seringa de 2,0 ml. Coloque o tumor no filtro de células e corte-o suavemente em 3-4 pedaços usando um bisturi. Verter a PBS inicial na placa de Petri e usar a extremidade plana do êmbolo para triturar o tumor dentro do coador de células.
- Lave o filtro de células com a PBS inicial para lavar todas as células com uma pipeta de 10 ml. Transferir suspensão celular em um novo tubo e centrifugação a 500 xg durante 5 min. Descartar o sobrenadante e ressuspender as células em 10 ml de PBS / BSA a 0,2%. Contagem de células.
- Alíquotas 1-5 x 10 6 células de linfoma em um tubo de 5 ml de FACS. Células girar novamente (500xg), descartar o sobrenadante e ressuspender em 100 ul de PBS / BSA a 0,2%.
- Opcionalmente, o bloco de FcR utilizando um anticorpo anti-CD16 / CD32-mAb (FcgR3 / 2) que se liga a FcyR em gelo durante 10 min. Lave as células uma vez com PBS / BSA a 0,2%.
- Adicionar anti-CD45 mAb para discriminar leucócitos a partir de outras células. Incubar durante 20 min em gelo no escuro, seguida de duas lavagens com PBS / BSA a 0,2%.
- Logo antes de análise de FACS mancha com iodeto de propídio durante 15 min em gelo para discernir as células mortas, seguidas de duas lavagens com PBS simples. Ressuspender em 150 ul para análise FACS.
NOTA: Na etapa 3.7.4 e 3.7.5 passo outros anticorpos podem ser utilizadas dependendo da entidade tumor.
4. Análise de FACS
- Utilize uma série de ferramentas de propagação para o portão população de interesse sob a forma de grande dispersão, dupleto discriminação, a exclusão de células mortas, por gating células positivas CD45, e modular para células antigénio-positivas.
- Na primeira, portão para fora da céluladetritos em uma dispersão para a frente (FSC-A) versus dispersão lateral (SSC-A), utilizando uma curva de dois parâmetros. Dobletos cela ao lado de descarte. Finalmente, portão para fora não CD45-antígeno-positivo (CD45) e morto / células morrendo (LD - ao vivo / morto-manchas).
- Amostras gravar usando o mesmo modelo para todos os experimentos.
NOTA: Consulte o protocolo do fabricante para aconselhamento técnico sobre o uso de hardware e software analítico.
5. Análise microscópica
- Analisar criosecções tumorais coradas utilizando um microscópio confocal com uma lente de imersão em óleo (objetiva de 40X). Use um He-Neon 633 nm laser de excitação do AF680, um laser de argônio para AF488, e um 405-Diode para DAPI.
- Processar os dados de imagem em bruto, utilizando um software compatível com o microscópio. Execute background-correção e filtragem de ruído, se necessário. Realize os ajustes de imagem adicionais, tais como corte, recorte, bem como ajustes de brilho e contraste.
- Finalmente geNerate uma única imagem de sobreposição composta de todos os canais de detecção. Ajustar o brilho eo contraste das camadas individuais. As imagens compostas irá mostrar a localização de células (DAPI-mancha, azul), de distribuição de construções de anticorpo marcado (AF680-mancha, vermelho) e vasos sanguíneos (AF488-mancha, verde).
6. Em Análise vivo de imagens
- Abrir arquivos de imagem em software de imagem e criar uma imagem sobreposta pela combinação de dados imagem da fotografia com dados de imagem de fluorescência. Otimizar visualização da imagem, removendo sinal de fundo autofluorescência tecido do sinal fluorescente específico. Isto pode ser feito subtraindo a imagem obtida com um filtro de fundo definida a partir da imagem obtida com o conjunto de filtros específicos para o marcador.
- Desenhar regiões de medição circulares idênticos de interesse (ROI) em torno do tumor antigénio-positivo e o tumor antigénio-negativo. Para determinar a intensidade do sinal de fundo, coloque um ROI circularem uma área do animal, onde se espera o sinal de fluorescência a ser baixo (por exemplo, anca perna).
- Use as mesmas ROIs para todos os animais de todos os pontos de tempo. Para o posicionamento, use as imagens em preto-e-branco fotográficas para identificar margens do tumor.
- Dados do ROI de exibição em uma tabela de medição. Usar dados eficiência radiante média, o que permite uma comparação mais quantitativa de sinais fluorescentes para mais análises estatísticas.
- Exibir e comparar dados como intensidades de sinal absolutos ou calcular a relação sinal-fundo usando dados do ROI medidos de tecido alvo e tecido plano. Calcula-se a razão tumor-para-fundo dividindo o valor da absorção do tumor por o valor determinado a partir do fundo do membro posterior.
- Como controlos, também analisar tumores antigénio-negativas e antigénio-positivo nos mesmos animais, bem como animais injectados com controlos isotípicos marcados para avaliar a especificidade dos sinais in vivo.
Resultados
As sondas marcadas com fluorescência para permitir a combinação de diferentes técnicas NIRF-imagem (Figura 1A). Buscou-se realizar in vivo NIRF-imagiologia, citometria de fluxo, microscopia de fluorescência e sequencialmente, a fim de comparar nanocorpos marcados fluorescentemente e anticorpos monoclonais específicos para a imagem in vivo (Figura 1B).
Os ratinhos foram injectados com 50 ug de anticorpo monoclonal nanocorpo e para avaliar a especificidade das construções marcadas com fluorescência para imagiologia in vivo. Os resultados mostraram marcação específica de tumores antigénio-positivo com ambos o anticorpo monoclonal nanocorpo e às 6 horas após a injecção (Figura 2). Analisa ROI dos tumores antigénio-positivo apresentou uma relação muito mais elevada de T / B de ~ 12 para o nanocorpo comparação com ~ 6 para o anticorpo monoclonal. Além disso, o nanocorpo não mostrou um sinal não específico em que os tumores de antigénio-negativo, ao passo que oanticorpo monoclonal mostrou sinais de confusão não específicos nos tumores antígeno-negativo.
Além disso o sinal não específico de tumores negativos, o anticorpo monoclonal também induziu sinais de fundo inespecíficas em todo o animal. Isto é provavelmente devido aos anticorpos circulantes livre excessivas, que são grandes demais para ser excretado por via renal. Contrariamente, os animais injectados com nanocorpos mostrou sinais não específicos apenas nos rins, devido à eliminação renal dos pequenos nanocorpos.
As análises de citometria de fluxo de suspensões de células tumorais mostrou marcação específica de células de tumor antigénio-positivo com ambos AF680 conjugados de 6 horas após a injecção. O sinal de fluorescência mais forte das células nanocorpo marcado em comparação com células de anticorpos monoclonais rotulados reflecte os resultados in vivo NIRF-imagiologia. Importante, as análises por citometria de fluxo revelou que não há nenhuma marcação não específica de células antigénio-negativa com qualquer um dos doisconstruções (Figura 3).
A microscopia de fluorescência de criocortes de tumor mostrou uma forte marcação e quase homogénea de células antigénio-positivo com o nanocorpo 6 h após a injecção. Contrariamente, o anticorpo monoclonal mostrou uma coloração muito fraca e não homogéneo em vez (Figura 4A). Tumores antigénio-negativo não mostram a coloração de 6 horas após a injecção do nanocorpo, ao passo que os tumores de antigénio-negativo injectado com o anticorpo mostra a coloração não específica dispersa convencional no espaço intersticial (Figura 4B).
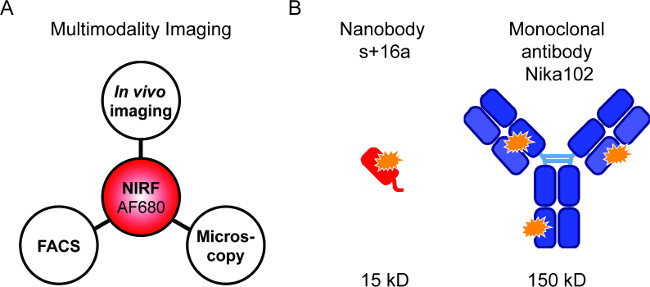
Figura 1: imaging Fluorescência e construções de anticorpo. (A) a configuração de imagiologia para avaliação de AF680 conjugados: In vivo NIRF-imagiologia seguido por citometria de fluxo e microscopia de fluorescência. (B ) Esquema de AlexaFluor680 rotulado + 16a nanocorpo s (vermelho) e anticorpo monoclonal Nika102 (azul). Laranja estrelas indicam os fluorocromos AlexaFluor680.
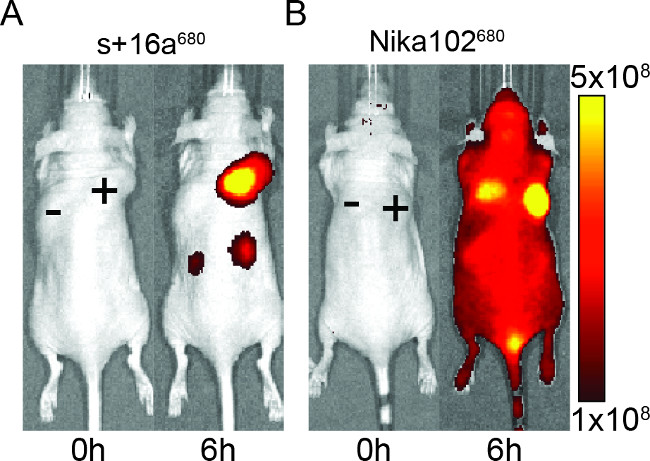
Figura 2: In vivo NIRF-imagiologia de imagens de o sinal de fluorescência de antigénio-positivo (+) e antigénio-negativa (-) tumores em ratinhos que foram injectados com + 16a nanocorpo s (A) e anticorpo monoclonal Nika102 (B). . Na imagiologia in vivo foi realizada antes (0 horas) e 6 h após a injecção. Intensidades de sinal são apresentados como a eficiência radiante (p / seg / cm 2 / SR) / (mW / cm 2).
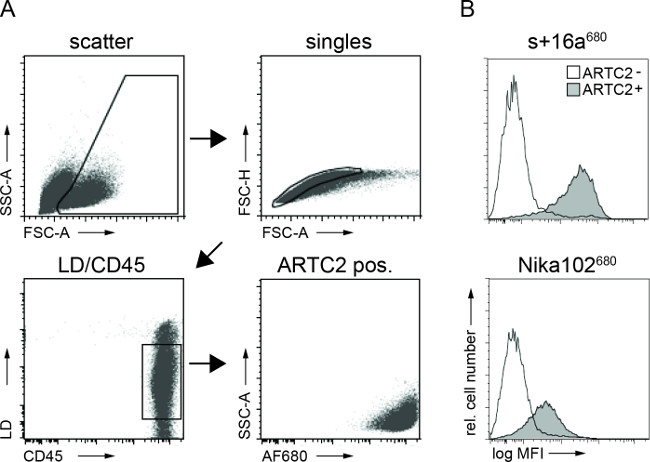
Figura 3:Análise ex vivo análises FACS de células construções de anticorpo ligado a partir de suspensões de células do tumor. (A) gating estratégia para FACS de células tumorais. (B) Os histogramas apresentar a quantidade do nanocorpo AF680 conjugado injectados intravenosamente s + 16a e Nika102 anticorpo especificamente ligado às células tumorais in vivo. Tumores Antigen-negativos são apresentados como histogramas não preenchidas e tumores antígeno-positivo são apresentados como histogramas cheias.
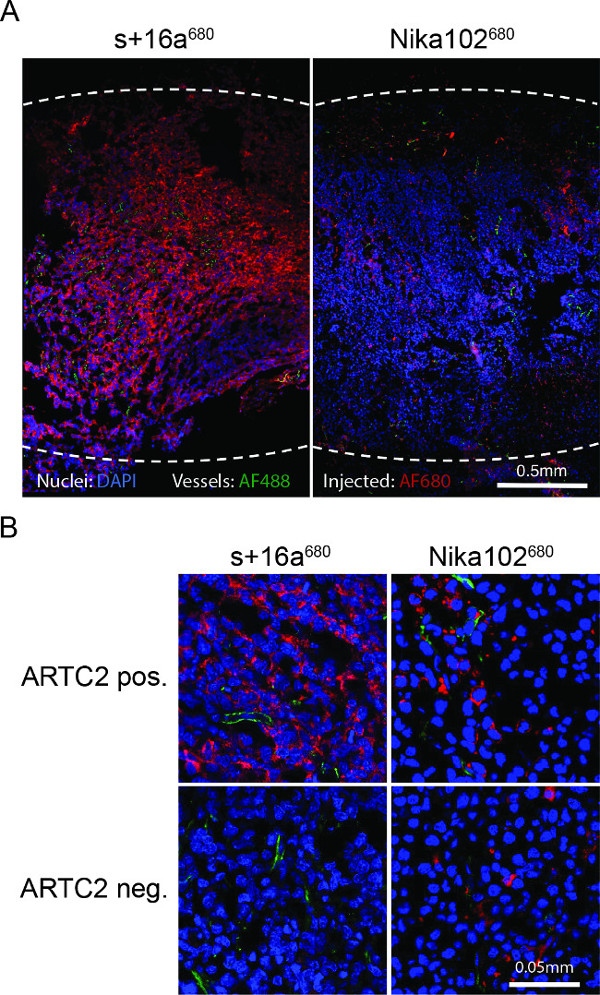
Figura 4: Ex. Microscopia de fluorescência vivo (A) Visão microscopia de fluorescência de criosecções tumorais antígeno-positivo inteiras 6 h após a injeção de s + 16a 680 ou Nika102 680. Intensidades de sinal de um in vivo por via intravenosa emprojetada AF680-conjugados sem quaisquer agentes de rotulagem secundário são exibidos em vermelho. Ex vivo núcleos contracorados são exibidos em azul e vasos em verde. As linhas a tracejado indicam as margens exteriores dos tumores inteiras. (B) a microscopia de fluorescência Close-up de tumores antígeno-positivo e antígeno-negativo.
Discussão
Utilizou-se um fluoróforo nanocorpos marcadas próximo do infravermelho e anticorpos monoclonais convencionais dirigidos contra o mesmo alvo em células de linfoma de um comparador de multimodal em vivo e ex vivo análises. Mostrámos que nanocorpos são bem adequados como ferramentas de diagnóstico para a detecção rápida e específica in vivo de linfomas.
In vivo, s + 16a 680 permitiu a detecção rápida e mais específica de xenografts ARTC2-positivo. Para além dos diferentes cinéticas para melhor visualização do tumor in vivo, a grande desvantagem de Nika102 680 foi elevado a um sinal não específico de tumores ARTC2-negativos e os sinais espontâneos não específicos.
Analisa Ex vivo de citometria de fluxo de células dispersas de tumores dissecados não mostrou nenhuma ligação não específica de células de linfoma ARTC2 negativos de injetados AF680-conjugados. Ex vivo fluorescência revelaram forte e quase homogenous coloração de células em secções de tumor ART2C-positivo em caso de + 16a nanocorpo s, confirmando que o nanocorpo foi capaz de chegar a áreas remotas, mesmo dentro do tumor após 6 h. Em contraste, o anticorpo monoclonal mostrou coloração mais fraca e não homogénea de células em tumores ARTC2-positiva após 6 h. Os melhores resultados de imagiologia com o anticorpo convencional pode ser atingida após 24 horas ou 48 horas (dados não mostrados). A fim de realizar uma comparação exaustiva de dois constructos de tamanhos diferentes, a imagem em diferentes pontos no tempo (série de imagiologia) tem de ser realizada para identificar o ponto de tempo de imagem óptima para cada constructo.
À semelhança de outros estudos anteriores, os resultados relatados aqui enfatizar que in vivo de imagem molecular com nanobodies marcados permite imagens tumor no mesmo dia rápida e específica com alta tumor-a-fundo rácios 12-15,17-19. Ao contrário, os anticorpos convencionais resultar em baixos índices de tumor-a-fundo e sinais inespecíficos de antitumores gen-negativos início após a injeção, devido à sua lenta liberação do corpo. A fim de obter resultados de imagem ideais com anticorpos convencionais, tempo de imagem aponta 24 horas ou mesmo 48 horas após a injeção são comumente necessário. Estes resultados estão de acordo com estudos anteriores que sugeriram que os anticorpos convencionais com comprovado benefício terapêutico têm utilidade limitada em imagem molecular 17,19,26. Portanto anticorpos convencionais pode ser bastante adequado para fins terapêuticos, devido à sua semi-vida no plasma longa enquanto nanocorpos são bastante adequados para fins de imagem devido à sua rápida depuração da circulação. Estas diferenças são devidas ao facto de que qualquer excesso de nanocorpos as pequenas (15-17 kDa) é rapidamente eliminado através da eliminação renal enquanto o excesso de anticorpos convencionais maiores (150 kDa) é mantido na circulação. Assim, a grande vantagem do nanobodies para imagiologia molecular é o baixo sinal de fundo em pontos de tempo de imagem primeiros regardless da dose injectada. Isso permite que mesmo imaging dia e pode ser transponível para o clínico definição. Ao contrário, os anticorpos convencionais têm de ser exatamente titulada para minimizar sinais de fundo inespecíficos, mantendo sinal específico o suficiente do tecido alvo (dados não publicados).
Uma das limitações da técnica NIRF-imagiologia, in vivo, é a baixa profundidade de penetração que permitem geralmente apenas de imagiologia por via subcutânea mas não de modelos de tumores ortotópicos. Entretanto, esta limitação pode ser superada em um ambiente experimental pelas técnicas foto-acústica tomográficos recentemente desenvolvidas que permitem geração de imagens de corpo inteiro de ratos 27 vivendo. Outra limitação da técnica NIRF-imaging é a avaliação da dose de tecido em relação à geração de imagens mediada por radionuclídeo. No entanto, os nanobodies podem ser radiomarcados para a tomografia por emissão de pósitrons (PET) de modelos de xenotransplante e avaliação quantitativa exata debiodistribuição traçador. De fato, os nossos resultados NIRF-imagem estão de acordo com um recente estudo que comparou nanobodies e anticorpos convencionais para imagens de PET. Os autores também chegou à conclusão de que nanobodies permitir imagens no mesmo dia com alta tumor-a-fundo rácios 15.
No entanto, apenas a rotulagem de construções de anticorpo com o infravermelho próximo AF680 corante fluorescente permitiu a exaustiva, in vitro, in vivo e ex vivo comparação infravermelho próximo imagiologia por fluorescência por citometria de fluxo, microscopia de fluorescência, e NIRF-imagiologia. Por esta razão, e porque é não radioativo, altamente sensível, barato, e usa relativamente fácil de produzir sondas específicas, defendemos o uso da técnica de NIRF-imaging para avaliação de novas construções de anticorpo em imagem molecular pré-clínica.
Divulgações
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Agradecimentos
Este trabalho foi apoiado pela escola de pós-graduação "Inflamação e regeneração" do Centro de Pesquisa Colaborativa 841 da Deutsche Forschungsgemeinschaft (Alexander Lenz, Valentin Kunick, William Fumey), pelo Centro de Pesquisa Colaborativa 877 da Deutsche Forschungsgemeinschaft (Friedrich Koch-Nolte) , pela Fundação Werner Otto (Peter Bannas), pela Fundação Wilhelm Sander (Peter Bannas, Friedrich Koch-Nolte), e pelo Deutsche Forschungsgemeinschaft (Martin Trepel, Friedrich Haag e Friedrich Koch-Nolte). Agradecemos a University Cancer Center Hamburg (UCCH) In Vivo imagens ópticas Núcleo Facility ea equipe UKE para consulta e seu serviço de alta qualidade. A Facilidade Núcleo foi apoiado em parte por doações do Deutsche Krebshilfe (German Cancer Aid).
Materiais
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Referências
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados