Method Article
Validierung der Nanobody und Antikörper-basierte
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Zusammenfassung
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Einleitung
In diesem Bericht beschreiben wir die Anwendung der im nahen Infrarot-Fluorophor-markierten Sonden für die Validierung der in vivo-Xenotransplantat-Abbildungsexperimente unter Verwendung von ex vivo Durchflußzytometrie und Fluoreszenzmikroskopie der sezierten Xenograft. Vergleicht man eine einzelne Domäne Nanobody (s + 16a, 17 kDa) 1 und einem monoklonalen Antikörper (Nika102, 150 kDa) 2,3 auf den gleichen Zielantigen für bestimmte in vivo gerichtet Nahinfrarot-Fluoreszenzabbildung in einem Lymphom-Xenotransplantat-Modell. Das Zielantigen ADP-ribosyltransferase ARTC2.2 als GPI-verankerten Zelloberfläche Ekto-Enzyms durch Lymphomzellen 4-9 exprimiert.
Nanobodies von Kameliden abgeleiteten Schwerketten-Antikörper nur sind die kleinsten verfügbaren antigenbindende Fragmente 10,11. Mit nur ca. 15 kDa, diese kleine Antikörperfragmente löslich, sehr stabil und über die Nieren aus dem Verkehr 8,10 gelöscht. Tiese Eigenschaften machen sie besonders geeignet für die spezifische und effiziente Ausrichtung der Tumorantigene in vivo 12-20. Common Antigen Ziele verfügbaren Nanobodies sind die epidermalen Wachstumsfaktor-Rezeptor (EGFR1 oder HER-1), den humanen epidermalen Wachstumsfaktor-Typ 2 (HER-2 oder CD340), carcinoembryonales Antigen (CEA) und das vaskuläre Zelladhäsionsmolekül-1 (VCAM-1 ) 21. Nanobody Konjugate sind vielversprechende Werkzeuge für die Immuntherapie von Krebs und Behandlung von entzündlichen Erkrankungen 22.
Jüngste Studien haben gezeigt, dass Nanobodies ermöglichen höhere Tumor-zu-Hintergrund (T / B) -ratios als herkömmliche Antikörper in in vivo-Anwendungen der molekularen Bildgebung 8,17,19. Dies wird vor allem durch den relativ schlechten und langsamen Gewebepenetration von konventionellen Antikörpern, langsame Clearance aus dem Kreislauf und lange Verweildauer in Nicht-Zielgewebe 23 erläutert. Außerdem Schuß konventionellen Antikörpern führt zu unspezifische Akkumulation in Ziel-Antigen-negativen Tumoren durch die erhöhte Permeabilität und Retention (EPR) hervorgerufen worden ist 24,25. Dies bedeutet, dass höhere Dosen konventioneller Antikörper können nicht nur spezifische Signale, sondern auch nicht-spezifische Signale zu erhöhen, wodurch die maximal erreichbare Tumor-zu-Hintergrund-Verhältnis. Im Gegensatz dazu eine Erhöhung der Dosis von Nano erhöht die Signale von Antigen-positiven Tumoren, aber nicht von normalen Gewebe oder Antigen-negative Tumoren (unveröffentlichte Daten).
Über den Vergleich von Nanobodies und konventionellen Antikörpern beschreiben wir eine intraindividuelle Beurteilung der Antigen-positiven und -negativen Xenotransplantaten in derselben Mäuse zum direkten Vergleich der spezifischen und unspezifischen Signale aufgrund der EPR-Effekt. Die Nah-Infrarot-Fluorophor konjugierten Sonden uns erlaubt, eine einzelne Sonde in vivo und ex vivo mit Nah-Infrarot-Fluoreszenz-Imaging auszunutzen, Durchflußzytometrie und Fluoreszenzmikroskopie. Die Anwendung unserer Protokolle ermöglicht nichtradioaktive, hochempfindliche und kostengünstige Optimierung der in vivo molekulare Bildgebung Experimente wie Evaluierung neuer Antikörperkonstrukte für bestimmte Tumor-Targeting.
Das Ziel dieses Tutorials Studie ist, die Verwendung von NIRF-Bildgebung zur Beurteilung der neuen Antikörperkonstrukte in präklinischen molekularen Bildgebung zu markieren.
In diesem Protokoll wurden alle Versuche mit einem Kleintier-NIRF-Abbildungssystem durchgeführt wird, ein Fluoreszenz-aktivierter Zellsortierer (FACS) Durchflusszytometer und einem konfokalen Mikroskop.
Protokoll
HINWEIS: Die Experimente wurden in Übereinstimmung mit internationalen Leitlinien für die ethische Nutzung von Tieren durchgeführt und wurden von der lokalen Tierschutzkommission des Universitätsklinikum Hamburg zugelassen.
1. Vorbereitung der Tumorzellen, Mäuse und -Antikörper-Konstrukten
- Vorbereitung der Lymphomzellen und Aliquotierung Keller Matrix (Matrigel).
- Am Tag vor der Injektion von Tumorzellen stellen eine sterilisierte Spitze Box (1000 ul Tipps) und die entsprechende Pipette in -20 ° C Tiefkühltruhe.
- Tauen Sie die Flasche mit dem Keller Matrix auf Eis in der 4 ° C Kühlschrank O / N.
- Am Tag der Injektion füllen einen Eiskübel und platzieren Sie den Keller Matrix zusammen mit Pipette, Spitzen und 1 ml Spritzen mit 30 G Nadeln auf Eis.
- Aliquot Lymphomzellen in einem Volumen von 100 ul RPMI-Medium in 1,5 ml Mikrozentrifugenröhrchen und sorgfältig mischen mit 100 ul Keller Matrix. Erstellen Sie in vorgekühltSpritzen und auf Eis gelegt, bis der Injektion.
HINWEIS: Verwenden Sie gute steriler Technik und auf Eis zu arbeiten die ganze Zeit, um ein Verstopfen der Keller Matrix zu verhindern.
- Mäuse Vorbereitung
- Verwenden Sie 8-10 Wochen alten athymischen Nacktmäusen (NMRI- Foxn1 n u).
- Zur Reduzierung der Autofluoreszenz des Darms zu halten Mäuse auf einem Luzerne-freie Diät für 1 Woche vor der in-vivo-Bildgebung.
- Injektionslymphomzellen anästhesieren Mäuse mit 2% Isofluran in einer Induktionskammer zu bewirken. Pflegen 1-2% Isofluran für die Dauer des Verfahrens unter Verwendung eines Isofluoran vielfältig.
- Spritzen Sie Lymphom-Zellen subkutan in die Schulter Flanken. Für die direkte intraindividuellen Vergleich zu injizieren Antigen-positive und Antigen-negative Zellen auf der rechten und linken Seite verbunden.
- Verwenden Sie einen Daumen und Zeigefinger, um die Haut der Maus kneifen und ziehen Sie sie aus dem Körper der Maus. Injizieren Sie langsam und gleichmäßig inder Beutel, die durch die Finger, die Schaffung eines einzigen Cluster von Zellen unter der Haut. Der Keller Matrix hilft halten injizierten Zellen vorhanden.
- Herstellung von Antikörper-Konstrukte
- Beschriften monoklonalen Antikörpern und Einzeldomänen-Nanobodies mit einem handelsüblichen Protein Labeling Kit zum Fluoreszenzfarbstoff AlexaFluor-680 (AF680) (Anregungswellenlänge = 679 nm, Emissionswellenlänge = 702 nm) nach der Anleitung des Herstellers. Berechnen Sie die Anzahl der Farbstoffe pro Nanokörper und herkömmliche Antikörper mit molaren Extinktionskoeffizienten von 15.720 mol -1 cm -1 und 203.000 mol -1 cm -1. Beurteilen Sie die Reinheit der Antikörperkonstrukte durch SDS-PAGE Größenfraktionierung und Coomassie-Brilliantblau-Färbung.
- Stellen Sie sicher, die Spezifität der markierten Konjugate durch die Durchführung einer Reihe von in-vitro-Experimenten vor den eigentlichen Bildgebungsstudien. Testen Sie die Spezifität der gekennzeichnetentibody Konstrukte in vitro durch blockierende Studien und unspezifische Isotypkontrollen 8,20.
HINWEIS: In Schritt 1.2.4 Zellzahlen für Antigen-negative und Antigen-positive Zellen (oder verschiedenen Zelllinien) können nach unterschiedlichen Wachstumsraten angepasst werden. Für diese Experimente wurden 0,5x10 6 DC27.10 ARTC2 negativ und 1,5x10 6 DC27.10 ARTC2 positiven Zellen verwendet werden, um Tumoren ähnlicher Grße zu erhalten. In Schritt 1.3.1 das Verfahren der Kennzeichnung und Kennzeichnung Wirksamkeit von Antikörper-Sonden mit Fluorophoren kann durch die Markierungs-Kits verwendet werden, unterscheiden.
2. In Vivo Imaging
- Nach 7-9 Tagen, wenn die Tumore ~ 8 mm Durchmesser zu erreichen, zu injizieren 50 ug AlexaFluor680 markierten Antikörper-Konstrukte in einem Volumen von 200 & mgr; l Kochsalzlösung, intravenös in die Schwanzvene der Maus (mAb-AF680: 50 ug mit 2 Farbstoffe / Molekül ≈ ~ 4 ^ 14 Fluorochrome ≈ ~ 0,8 & mgr; g Fluorochrome; Nanobody-AF680: 50 μg mit 0,3 Farbstoffe / Molekül ≈ ~ 5,6 ^ 14 Fluorochrome ≈ ~ 1,1 & mgr; g Fluorochrome).
- Initialisieren des Abbildungssystems und betäuben Mäusen mit 3% Isofluran Verwendung eines XGI-8 Anästhesiesystem in der Induktionskammer vor der Bilderzeugung zu bewirken. Pflegen 1-2% Isofluran für die Dauer der bildgebenden Verfahren unter Verwendung der Isofluran Verteiler in der Abbildungskammer aufgenommen.
- Position Mäuse auf beheizten Abbildungsstufe mit Tumoren auf die Kamera gerichtet ist. Überwachen Sie die ordnungsgemäße Betäubung durch Kneifen der Zehe oder Schwanz des Tieres; eine Reaktion des Tieres zeigt an, dass der Anästhesie ist zu hell.
- Überwachen Sie die Atemfrequenz; die Anästhesie ist zu hell, wenn die Atemfrequenz erhöht und zu tief, wenn die Atemfrequenz verringert, tief oder unregelmäßig. Schützen Sie Tier Hornhaut mit einer Augensalbe zur Trockenheit während der Narkose zu verhindern.
- Wählen Fluoreszenzfiltersätze von 615 bis 665 nm zur Anregung, 695 bis 770 nm für Emission, und von 580 bis 610 nm Anregung für Hintergrund-Subtraktion mit einem 51 2x 512 Pixel-Matrix-Größe. Stellen Sie die Belichtungszeit, um die automatische, Pixel-Binning für mittlere und F / Stopp, um 2.
HINWEIS: Kürzere Belichtungszeiten ermöglichen eine schnellere Bildraten; längere Belichtungszeiten liefern eine höhere Empfindlichkeit. Binning steuert die Pixelgröße auf dem CCD-Kamera. Die Erhöhung der Binning erhöht die Pixelgröße, Empfindlichkeit und Bildrate, sondern reduziert die räumliche Auflösung. F / Stop setzt die Größe der Kamera Blende. Die Blendenöffnung steuert die Lichtmenge festgestellt und die Tiefe der field.Note, die Einstellungen können durch bildgebende Gerät und Versuchsaufbau abweichen. Wenden Sie sich im Handbuch des Herstellers für optimale Ergebnisse.- In der Bildverarbeitungssoftware zu optimieren Belichtungszeit, F / Stop und die Pixel-Binning, bezogen auf das Expressionsniveau der Zelllinie. Änderung dieser Einstellungen jederzeit während eines Experiments ohne Einfluss auf den quantitativen Ergebnisses. Alternativ lassen Sie die Imaging-Assistenten Software automatisch ermittelndie Parameter.
- Bild Mäuse vor der Injektion und 6 Stunden nach der Injektion des Antikörperkonstrukte.
HINWEIS: Die Kennzeichnung Wirksamkeit kann die erforderliche Dosis für optimale Bildergebnisse benötigt beeinflussen. Deshalb ist die Menge des erforderlichen Antikörper-Konstrukt für eine optimale Bildergebnisse muss empirisch ermittelt werden. Es kann je nach Kennzeichnung Wirksamkeit und Größe des Konstruktes sowie die Tumormodell und dem Soll-Antigen-Expression variieren.
3. Ernte und Herstellung von Tumoren
- Füllt ein Eisbehälter und Zeit 4% Paraformaldehyd (PFA) phosphatgepufferte Kochsalzlösung (PBS) / Proteaseinhibitor (AEBSF), und PBS / 0,2% Rinderserumalbumin (BSA) auf Eis.
- Sobald die Abbildungssitzung beendet ist, erhöht die Konzentration von Isofluran zu 4%. Nach dem Tier nicht mehr atmen, nehmen Sie es von der Bildphase und führen Genickbruch.
- Montieren Sie die Maus auf einem Styropor-Block und Spray mit 70% Ethanol.
- Verwenden Scherens und einer Pinzette, um die Außenhaut geschnitten und ziehen Sie sie vorsichtig zurück, um Tumore aus. Tumoren entfernen mit Skalpell, um sicherzustellen, Tumorgewebe erhalten bleibt.
- Cut-Tumoren in der Hälfte mit einem Skalpell. Platzieren Sie die Hälfte in einem Sammelrohr mit PBS / AEBSF für FACS-Analysen und die andere Hälfte in einem 50-ml-Tube mit 4% PFA für die Immunhistochemie.
- Vorbereitung für die Immunhistochemie
- Halten Tumoren in 4% PFA im Kühlschrank bei 4 ° C für 24 Stunden. Übertragen Tumoren zu einer Röhre mit PBS / 30% Saccharose und in den Kühlschrank bei 4 ° C, bis der Tumor sinkt auf den Boden des Röhrchens.
- Schneiden Sie die Tumoren in geeignete Stücke für die cryomolds. Setzen Sie die Tumoren in cryomolds füllen und mit OCT-Verbindung, so dass die Tumoren sind abgedeckt.
- Setzen Formen auf Trockeneis und warten Sie, bis die Verbindung vollständig gefroren ist. Übertragen gefrorenen Tumoren bis -80 ° C Gefrierschrank und speichern für die Immunhistochemie.
- Cut froren Tumoren in Abschnitte von 8 um mit einem Mikrotom. Verwenden Sie Standard-immunhistochemischeChemie-Protokoll, um mit Antikörper gegen CD31-AF488 Fleck auf Blutgefäße und Diamidino-Phenylindol (DAPI) zu visualisieren, um Kerne zu visualisieren.
HINWEIS: Tumorschnitte sind sehr lichtempfindlich sind, wie sie fluoreszierend markierten Antikörper enthalten bereits. Minimieren Exposition so weit wie möglich zu beleuchten.
- Vorbereitung für die FACS-Analyse
- Zeigen Petrischale auf Eis, und entfernen Sie den Kolben aus einer 2,0-ml-Spritze. Setzen Sie den Tumor in der Zellsieb und schneiden Sie sie vorsichtig in 3-4 Stücke mit einem Skalpell. Gießen Sie den ersten PBS in der Petrischale und verwenden Sie das flache Ende des Kolbens, um den Tumor in der Zelle Sieb pürieren.
- Spülen Sie die Zelle Sieb mit der ersten PBS zu waschen alle Zellen mit einer 10 ml Pipette. Übertragen Zellsuspension in ein neues Röhrchen und Schleudern bei 500 × g für 5 min. Überstand verwerfen und die Zellen resuspendieren in 10 ml PBS / 0,2% BSA. Zählen von Zellen.
- Aliquot 1-5 x 10 6 Zellen-Lymphom in einem 5 ml FACS-Röhrchen. Spin-Zellen wieder (500· g), Überstand verwerfen und resuspendieren in 100 ul PBS / 0,2% BSA.
- Optional Block FcR Verwendung eines Anti-CD16 / CD32-mAb (FcgR3 / 2), die an Fc & ggr; für 10 min auf Eis bindet. Wash-Zellen einmal mit PBS / 0,2% BSA.
- Fügen Sie anti-CD45-mAb an Leukozyten von anderen Zellen unterscheiden. Inkubieren für 20 min auf Eis im Dunkeln, gefolgt von zwei Waschschritten mit PBS / 0,2% BSA.
- Kurz vor der FACS-Analyse mit Propidiumiodid-Färbung für 15 Minuten auf Eis, um tote Zellen, gefolgt von zwei Waschschritten mit PBS-Ebene zu erkennen. Resuspendieren in 150 & mgr; l für die FACS-Analyse.
HINWEIS: In Schritt 3.7.4 und Schritt 3.7.5 andere Antikörper kann in Abhängigkeit von der Tumorart verwendet werden.
4. FACS-Analyse
- Verwenden Sie eine Reihe von Tools zur Gating Tor der Bevölkerung von Interesse in Form von großen Streuung, Wams Diskriminierung, Ausgrenzung von abgestorbenen Zellen, Gating für CD45-positive Zellen und Gating-Antigen-positiven Zellen.
- Zunächst Tor aus ZellAblagerungen in einer Vorwärtsstreuung (FSC-A) im Vergleich zu Seitenstreulicht (SSC-A) mit einem Zwei-Parameter-Plot. Nächste Ablagezelle Dubletten. Schließlich Tor aus nicht CD45-Antigen-positiven (CD45) und Toten / sterbenden Zellen (LD - Live / Dead-Färbung).
- Nehmen Sie Proben mit der gleichen Vorlage für alle Versuche.
HINWEIS: Siehe Protokoll des Herstellers für die anwendungstechnische Beratung über den Einsatz von Hard- und Analysesoftware.
5. Die mikroskopische Analyse
- Analysieren Bunttumorgefrierschnitten mit einem konfokalen Mikroskop mit einem Öl-Immersionslinse (40X-Objektiv). Verwenden Sie einen He-Neon 633 nm Laseranregung von AF680, einem Argon-Laser für AF488 und eine 405-Diode für DAPI.
- Verarbeiten Sie die RAW-Bilddaten mit einer Software mit dem Mikroskop kompatibel. Führen Sie Hintergrund-Korrektur und Rauschfilterung, wenn nötig. Führen Sie weitere Bildeinstellungen wie zB Schneiden, Beschneiden sowie Helligkeit und Kontrast.
- Schließlich generate ein einzelnes Bild zusammengesetzte Überlagerung von allen Detektionskanäle. Stellen Sie die Helligkeit und den Kontrast der einzelnen Schichten. Die zusammengesetzten Bilder werden Lokalisierung von Zellen (DAPI-Färbung, blau), die Verteilung der markierten Antikörper-Konstrukte (AF680-Flecken, rot) und Blutgefäße (AF488-fleck, grün) zu zeigen.
6. In Vivo Imaging Analysis
- Öffnen von Bilddateien in Bildbearbeitungssoftware und erstellen Sie ein Overlay-Bild durch die Kombination von Foto-Bilddaten mit Fluoreszenzbilddaten. Zum Optimieren der Bildanzeige, indem Gewebeautofluoreszenz Hintergrundsignal aus der spezifischen Fluoreszenzsignals. Dies kann durch Subtraktion der mit einem Hintergrundfilter aus der mit dem Set, speziell für den Tracer Filter aufgenommenen Bildes eingestellt aufgenommenen Bildes durchgeführt werden.
- Zeichnen identischen kreis Messung interessierenden Bereiche (ROI) um die Antigen-positiven Tumor und Antigen-negative Tumor. Um Hintergrundsignalintensität zu bestimmen, legen Sie eine kreisförmige ROIin einem Bereich des Tieres, wo Fluoreszenzsignal wird voraussichtlich gering sein (zB Hinterbein).
- Verwenden Sie die gleichen ROIs für alle Tiere zu allen Zeitpunkten. Für die Positionierung mit Hilfe der fotografischen Schwarz-Weiß-Bilder, um Tumorränder zu identifizieren.
- Anzeige ROI-Daten in einem Messtisch. Verwenden durchschnittliche Strahlungsleistung Daten, die eine quantitative Vergleich der Fluoreszenzsignale für die weitere statistische Analysen ermöglicht.
- Anzeige und Daten als absolute Signalintensitäten zu vergleichen oder die Berechnung des Signal-zu-Hintergrund-Verhältnis mit gemessenen ROI Daten von Zielgewebe und Hintergrundgewebe. Berechnen der Tumor-zu-Hintergrund-Verhältnis durch Dividieren der Tumoraufnahme Wert von dem Hintergrundwert von der Hintergliedmaße bestimmt.
- Als Kontrollen wurden auch analysiert Antigen-negative und Antigen-positive Tumoren bei denselben Tieren als auch Tiere mit markiertem Isotypenkontrollen injiziert, um die Spezifität von Signalen in vivo zu beurteilen.
Ergebnisse
Fluoreszenzmarkierte Sonden ermöglichen die Kombination verschiedener NIRF-Bildgebungsverfahren (1A). Wir sollen, um in vivo NIRF-Abbildungsfluoreszenzmikroskopie sequentiell um fluoreszierend markierten Nanokörper und monoklonale Antikörper für die spezifische in-vivo-Bildgebung (1B) Vergleichen durchzuführen, Durchflusszytometrie und.
Mäuse wurden mit 50 ug Nanokörper und monoklonale Antikörper injiziert, um die Spezifität der fluoreszierend markierten Konstrukte für die in vivo-Bildgebung zu bewerten. Die Ergebnisse zeigten, spezifische Markierung von Antigen-positiven Tumoren mit sowohl Nanokörper und monoklonale Antikörper bei 6 Stunden nach der Injektion (Figur 2). ROI-Analysen der Antigen-positiven Tumoren zeigten eine viel höhere T / B-Verhältnis von ~ 12 für die Nanobody Vergleich zu ~ 6 für den monoklonalen Antikörper ist. Darüber hinaus zeigte die Nanokörper keine unspezifische Signal in den Antigen-negativen Tumoren, während diemonoklonale Antikörper zeigte unspezifische confounding Signale in den Antigen-negative Tumoren.
Neben dem unspezifischen Signal der negativen Tumoren, der monoklonale Antikörper auch in der gesamten Tier induzierten unspezifische Hintergrundsignale. Dies ist aufgrund übermäßigen freien zirkulierenden Antikörpern, die zu groß sind, um die Nieren ausgeschieden werden, sind wahrscheinlich. Umgekehrt Tiere mit Nanokörper injiziert zeigten unspezifische Signale nur in den Nieren durch die renale Ausscheidung der kleinen Nanokörpern.
Durchflusszytometrie Analysen von Tumorzellsuspensionen zeigten spezifische Markierung von Antigen-positiven Tumorzellen sowohl mit AF680-Konjugate 6 Stunden nach der Injektion. Die stärkere Fluoreszenzsignal der Nanobody markierten Zellen gegenüber monoklonalen Antikörper markierte Zellen widerspiegelt, die in vivo NIRF-Abbildungsergebnisse. Wichtig ist, dass die durchflusszytometrische Analysen zeigen, daß es keine unspezifische Markierung von antigennegativen Zellen mit einem der beidenKonstrukte (Abbildung 3).
Die Fluoreszenzmikroskopie von Tumorgefrierschnitte zeigten eine starke und fast homogene Kennzeichnung von Antigen-positiven Zellen mit dem Nanobody 6 Stunden nach der Injektion. Umgekehrt zeigte der monoklonale Antikörper eine wesentlich schwächere und recht inhomogene Färbung (4A). Antigen-negative Tumoren zeigen keine Färbung 6 Stunden nach Injektion der Nanobody, während antigen-negativen Tumoren zur herkömmlichen Antikörper zeigen unspezifische Streu Färbung in dem Zwischenraum (4B) eingespritzt.
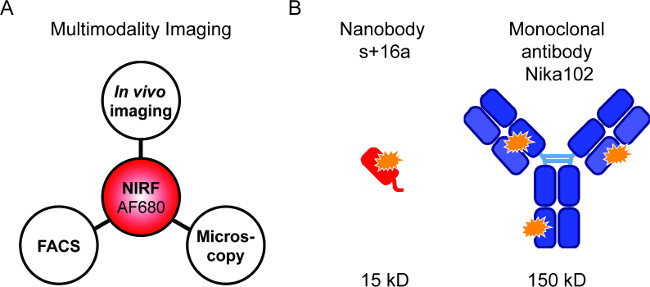
Abbildung 1: Fluoreszenz-Bildgebung und Antikörperkonstrukte. (A) Bilddarstellungsaufbau zur Auswertung AF680-Konjugate: In vivo NIRF-imaging gefolgt von Durchflußzytometrie und Fluoreszenzmikroskopie. (B ) Schematische Darstellung der AlexaFluor680 beschriftet Nanobody s + 16a (rot) und monoklonale Antikörper Nika102 (blau). Orange Sterne zeigen die AlexaFluor680 Fluorochrome.
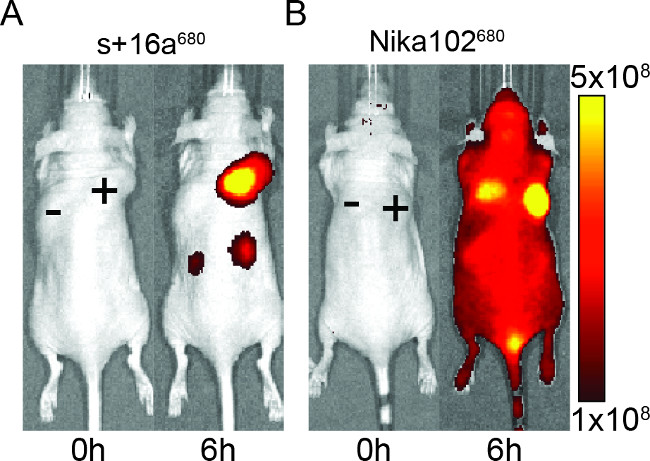
Abbildung 2: In vivo NIRF-Abbildungsbilder des Fluoreszenzsignals von Antigen-positiven (+) und Antigen-negative (-) Tumoren in Mäusen, die mit Nanobody s + 16a (A) und monoklonale Antikörper Nika102 (B) injiziert wurden. . In-vivo-Bildgebung wurde vor (0 h) und 6 h nach der Injektion durchgeführt. Signalintensitäten werden als Strahlungsleistung (p / sec / cm 2 / sr) / (& mgr; W / cm 2) dargestellt.
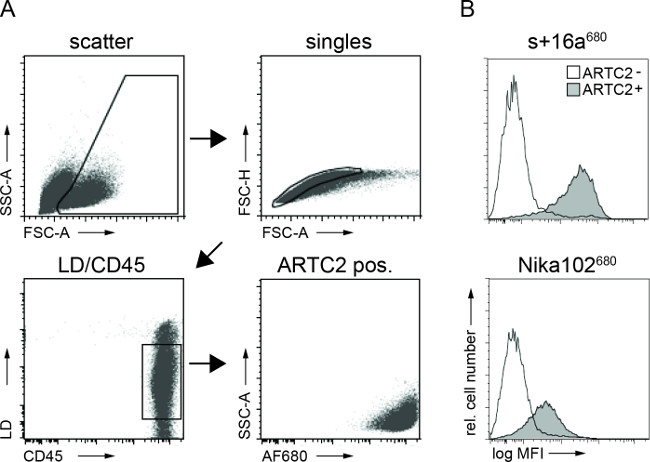
Abbildung 3:Ex vivo FACS Analysen der Zelle gebundenen Antikörperkonstrukte die aus Tumorzellsuspensionen. (A) Gating Strategie für FACS-Analysen von Tumorzellen. (B) Histogramme zeigen die Menge des intravenös injiziert AF680-konjugierten Nanobody s + 16a und Antikörper Nika102 spezifisch an die Tumorzellen in vivo gebunden. Antigen-negative Tumoren werden als ungefüllte Histogramme und Antigen-positiven Tumoren angezeigt sind als ausgefüllte Histogramme dargestellt.
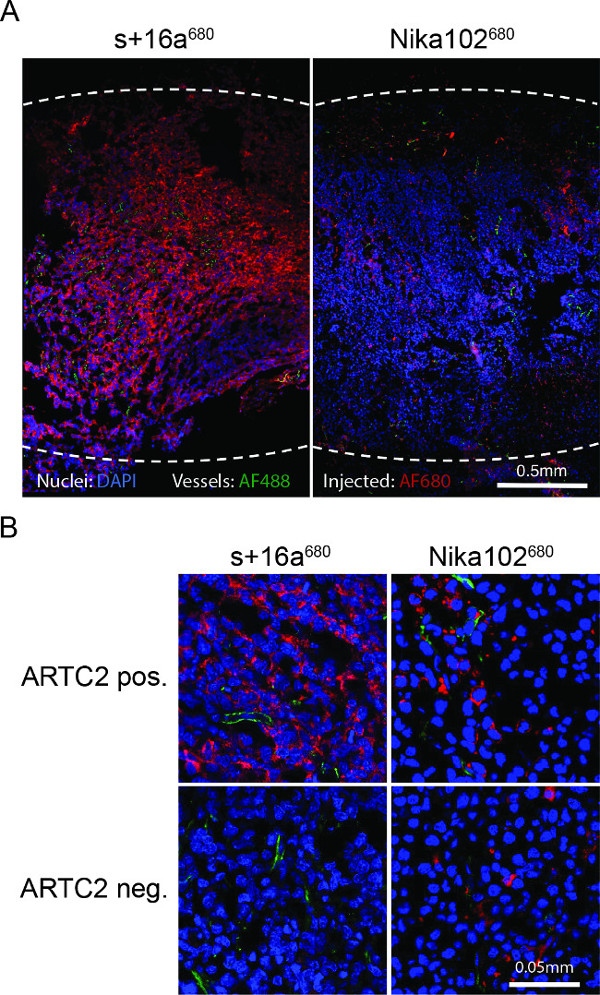
Abb. 4: Ex-vivo-Fluoreszenzmikroskopie (A) Übersicht Fluoreszenzmikroskopie der gesamte Antigen-positiven Tumor Kryoschnitte 6 Stunden nach der Injektion von s + 16a 680 oder Nika102 680. Signalintensitäten des in vivo intravenöszogen AF680-Konjugate ohne Sekundär-Markierungsmittel werden in rot angezeigt. Ex vivo gegengefärbt Kerne sind blau und Behälter grün dargestellt. Punktierte Linien zeigen äußeren Ränder der gesamten Tumoren. (B), Close-up der Fluoreszenzmikroskopie von Antigen-positiven und Antigen-negativen Tumoren.
Diskussion
Wir verwendeten im nahen Infrarot-Fluorophor markierten Nanokörper und konventioneller monoklonaler Antikörper gegen das gleiche Ziel auf Lymphomzellen gerichtet für eine multimodale Vergleich von in vivo und ex vivo-Analysen. Wir haben gezeigt, dass Nanokörper sind auch Diagnose-Tools für eine schnelle und spezifische in vivo Detektion von Lymphomen geeignet.
In vivo, s + 16a 680 erlaubt einen schnellen und spezifischen Nachweis von ARTC2-positive Fremdtransplantaten. Abgesehen von der unterschiedlichen Kinetik besten Tumor Visualisierung in vivo, ein schwerwiegender Nachteil Nika102 680 war die hohe unspezifische Signal von ARTC2-negative Tumoren und unspezifische Hintergrundsignale.
Ex vivo durchflusszytometrischen Analysen von dispergierten Zellen aus sezierten Tumoren zeigten keine spezifische Bindung zu ARTC2-negativen Lymphomzellen injiziert AF680-Konjugate. Ex vivo Fluoreszenz zeigte starke und nahezu homogenschiedenen Färbung von Zellen in ART2C-positive Tumorschnitte im Falle von Nanobody s + 16a, bestätigt, dass die Nanokörper konnte auch abgelegene Gebiete innerhalb des Tumors nach 6 h. Im Gegensatz dazu zeigte der monoklonale Antikörper schwächer und inhomogene Färbung von Zellen in ARTC2-positiven Tumoren nach 6 Std. Bessere Abbildungsergebnisse mit dem herkömmlichen Antikörpers kann nach 24 h oder 48 h erreicht werden (Daten nicht gezeigt). Um eine gründliche Vergleich zweier unterschiedlich großer Konstrukte auszuführen, abbild zu verschiedenen Zeitpunkten (serial-Bildgebung) durchgeführt, um die optimale Bilderzeugungszeitpunkt für jedes Konstrukt zu identifizieren.
Wie bei anderen früheren Studien, die hier vorgestellten Ergebnisse unterstreichen, dass in vivo molekulare Bildgebung mit markierten Nanokörper ermöglicht eine schnelle und spezifische selben Tag Tumordarstellung mit hoher Tumor-zu-Hintergrund-Verhältnisse 12-15,17-19. Umgekehrt führen herkömmliche Antikörper in niedrigen Tumor-zu-Hintergrund-Verhältnisse und unspezifische Signale von Antigen-negativen Tumoren früh nach der Injektion aufgrund ihrer langsamen Clearance aus dem Körper. Um eine optimale Bildergebnisse mit konventionellen Antikörpern zu erhalten, bildgebenden Zeitpunkten 24 Stunden oder sogar 48 Stunden nach der Injektion werden häufig benötigt. Diese Ergebnisse stehen im Einklang mit früheren Studien, die vorgeschlagen haben, dass konventionelle Antikörper mit bewährten therapeutischen Nutzen haben Dienstprogramm in der molekularen Bildgebung 17,19,26 begrenzt. Daher konventionellen Antikörpern könnte zu therapeutischen Zwecken nicht geeignet sein, die aufgrund ihrer langen Plasmahalbwertszeit während der Nanokörper sind zur Bildgebung und nicht geeignet, die aufgrund ihrer schnellen Clearance aus dem Kreislauf. Diese Unterschiede sind auf die Tatsache zurückzuführen, dass ein Überschuss der kleineren Nanobodies (15-17 kDa) rasch über die renale Elimination gelöscht, während über größeren konventionellen Antikörpern (150 kDa) in den Kreislauf zurückgehalten. So der große Vorteil von Nanokörpern für die molekulare Bildgebung ist die geringe Hintergrundsignal in frühen Bildzeitpunkten regardless der injizierten Dosis. Auf diese Weise können am gleichen Tag Bildgebung und konnte übersetzbar klinischen Umfeld. Umgekehrt können, müssen herkömmliche Antikörper genau titriert, um die unspezifische Hintergrundsignale zu minimieren, und gleichzeitig genügend spezifische Signal von der Zielgewebe (unveröffentlichte Daten) werden.
Eine der Einschränkungen der in vivo NIRF-Bildgebungstechnik ist die geringe Eindringtiefe der Regel erlaubt nur Abbildungs subkutaner aber nicht orthotope Tumormodellen. Allerdings könnte diese Einschränkung in einer experimentellen Einstellung durch die neu entwickelten tomographischen photoakustischen Techniken, die Ganzkörper-Bildgebung von lebenden Mäusen 27 ermöglichen überwunden werden. Eine weitere Einschränkung des NIRF-Bildgebungstechnik ist die Beurteilung des Gewebe Dosis verglichen mit Radionuklid-vermittelte Bildgebung. Jedoch können die Nanokörper für die Positronen-Emissions-Tomographie (PET) Bildgebung des Xenograft-Modellen und genaue quantitative Beurteilung der radioaktiv markiert werdenTracer Bioverteilung. Tatsächlich sind unsere NIRF-Abbildungsergebnisse in Übereinstimmung mit einer neueren Untersuchung, die Nanokörper und herkömmliche Antikörper für die PET-Bildgebung verglichen. Die Autoren kamen zu dem Schluss, dass Nanobodies ermöglichen selben Tag Bildgebung mit hoher Tumor-zu-Hintergrund-Verhältnisse 15.
Nur die Markierung von Antikörperkonstrukten mit der Nah-Infrarot fluoreszierenden Farbstoff AF680 erlaubt jedoch uns umfangreiche in vitro, in vivo und ex vivo Nahinfrarot-Fluoreszenzbildgebung Vergleich mittels Durchflusszytometrie, Fluoreszenzmikroskopie und NIRF-Bildgebung. Aus diesem Grund und weil es nicht radioaktives, hochempfindliche, kostengünstig und verwendet vergleichsweise einfach zu produzieren gezielte Sonden treten wir die Verwendung des NIRF-Abbildungsverfahren für die Bewertung der neuen Antikörperkonstrukte in präklinischen molekularen Bildgebung.
Offenlegungen
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Danksagungen
Diese Arbeit wurde von der Graduiertenschule "Inflammation und Regeneration" des Sonderforschungsbereich 841 der Deutschen Forschungsgemeinschaft (Alexander Lenz, Valentin Kunick, William Fumey), durch den Sonderforschungsbereich 877 der Deutschen Forschungsgemeinschaft (Friedrich Koch-Nolte) unterstützt , von der Werner Otto Stiftung (Peter Bannas), von der Wilhelm Sander-Stiftung (Peter Bannas, Friedrich Koch-Nolte) und von der Deutschen Forschungsgemeinschaft (Martin Trepel, Friedrich Haag und Friedrich Koch-Nolte). Wir danken dem Universitäts Krebscentrum Hamburg (UCCH) In-vivo-Optical Imaging Core Facility und das Personal an UKE für die Konsultation und ihre qualitativ hochwertigen Service. Die Core Facility wurde zum Teil durch Zuschüsse von der Deutschen Krebshilfe (Deutsche Krebshilfe) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Referenzen
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten