Method Article
纳米抗体和基于抗体的验证
* 这些作者具有相同的贡献
摘要
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
摘要
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
引言
在本报告中,我们描述了在体内异种移植物成像实验验证近红外荧光团标记的探针的实施通过使用离体流动的解剖异种移植肿瘤的流式细胞仪和荧光显微镜。我们比较单域纳米抗体(S + 16A,17 kDa)的1和单克隆抗体(Nika102,150 kDa)的2,3定向到特定的相同靶抗原的体内近红外在淋巴瘤异种移植模型中的荧光成像。靶抗原ADP-核糖基转移ARTC2.2表示为GPI锚定的细胞表面外生酶由淋巴瘤细胞4-9。
从骆驼科动物来源的纳米抗体重链只抗体是最小的可用抗原结合片段10,11。只有约15 kDa的,这些小抗体片段是可溶的,非常稳定且经肾脏从流通8,10清除。牛逼HESE性能使它们特别适合用于肿瘤抗原的体内 12-20具体和有效的定位。可用纳米抗体的共同抗原目标是表皮生长因子受体(EGFR1或HER-1),人表皮生长因子2型(HER-2或CD340),癌胚抗原(CEA)和血管细胞黏附分子-1(VCAM-1的)21。纳米抗体结合物是有前途的工具,用于癌症免疫治疗的炎性疾病22和治疗。
最近的研究已经表明,纳米抗体允许更高肿瘤-背景(T / B)的-ratios比在体内分子成像应用8,17,19常规抗体。这主要是说明通过常规的抗体,从流通缓慢清除率和较长的滞留时间的相对差和缓慢的组织穿透在非靶组织23。此外,过量的常规抗体导致非特异性蓄积我引起渗透性增强和保留(EPR)N靶抗原阴性肿瘤效果24,25。这意味着,较高剂量的常规抗体的可能增加,不仅特定信号,而且非特异性信号,因此降低了可达到的最大肿瘤 - 背景比。与此相反,增加纳米抗体的剂量增加的抗原阳性肿瘤的信号,但不是正常组织或抗原阴性肿瘤(未公布的数据)。
超出纳米抗体和常规抗体的比较,我们概述在同一小鼠特异性和非特异性信号的直接比较抗原阳性和阴性异种移植物的个体内评估由于EPR效应。近红外荧光团偶联的探针允许我们利用单个探针在体内和离体使用近红外荧光成像,流式细胞仪,荧光显微镜。运用我们的协议,允许非体内分子成像实验放射性的,高度敏感的,并且便宜的优化,如新的抗体构建体对特定的肿瘤靶向的评价。
本教程研究的目的是突出使用NIRF成像用于临床前分子影像新抗体构建的评价。
在这个协议中,所有的实验都用小动物NIRF-成像系统执行,荧光激活细胞分选仪(FACS)流式细胞仪,和共焦显微镜。
研究方案
注:实验按照中国的伦理利用动物与国际准则进行的,并经大学医学中心,汉堡当地的动物福利委员会。
1.准备肿瘤细胞,小鼠和抗体构建的
- 淋巴瘤细胞的制备及地下室矩阵等分(基质胶)。
- 注射肿瘤细胞前一天放了消毒的提示框(1000微升的提示),并在-20℃冷冻适当的吸管。
- 解冻瓶在4℃冰箱O / N冰地下室矩阵。
- 注射当天填写的冰桶,并将地下室矩阵一起吸,技巧和1ml注射器在冰上地下30针。
- 等分淋巴瘤细胞在100微升在1.5ml微量离心管RPMI培养基的体积和用100μl地下室矩阵小心混合。绘制成预冷注射器和雪藏,直到注射。
注:使用良好的无菌技术,并在冰工作的全部时间,以防止地下室基质堵塞。
- 小鼠制备
- 使用8-10周龄无胸腺裸鼠(NMRI- Foxn1 N个 U)。
- 为了减少肠的自发荧光之前体内显像保持小鼠上苜蓿-自由饮食1周。
- 用于注射淋巴瘤细胞麻醉小鼠在感应室,用2%异氟烷以实现。保持1-2%异氟醚的程序的使用异氟烷歧管中的持续时间。
- 皮下注射淋巴瘤细胞到肩部侧翼。对于直接个体内比较注入抗原阳性和抗原阴性细胞在右侧和左侧,分别。
- 用拇指和食指捏住鼠标的皮肤和从小鼠的身体拉远。注入缓慢而均匀地进入由手指产生的袋,创造皮下细胞的单个簇。地下室矩阵有助于保持注射的细胞到位。
- 抗体构建的制备
- 标记单克隆抗体和单结构域的纳米抗体与可商购的蛋白标记试剂盒根据制造商的说明荧光染料AlexaFluor-680(AF680)(激发波长= 679纳米,发射波长= 702纳米)。计算使用的15720摩尔-1 -1和203000摩尔-1 -1,分别的摩尔消光系数每纳米抗体和常规抗体的染料的数量。评估抗体构建由SDS-PAGE大小分离和考马斯亮蓝染色的纯度。
- 通过进行实际的成像研究之前的一系列体外试验确保标记偶联物的特异性。测试贴上的特殊性tibody构建体外通过阻断研究和非特异性同种型对照8,20。
注:在步骤对抗原阴性和抗原阳性细胞(或不同的细胞系)1.2.4细胞数量可能必须根据不同的生长率进行调整。对于这些实验,0.5×10 6 DC27.10 ARTC2阴性和1.5×10 6 DC27.10 ARTC2阳性细胞用于获得同样大小的肿瘤。在步骤1.3.1抗体探针的标记和标记的功效与荧光团的过程中可能会有所不同所使用的标记试剂盒。
2. 在体内成像
- 后7-9天,当肿瘤达到〜8mm的直径,注入50 AlexaFluor680微克标记抗体构建体中的200微升盐水的体积静脉内到尾静脉鼠标(单抗-AF680:50微克,2染料/分子≈〜4 ^ 14的荧光≈〜0.8微克的荧光纳米抗体-AF680:50μ0.3染料克/分子≈〜5.6 ^ 14的荧光≈〜1.1微克荧光)。
- 初始化成像系统和麻醉小鼠使用XGI -8-麻醉系统中的感应室3%异氟烷在成像前,以实现。保持1-2%异氟醚,使用异氟醚气歧管容纳在成像室中的成像程序的持续时间。
- 位置小鼠热成像阶段,肿瘤指向相机。监视适当麻醉按捏脚趾或动物的尾巴;动物的任何反应表明,麻醉太浅。
- 监测呼吸率;麻醉是,如果呼吸速率增加太轻太深,如果呼吸率降低,深或不规则的。保护动物的角膜与眼软膏,以防止干燥,而在麻醉下。
- 选择615-665纳米的激发,695-770纳米的emissio荧光过滤器套n和580-610 nm激发背景扣除了51 2X 512像素矩阵大小。设置曝光时间为自动,像素合并到中和F /停止2。
注:更短的曝光时间,实现更快的帧速率;更长的曝光时间提供更大的灵敏度。分级控制所述CCD照相机上的像素尺寸。提高分级增大象素尺寸,灵敏度和帧速率,但会降低空间分辨率。的F /停止设置相机镜头的光圈的大小。孔径大小控制检测到的光的量和field.Note的深度设置可以由成像设备和实验组向上不同。查阅制造商手册以获得最佳效果。- 在成像软件优化曝光时间,F /停止和像素组合基于所述细胞系的表达水平。在实验中,而不会影响定量结果改变这些设置在任何时间。另外,让成像向导软件能自动判断的参数。
- 注射前图像的小鼠和注射抗体构建体后6小时。
注:标签功效可能影响为了得到理想的成像效果所需的剂量。所需抗体构建体因此获得最佳成像效果的量,必须凭经验确定。取决于标签的有效性和尺寸的构建体,以及肿瘤模型与目标抗原的表达,可能会有所不同。
3.采收和肿瘤的制备
- 填冰桶并放置4%多聚甲醛(PFA)的磷酸盐缓冲盐水(PBS)/蛋白酶抑制剂(AEBSF)和PBS / 0.2%牛血清白蛋白(BSA)在冰上。
- 一旦成像会议结束时,增加异氟烷的浓度为4%。经过动物呼吸停止,从成像阶段取出,并进行颈椎脱位。
- 一个泡沫塑料块上安装鼠标和喷以70%的乙醇。
- 用剪刀s和钳切外皮和拉回来仔细暴露肿瘤。用解剖刀除去肿瘤,以确保肿瘤组织保持不变。
- 用手术刀切成两半肿瘤。放置一个半在用PBS / AEBSF用于FACS分析和在50毫升的管中,另一半用4%PFA进行免疫组化一个收集管。
- 免疫组化准备
- 保持肿瘤在4%PFA中的冰箱在4℃下24小时。转移的肿瘤,以用PBS / 30%蔗糖的管,并保持在冰箱4℃直至肿瘤汇到管的底部。
- 切成适当件为cryomolds肿瘤。把肿瘤cryomolds并用OCT化合物中填充,使得肿瘤都包括在内。
- 把模具上的干冰,等到该化合物是完全冻结。转移肿瘤冷冻至-80℃,冷冻库,存储免疫组化。
- 切为8μm用切片机切片冷冻肿瘤。使用标准的免疫组织化学协议染色用抗CD31-AF488抗体来可视化血管和二脒基苯基吲哚(DAPI)对细胞核可视化。
注意:肿瘤切片对光非常敏感,因为它们已经包含荧光标记的抗体。尽量减少暴露在光线尽可能多地。
- 对于FACS分析准备
- 放置培养皿在冰上,并从2.0毫升注射器卸下柱塞。把肿瘤细胞过滤网,轻轻地切成使用手术刀3-4件。倾初始的PBS在培养皿,并使用柱塞的平端的细胞过滤网内捣碎肿瘤。
- 冲洗细胞过滤与初始的PBS洗出所有的细胞用10毫升吸管。转移细胞悬液在一个新的管和旋转,在500×g离心5分钟。弃上清,悬浮细胞10毫升PBS / 0.2%BSA。计数细胞。
- 等分试样1-5×10 6个细胞淋巴瘤中5ml的FACS管。再次旋细胞(500XG),弃上清,重悬在100微升PBS / 0.2%BSA。
- 任选地,使用块的FcR的抗CD16 / CD32-单抗(FcgR3 / 2),其结合的FcγR在冰上10分钟。用PBS洗一次细胞/ 0.2%BSA中。
- 加抗CD45-单抗判别从其他细胞白细胞。孵育20分钟,在冰上在暗处,接着洗两次,用PBS / 0.2%BSA中。
- 右之前FACS分析染色用碘化丙啶在冰上15分钟,以辨别死细胞,接着洗涤两次用普通的PBS。重悬在150微升用于FACS分析。
注:在步骤3.7.4和步骤3.7.5其它抗体可根据肿瘤实体中使用。
4. FACS分析
- 使用一系列选通工具门感兴趣的人口大分散,双重歧视,排斥死细胞的形式,选通CD45阳性细胞和门控抗原阳性细胞。
- 在第一,栅极出细胞使用两参数积屑在正向散射(FSC-A)与侧向散射(SSC-A)。接下来丢弃电池双峰。最后,门掉非CD45抗原阳性(CD45)和死/垂死细胞(LD - 活/死染色)。
- 使用相同的模板所有实验记录样品。
注:请参阅制造商的协议,关于使用硬件和分析软件的技术咨询。
5.显微分析
- 分析使用共聚焦显微镜的油浸没透镜(40X物镜)染色肿瘤冷冻切片。使用AF680的他明丽633 nm激光激发下,氩激光为AF488和405二极管的DAPI。
- 处理使用与显微镜兼容的软件的原始图像数据。执行背景校正和噪音,如果必要的过滤。执行额外的图像调整,如切片,裁剪以及亮度和对比度调整。
- 最后,GE所有检测通道nerate一个单一的复合叠加图像。调整各个层的亮度和对比度。的合成图像显示细胞(DAPI染色,蓝),标记抗体构建体(AF680-染色,红色)和血管分布(AF488-染色,绿色)的定位。
6. 体内成像分析
- 在成像软件,并打开图像文件通过照片图像数据与荧光图像数据组合创建一个叠加图像。通过从特定的荧光信号中去除组织的自体荧光背景信号优化的图像显示。这可以通过减去与来自与该过滤器设置特定的示踪剂获得的图像设置背景滤波器获取的图像来完成。
- 绘制的感兴趣区域(ROI)内抗原阳性肿瘤和抗原阴性肿瘤相同圆形测定区域。为了确定背景信号强度,放置一个圆形的ROI在荧光信号预期为低( 例如 ,后腿)的动物的区域。
- 使用相同的感兴趣区对所有动物在各时间点。为定位,使用照相黑白图像,以确定肿瘤边缘。
- 在测量表显示投资回报率的数据。使用平均辐射效率的数据,这使得进行进一步的统计分析荧光信号更加定量比较。
- 显示和比较数据作为绝对信号强度或使用从目标组织和背景组织测量投资回报率数据计算出的信号 - 背景比。除以从后肢确定的背景值的肿瘤摄取值计算肿瘤 - 背景比。
- 作为对照,还分析了在相同的动物抗原阴性和抗原阳性肿瘤以及注射了标记的同种型对照以评估在体内信号的特异性动物。
结果
荧光标记的探针允许对不同NIRF成像技术( 图1A)的组合。我们的目的是为了特定体内成像( 图1B)比较荧光标记的纳米抗体和单克隆抗体进行体内 NIRF成像,流式细胞术,并依次荧光显微镜。
小鼠注射50微克的纳米抗体和单克隆抗体,以评估在体内成像的荧光标记的构建体的特异性。结果表明:对抗原阳性肿瘤与两个纳米抗体和单克隆抗体特异性标记在6小时注射后( 图2)。 ROI分析抗原 - 阳性肿瘤的表现出对纳米抗体高得多的T / B比〜12相比〜6的单克隆抗体。此外,纳米抗体显示出对抗原阴性肿瘤没有非特异性信号,而单克隆抗体显示出在抗原阴性肿瘤特异性混杂信号。
除了阴性肿瘤的非特异性信号,所述单克隆抗体也诱导非特异性背景信号在整个动物。这可能是由于过量自由循环抗体,这是太大而不能肾脏排泄。反之,动物注射纳米抗体仅表现在由于肾消除的小纳米抗体对肾脏的非特异性信号。
流式细胞仪检测肿瘤细胞悬浮液分析显示抗原阳性的肿瘤细胞这两种注射后AF680结合物6小时的特定标签。所述纳米抗体标记的细胞相比,单克隆抗体标记的细胞的较强的荧光信号反映了体内 NIRF成像的结果。重要的是,流式细胞仪分析显示,有抗原阴性细胞的没有非特异性标记与任两个构建体( 图3)。
肿瘤冷冻切片的荧光显微术显示出抗原阳性细胞的强而几乎均匀标记与注射后的纳米抗体6小时。反之,所述的单克隆抗体显示出弱得多的和相当不均匀染色( 图4A)。抗原阴性肿瘤显示注射的纳米抗体后没有染色6小时,而抗原阴性肿瘤注射在间隙空间( 图4B)的常规抗体显示非特异性散染色。
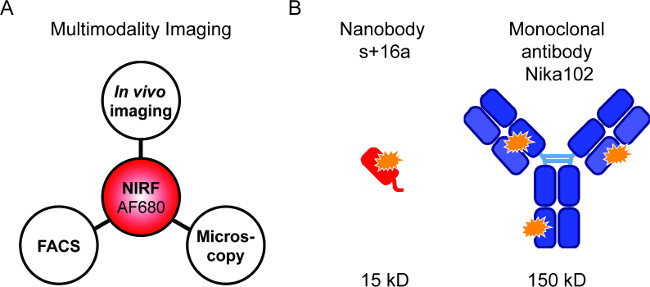
图1:Flourescence成像和抗体构建体。 (A)成像设置为AF680-结合的评价: 体内 NIRF成像,随后用流式细胞仪和荧光显微镜。 (B )AlexaFluor680示意图标记纳米抗体S + 16A(红色)和单克隆抗体Nika102(蓝色)。橙星表示AlexaFluor680荧光。
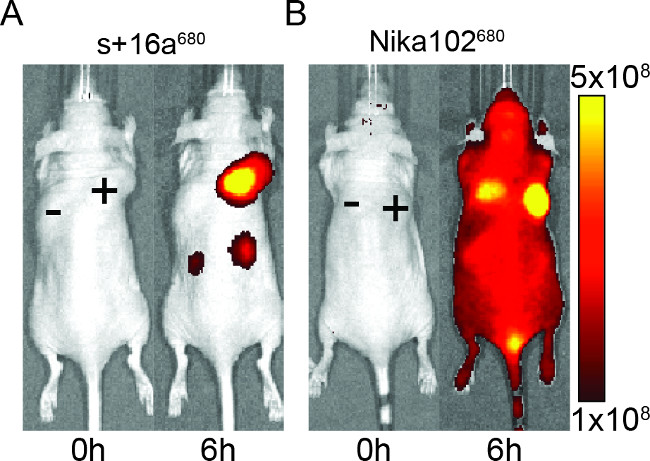
图2: 体内 NIRF成像的荧光信号的图像抗原阳性(+)和抗原阴性( - )中的小鼠的肿瘤已经注射了纳米抗体S + 16A(A)和单克隆抗体Nika102(B)中。 。被前(0 h)和注射后6小时进行活体成像。信号强度显示为辐射效率(P /秒/厘米2 / SR)/(μW/厘米2)。
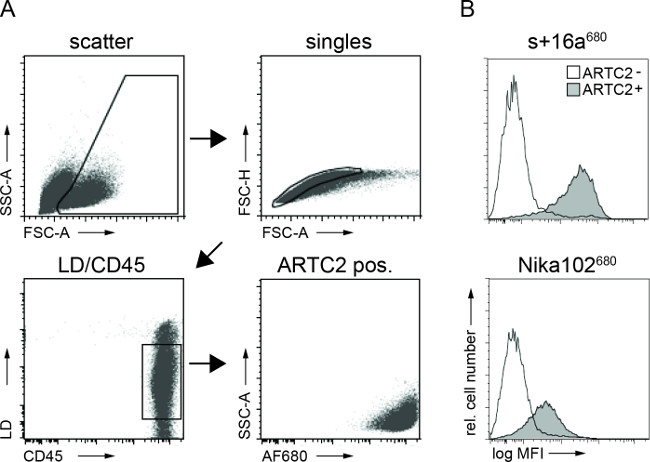
图3:体外 FACS细胞结合肿瘤细胞悬液抗体构建的分析。(A)门控策略FACS肿瘤细胞的分析。 (B)的直方图显示了静脉内注射AF680共轭纳米抗体S + 16a和抗体Nika102特异性结合到肿瘤细胞在体内的量。抗原阴性肿瘤显示为未填充的直方图和抗原阳性肿瘤显示为填充的直方图。
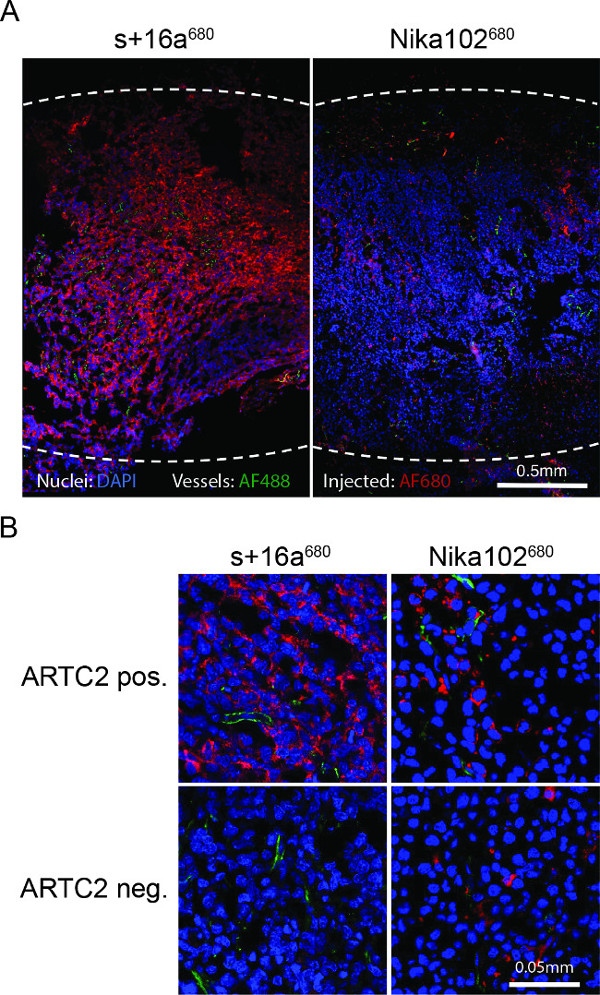
图4:整个抗原阳性肿瘤冷冻切片的注射S + 16A 680或Nika102 680后6小时体外荧光显微镜(A)中 概述的荧光显微镜。的体内静脉中的信号强度投影AF680结合物,没有任何次级标记剂显示为红色。 体外 counterstained核被以绿色显示在蓝色和船只。虚线表示整个肿瘤的外边缘。 (B)的抗原阳性和抗原阴性肿瘤特写荧光显微镜。
讨论
我们使用针对相同的靶标上的淋巴瘤细胞的近红外荧光标记的纳米抗体与常规的单克隆抗体用于在体内和离体分析多峰比较。我们发现,纳米抗体非常适合作为用于快速,特异的体内检测淋巴瘤的诊断工具。
在体内 ,S + 16A 680允许一个快速的和更具体的检测ARTC2阳性异种移植物。除了 不同的动力学在体内肿瘤的最佳可视化,Nika102 680的主要缺点是来自ARTC2阴性肿瘤和非特异性背景信号的高非特异性信号。
分散细胞的体外流式细胞仪分析来自解剖肿瘤未见非特异性结合注射AF680结合物的ARTC2阴性淋巴瘤细胞。 体外荧光强透露,几乎均质细胞ART2C阳性肿瘤切片的情况下的纳米抗体S + 16a中的OU染色,证实了纳米抗体能够6h后肿瘤内达到甚至偏远的地区。与此相反,单克隆抗体显示出更弱和不均匀染色细胞ARTC2阳性肿瘤的6小时后。 (数据未显示)与常规的抗体更好的成像结果可以在24小时或48小时后可以实现。为了执行两个不同尺寸的构建体进行了彻底的比较,成像在不同时间点(串行成像)必须被执行以确定最佳成像时间点对每个构建体。
像其他以前的研究,这里报告的结果强调在体内分子成像用标记的纳米抗体可以快速和特异性当日肿瘤成像具有高肿瘤-背景比12-15,17-19。反之,常规抗体导致低肿瘤 - 背景比和从反非特异性信号发电机阴性肿瘤注射后早期,由于其从体内缓慢的间隙。为了获得与常规抗体最佳成像的结果,成像时间点24小时或之后注射通常需要甚至48小时。这些发现符合先前的研究已经表明,与成熟的治疗益处常规抗体在分子成像17,19,26具有有限效用。因此常规抗体可能是相当适合于治疗目的的,由于它们的长的血浆半衰期而纳米抗体是相当适合用于成像目的,因为它们从循环中快速清除。这些差异是由于这样的事实,任何多余的小纳米抗体(15-17 kDa)的迅速通过肾消除清零而过剩较大常规抗体(150 kDa)的被保留在循环中。所以纳米抗体用于分子成像的主要优点是在初成像的时间点的低背景信号regardlESS的注射剂量。这允许同一天的成像,可以是可平移的临床设置。反之,常规抗体必须被精确滴定以减少非特异性背景信号,同时保持足够的特定信号从靶组织(未公布的数据)。
之一的体内 NIRF成像技术的局限性是低的穿透深度通常允许皮下仅成像但不是原位肿瘤模型。然而,这种限制可能是由最近开发的断层光声技术,允许活小鼠27的全身成像来克服在实验设置。的NIRF成像技术的另一个限制是该组织的剂量的评估相比,放射性核素介导的成像。然而,纳米抗体可以放射性标记为异种移植物模型和准确的定量评估的正电子发射断层扫描(PET)成像示踪生物分布。事实上,我们的NIRF成像结果按照最近的研究,相比纳米抗体和用于PET成像的常规抗体。作者还得出结论认为纳米抗体可以当天成像高肿瘤对背景比15。
然而,抗体构建体仅与近红外荧光染料AF680标记允许我们综合在体外 , 在体内 ,并使用流式细胞仪,荧光显微镜,及NIRF成像体外近红外荧光成像的比较。出于这个原因,而且由于它是非放射性的,高度敏感的,廉价的,并且采用相对易于产生靶向探针,我们主张用NIRF成像技术用于在临床前分子成像新抗体构建体的评价。
披露声明
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
致谢
这项工作是由研究生院"炎症和再生"德意志研究联合会的合作研究中心841(亚历山大·伦茨,瓦伦丁Kunick,威廉Fumey)的,由德意志研究联合会的合作研究中心877(弗里德里希·科赫 - 诺尔特)支持,由沃纳·奥托基金会(彼得Bannas),由威廉·桑德基金会(彼得Bannas,弗里德里希·科赫 - 诺尔特),以及由德意志研究联合会(马丁Trepel,弗里德里希·哈格和弗里德里希·科赫 - 诺尔特)。我们感谢大学癌症中心的汉堡(UCCH) 体内光学成像核心设施和工作人员UKE咨询及优质的服务。核心设备是由来自德国Krebshilfe(德国癌症援助)资助部分支持。
材料
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
参考文献
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。