Method Article
Validation des Nanobodies et Anticorps Based
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Résumé
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introduction
Dans le présent rapport, nous décrivons la mise en œuvre du proche infrarouge fluorophores sondes marquées pour la validation des expériences in vivo dans d'imagerie de xénogreffe en utilisant ex vivo cytométrie en flux et microscopie de fluorescence des tumeurs de xénogreffe disséqués. Nous comparons une seule Nanobodies de domaine (s + 16a, 17 kDa) 1 et un anticorps monoclonal (Nika102, 150 kDa) 2,3 dirigés vers le même antigène cible pour spécifique in vivo dans le proche infrarouge imagerie de fluorescence dans un modèle de lymphome de xénogreffe. L'antigène cible ADP-ribosyltransférase ARTC2.2 est exprimée en surface cellulaire ecto-enzyme GPI ancrée par des cellules de lymphome 4-9.
Nanobodies dérivés de chaîne lourde de camélidé seule anticorps sont les plus petits disponibles fragments de liaison d'antigène 10,11. Avec seulement ~ 15 kDa, ces petits fragments d'anticorps sont solubles, très stable et sont effacés de la circulation rénale 8,10. Tes propriétés les rendent particulièrement appropriés pour le ciblage spécifique et efficace des antigènes tumoraux in vivo 12-20. Les cibles antigéniques communs de Nanobodies disponibles sont le récepteur du facteur de croissance épidermique (EGFR1 ou HER-1), humaine croissance épidermique de type facteur 2 (HER-2 ou CD340), l'antigène carcino-embryonnaire (CEA) et l'adhésion cellulaire vasculaire molécule-1 (VCAM-1 ) 21. conjugués Nanobodies sont des outils prometteurs pour l'immunothérapie du cancer et le traitement des maladies inflammatoires 22.
Des études récentes ont montré que plus la tumeur nanocorps permettent à fond (T / B) -ratios que les anticorps classiques dans les applications d'imagerie moléculaire in vivo 8,17,19. Ceci se explique principalement par la pénétration de tissu relativement pauvre et lente des anticorps conventionnels, lente clairance de la circulation, et de longue rétention dans les tissus non ciblés 23. En outre, l'excès d'anticorps conventionnels conduit à l'accumulation non spécifique itumeurs antigène négative n cibles causées par la perméabilité et une meilleure rétention (EPR) Effet 24,25. Cela signifie que des doses plus élevées d'anticorps classiques peuvent augmenter non seulement les signaux spécifiques, mais également des signaux non spécifiques, ce qui réduit le rapport maximal réalisable tumeur à fond. En revanche, l'augmentation de la dose de Nanobodies augmente les signaux de tumeurs positives à l'antigène mais non de tissu normal ou des tumeurs de l'antigène négatif (données non publiées).
Au-delà de la comparaison des Nanobodies et anticorps classiques, nous présentons une évaluation intra-individuelle de xénogreffes antigène-positives que négatives dans la même souris pour une comparaison directe de signaux spécifiques et non spécifiques en raison de l'effet EPR. Les sondes conjugués fluorophores proche infrarouge nous a permis d'exploiter une seule sonde in vivo et ex vivo utilisant l'imagerie de fluorescence dans le proche infrarouge, cytométrie de flux, et la microscopie de fluorescence. L'application de nos protocoles permet nonoptimisation radioactive, très sensible, et peu coûteuse des expériences in vivo moléculaires d'imagerie telles que l'évaluation de nouvelles constructions d'anticorps spécifique de la tumeur pour le ciblage.
L'objectif de cette étude de tutoriel est de mettre en évidence l'utilisation de NIRF-imagerie pour l'évaluation de nouvelles constructions d'anticorps dans l'imagerie moléculaire préclinique.
Dans ce protocole, toutes les expériences ont été réalisées avec un système NIRF-imagerie des petits animaux, un trieur de cellules activé par fluorescence (FACS) cytomètre en flux, et un microscope confocal.
Protocole
NOTE: Des expériences ont été réalisées conformément aux lignes directrices internationales sur l'utilisation éthique des animaux et ont été approuvés par la commission de l'University Medical Center, Hambourg bien-être animal local.
1. Préparation des cellules tumorales, les souris et les constructions d'anticorps
- Préparation des cellules de lymphome et le sous-sol Aliquotage Matrix (Matrigel).
- Le jour avant l'injection des cellules tumorales mis une boîte stérilisée de pointe (1000 conseils de pi) et la pipette appropriée -20 ° C congélateur.
- Décongeler la bouteille avec la matrice du sous-sol sur la glace dans le réfrigérateur à 4 ° C O / N.
- Le jour de l'injection remplir un seau à glace et placer la matrice de sous-sol avec pipette, les pointes, et seringues de 1 ml avec 30 g d'aiguilles sur la glace.
- des cellules de lymphome de l'aliquote en un volume de 100 ul de milieu RPMI à 1,5 ml des tubes de microcentrifugation et mélanger soigneusement avec 100 pl de la matrice de sous-sol. Aspirer dans une pré-refroidiseringues et mis sur la glace jusqu'à l'injection.
REMARQUE: Utilisez la bonne technique stérile et de travailler sur la glace tout le temps pour éviter le colmatage de la matrice de sous-sol.
- Souris Préparation
- Utilisez 8-10 semaines vieille souris nude athymiques (NMRI- Foxn1 n u).
- Pour réduire autofluorescence de l'intestin garder souris sur un régime sans luzerne pour 1 semaine avant l'imagerie in vivo.
- Pour l'injection des cellules de lymphome de souris pour effectuer anesthésier avec 2% d'isoflurane dans une chambre d'induction. Maintenir 1-2% d'isoflurane pendant la durée de la procédure en utilisant un collecteur isofluorane.
- Injecter des cellules de lymphome sous-cutanée dans les flancs de l'épaule. A titre de comparaison intra-individuelle directe injecter des cellules positives à l'antigène et de l'antigène négatif sur le côté droit et gauche respectivement.
- Utilisez le pouce et l'index pour pincer la peau de la souris et tirez loin du corps de la souris. Injecter lentement et uniformément dansla poche créée par les doigts, la création d'un cluster unique des cellules sous la peau. La matrice de sous-sol aide à garder cellules injectées en place.
- Préparation des anticorps Les constructions
- Étiqueter les anticorps monoclonaux et nanocorps de domaine unique avec un kit de marquage de protéines disponibles dans le commerce pour le colorant fluorescent AlexaFluor-680 (AF680) (onde d'excitation = 679 nm, longueur d'onde d'émission = 702 nm) selon les instructions du fabricant. Calculer le nombre de colorants par nanocorps et anticorps classique en utilisant des coefficients d'extinction molaires de 15 720 mol -1 cm -1 et 203 000 mol -1 cm -1, respectivement. Évaluer la pureté des constructions d'anticorps par SDS-PAGE taille fractionnement et bleu brillant Coomassie.
- Assurer la spécificité des conjugués marqués en procédant à une série d'expériences in vitro avant que les études d'imagerie réels. Test de la spécificité d'un étiquetétibody construit in vitro grâce à des études de blocage et non spécifique isotype contrôle 8,20.
NOTE: Dans l'étape 1.2.4 nombre de cellules pour cellules présentatrices d'antigène négative et positives à l'antigène (ou des différentes lignes de cellules) peut être adapté en fonction de différents taux de croissance. Pour ces expériences, les cellules positives 0,5x10 6 DC27.10 ARTC2 négatif et 1,5x10 6 DC27.10 ARTC2 ont été utilisés pour obtenir des tumeurs de taille similaire. Dans l'étape 1.3.1 le processus de l'étiquetage et l'étiquetage efficacité des sondes anticorps avec des fluorophores peut différer par le kit de marquage utilisé.
2. In Vivo Imaging
- Après 7-9 jours, lorsque les tumeurs atteignent environ 8 mm de diamètre, 50 ug d'injecter AlexaFluor680 constructions d'anticorps marqué dans un volume de 200 ul de solution saline par voie intraveineuse dans la veine caudale de la souris (mAb-AF680: 50 ug avec deux colorants / molécule ≈ ~ 4 ^ 14 fluorochromes ≈ ~ 0,8 ug fluorochromes; Nanobody-AF680: 50 μ0,3 g de colorants / molécule ~ 5,6 ≈ 14 ^ ~ fluorochromes ≈ 1,1 ug fluorochromes).
- Initialiser le système d'imagerie et anesthésier les souris pour effectuer avec 3% d'isoflurane utilisant un système d'anesthésie XGI-8 dans la chambre d'induction avant l'imagerie. Maintenir 1-2% d'isoflurane pendant la durée de la procédure de formation d'image à l'aide du collecteur isoflurane logé dans la chambre d'imagerie.
- souris de position sur la scène de l'imagerie chauffée avec des tumeurs dirigés vers la caméra. Surveiller la bonne anesthésie en pinçant l'orteil ou de la queue de l'animal; aucune réaction de l'animal indique que l'anesthésie est trop léger.
- Surveiller le taux de respiration; l'anesthésie est trop léger si le taux de respiration est augmentée et trop profond si le taux de respiration est diminuée, profonde ou irrégulière. Protéger les cornées de l'animal avec une pommade ophtalmique pour prévenir la sécheresse sous anesthésie.
- Choisissez jeux de filtres fluorescents de 615 à 665 nm pour l'excitation, de 695 à 770 nm pour EMISSIOn, et de 580 à 610 nm pour l'excitation soustraction de fond 51 avec une taille de 2 x 512 matrice de pixels. Réglez le temps d'exposition à l'auto, pixel binning à moyen et F / STOP pour deux.
REMARQUE: Réduction des temps d'exposition permettent plus rapides des taux de trame; plus longues durées d'exposition offrent une plus grande sensibilité. Regroupement contrôle la taille de pixel sur la caméra CCD. L'augmentation de la catégorisation augmente la taille du pixel, la sensibilité, et la cadence, mais réduit la résolution spatiale. F / arrêt définit la taille de l'ouverture de l'objectif de la caméra. La taille de l'ouverture contrôle la quantité de lumière détectée et la profondeur de field.Note que les paramètres peuvent différer par le dispositif et expérimentale mise en place d'imagerie. Consultez le manuel du fabricant pour des résultats optimaux.- Dans le logiciel d'imagerie temps d'exposition d'optimiser, F / arrêt et pixel binning basés sur le niveau de la lignée cellulaire d'expression. Modifier ces paramètres à tout moment au cours d'une expérience sans impact sur le résultat quantitatif. Sinon, laissez le logiciel Assistant Imaging déterminer automatiquementles paramètres.
- souris de l'image avant l'injection et 6 heures après l'injection de constructions d'anticorps.
NOTE: L'efficacité de l'étiquetage peut influer sur la dose nécessaire requis pour des résultats optimaux d'imagerie. Par conséquent, la quantité d'anticorps requise-assemblage pour un résultat optimal d'imagerie doit être déterminée de manière empirique. Elle peut varier en fonction de l'efficacité de marquage et la taille de la construction ainsi que le modèle de tumeur et l'expression de l'antigène cible.
3. La récolte et la préparation des tumeurs
- Remplir un seau à glace et placer 4% de paraformaldehyde (PFA) une solution saline tamponnée phosphate (PBS) / inhibiteur de protease (AEBSF) et du PBS / 0,2% d'albumine de sérum bovin (BSA) sur de la glace.
- Une fois la session de formation d'image est terminée, augmenter la concentration d'isoflurane à 4%. Après animaux cesse la respiration, le retirer de la scène d'imagerie et d'effectuer dislocation cervicale.
- Mont souris sur un bloc de polystyrène et de pulvérisation avec 70% d'éthanol.
- Utilisez ciseauxs et une pince pour couper la peau extérieure et le tirer en arrière soin d'exposer les tumeurs. Enlever des tumeurs au bistouri pour assurer le tissu tumoral reste intacte.
- Tumeurs couper en deux à l'aide d'un scalpel. Placer une moitié dans un tube de prélèvement avec du PBS / AEBSF pour les analyses FACS, et l'autre moitié dans un tube de 50 ml avec 4% de PFA pour l'immunohistochimie.
- Préparation pour l'immunohistochimie
- Gardez tumeurs dans 4% PFA dans le réfrigérateur à 4 ° C pendant 24 heures. Transfert des tumeurs à un tube avec du PBS / 30% de saccharose et de garder au réfrigérateur à 4 ° C jusqu'à ce que les puits de la tumeur au fond du tube.
- Couper les tumeurs en morceaux appropriés pour les cryomoules. Mettez les tumeurs dans cryomoules et remplir avec le composé octobre afin que les tumeurs sont couverts.
- Mettez les moules sur glace sèche et d'attendre jusqu'à ce que le composé est complètement gelé. Transfert tumeurs congelés à -80 ° C congélateur et stocker pour l'immunohistochimie.
- Cut gelé tumeurs dans les sections de 8 pm avec un microtome. Utilisez immunohistochimique normeprotocole de chimie pour colorer avec un anticorps contre CD31-AF488 de visualiser les vaisseaux sanguins et diamidino-phénylindole (DAPI) pour visualiser les noyaux.
NOTE: Les sections de tumeurs sont très sensibles à la lumière, car ils contiennent déjà des anticorps marqués par fluorescence. Minimiser l'exposition à la lumière, autant que possible.
- Préparation pour l'analyse FACS
- Placez boîte de Pétri sur de la glace et enlever le piston d'une seringue 2,0 ml. Mettez la tumeur dans le tamis cellulaire et coupez-le délicatement dans 3-4 morceaux à l'aide d'un scalpel. Verser la première PBS dans la boîte de Pétri et utiliser le bout plat du piston pour écraser la tumeur dans le tamis cellulaire.
- Rincer la crépine de la cellule avec l'initiale PBS pour laver toutes les cellules avec une pipette de 10 ml. Transfert suspension de cellules dans un nouveau tube et de spin à 500 g pendant 5 min. Jeter le surnageant et remettre en suspension les cellules dans 10 ml de PBS / BSA à 0,2%. Compter les cellules.
- Aliquotes 1-5 x 10 6 cellules de lymphome dans un FACS tube 5 ml. cellules Spin nouveau (500XG), éliminer le surnageant et remettre en suspension dans 100 ul de PBS / BSA à 0,2%.
- Eventuellement, le bloc FcR utilisant un anticorps anti-CD16 / CD32 mAb-(FcgR3 / 2) qui se lie à FcyR sur de la glace pendant 10 min. Laver les cellules une fois avec du PBS / 0,2% de BSA.
- Ajouter anti-CD45-mAb de discriminer leucocytes d'autres cellules. Incuber pendant 20 min sur de la glace dans l'obscurité, suivie par deux lavages avec du PBS / 0,2% de BSA.
- Juste avant l'analyse FACS tache avec l'iodure de propidium pendant 15 min sur la glace de discerner les cellules mortes, suivi par deux lavages avec PBS plaine. Remettre en suspension dans 150 ul pour analyse FACS.
NOTE: Dans l'étape 3.7.4 et 3.7.5 étape autres anticorps peut être utilisé en fonction de l'entité de la tumeur.
4. Analyse FACS
- Utilisez une série d'outils de déclenchement à la porte la population d'intérêt sous forme de grande dispersion, la discrimination de doublet, l'exclusion des cellules mortes, gating pour les cellules positives CD45 et gating pour les cellules positives à l'antigène.
- Dans un premier temps, porte sur cellulaireles débris dans une diffusion vers l'avant (FSC-A) par rapport à la diffusion latérale (SSC-A) en utilisant un terrain à deux paramètres. Doublets de cellules de rejet suivante. Enfin, sur la porte non CD45-positives à l'antigène (CD45) et morts / cellules mourantes (LD - / morts-tache en direct).
- échantillons de disques utilisant le même modèle pour toutes les expériences.
NOTE: Consultez le protocole du fabricant pour obtenir des conseils techniques sur l'utilisation du matériel et des logiciels d'analyse.
5. Analyse microscopique
- Analyser cryosections tumorales colorées en utilisant un microscope confocal avec une lentille à immersion d'huile (objectif 40X). Utilisez un Il-Neon 633 nm excitation laser de AF680, un laser Argon pour AF488, et un 405-Diode pour DAPI.
- Traiter les données d'image RAW à l'aide d'un logiciel compatible avec le microscope. Effectuer fond de correction et de filtrage du bruit si nécessaire. Effectuez les réglages d'image supplémentaires telles que la coupe, recadrage ainsi que les réglages de luminosité et de contraste.
- Enfin generate une image composite unique de superposition de tous les canaux de détection. Régler la luminosité et le contraste des couches individuelles. Les images composites montreront localisation de cellules (DAPI-tache, bleu), la distribution de constructions anticorps marqué (AF680-taches, rouge) et les vaisseaux sanguins (AF488-taches, vert).
6. Analyse Vivo Imaging
- Ouvrir des fichiers image dans un logiciel d'imagerie et de créer une image de superposition en combinant les données d'image de photographie avec des données d'image de fluorescence. Optimiser l'affichage de l'image en éliminant autofluorescence des tissus signal de fond du signal fluorescent spécifique. Cela peut être fait en soustrayant l'image acquise avec un filtre de fond définir à partir de l'image acquise avec le filtre spécifique pour mettre le traceur.
- Dessinez régions de mesure circulaires identiques d'intérêt (ROI) autour de la tumeur antigène-positive et la tumeur de l'antigène négatif. Pour déterminer fond intensité du signal, placez un ROI circulairedans une zone de l'animal où il est prévu signal de fluorescence est faible (par exemple, la jambe de derrière).
- Utilisez les mêmes ROI pour tous les animaux à tous les points de temps. Pour le positionnement, utilisez les images en noir et blanc photographiques pour identifier les marges tumorales.
- Affichage des données ROI dans une table de mesure. Utiliser les données d'efficacité moyenne radiante, qui permet une comparaison plus quantitative des signaux fluorescents pour d'autres analyses statistiques.
- Comparer les données d'affichage et que les intensités de signaux absolus ou calculer le rapport signal sur bruit de fond en utilisant les données de mesure issues de ROI tissu cible et le tissu de fond. Calculer le rapport tumeur à fond en divisant la valeur d'absorption de la tumeur par la valeur d'arrière-plan déterminée à partir de la patte postérieure.
- Comme témoins, analyser également des tumeurs antigène-négatives et positives à l'antigène dans les mêmes animaux ainsi que des animaux injectés avec contrôles isotypiques marqués d'évaluer la spécificité des signaux in vivo.
Résultats
Des sondes marquées par fluorescence permettent la combinaison de différentes techniques d'imagerie NIRF (figure 1A). Nous avons cherché à effectuer vivo NIRF-imagerie, la cytométrie en flux et la microscopie de fluorescence de manière séquentielle afin de comparer nanocorps marqués par fluorescence et des anticorps monoclonaux spécifiques pour l'imagerie in vivo (figure 1B).
Les souris ont été injectées avec 50 ug d'anticorps monoclonal Nanobodies et d'évaluer la spécificité des produits d'assemblage marqués par fluorescence pour l'imagerie in vivo. Les résultats ont montré un étiquetage spécifique des tumeurs positives à l'antigène à la fois et nanocorps anticorps monoclonal à 6 heures après l'injection (Figure 2). ROI analyse des tumeurs positives à l'antigène a montré un rapport beaucoup plus élevé T / B d'environ 12 pour le rapport de Nanobodies ~ 6 pour l'anticorps monoclonal. En outre, le nanocorps montré aucun signal non spécifique dans les tumeurs de l'antigène négatif, alors que leanticorps monoclonal a montré des signaux de confusion non spécifiques dans les tumeurs de l'antigène négatif.
Outre le signal non spécifique des tumeurs négatives, l'anticorps monoclonal a également induit des signaux de fond non spécifique dans l'animal entier. Cela est probablement dû à des anticorps circulants gratuitement excessives, qui sont trop gros pour être excrété par les reins. Au contraire, les animaux injectés avec nanobodies signaux non spécifiques ont montré que dans les reins en raison de l'élimination rénale des petites Nanobodies.
La cytométrie en flux analyses de suspensions de cellules tumorales ont montré un marquage spécifique des cellules tumorales positives à l'antigène à la fois conjugués AF680 6 h après l'injection. Le signal de fluorescence plus forte des cellules nanobody marqué par rapport aux cellules productrices d'anticorps monoclonaux marqués reflète les résultats in vivo NIRF-imagerie. Fait important, les analyses de cytométrie en flux révèle qu'il n'y a pas marquage non spécifique des cellules présentatrices d'antigène négatif avec l'un des deuxassemblage (figure 3).
La microscopie à fluorescence des coupes cryogéniques de tumeur a montré une forte étiquetage et presque homogène de cellules positives à l'antigène avec la Nanobodies 6 h après l'injection. Au contraire, l'anticorps monoclonal a montré une coloration beaucoup plus faible et plutôt homogène (figure 4A). tumeurs antigène négatif montrent aucune coloration 6 heures après l'injection de la nanocorps, alors que les tumeurs de l'antigène négative injectés avec l'anticorps non spécifique spectacle coloration classique dispersés dans l'espace interstitiel (figure 4B).
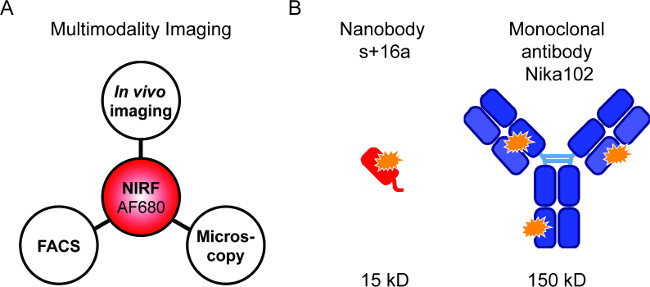
Figure 1: imagerie Flourescence et constructions d'anticorps. (A) l'installation d'imagerie pour l'évaluation de AF680-conjugués: In vivo NIRF-imagerie suivie par cytométrie en flux et la microscopie de fluorescence. (B ) Schéma de AlexaFluor680 étiqueté + 16a de la nanocorps (rouge) et anticorps monoclonal Nika102 (bleu). Orange étoiles indiquent les fluorochromes AlexaFluor680.
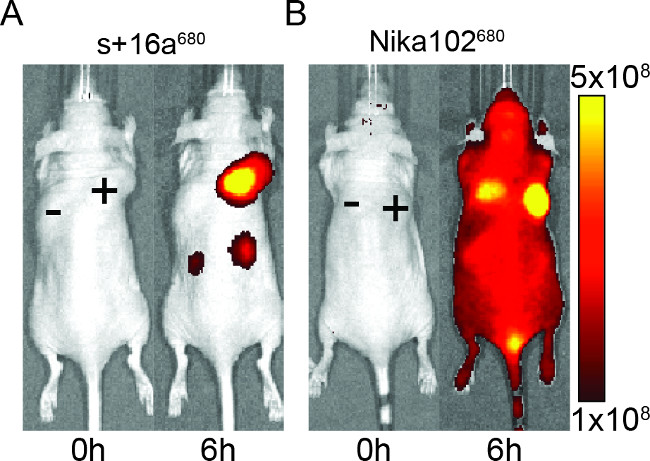
Figure 2: In vivo NIRF-imagerie d'images du signal de fluorescence de l'antigène-positive (+) et l'antigène-négatives (-) des tumeurs chez les souris qui ont été injectés avec + l'16a de Nanobodies (A) et l'anticorps monoclonal Nika102 (B). . imagerie in vivo a été réalisée avant (0 h) et 6 h après l'injection. Les intensités de signaux sont affichés sous forme efficacité radiante (p / sec / cm 2 / sr) / (uW / cm 2).
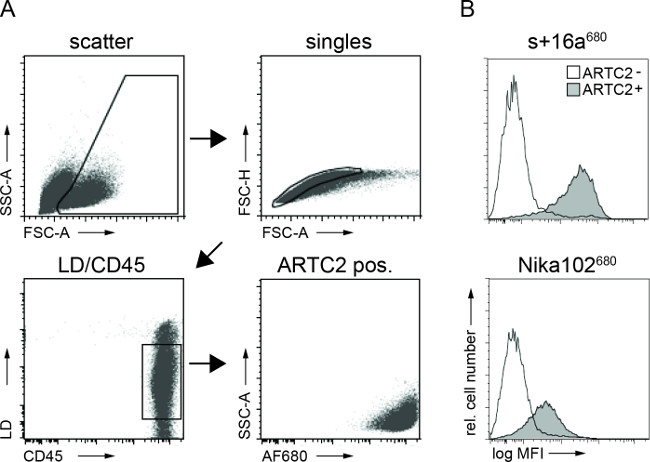
Figure 3:Ex vivo analyses FACS de cellules lié constructions d'anticorps à partir de suspensions de cellules tumorales. (A) stratégie déclenchement pour analyses FACS des cellules tumorales. (B) Les histogrammes afficher la quantité de + 16a et anticorps Nika102 du nanocorps AF680 conjugué injecté par voie intraveineuse lié spécifiquement aux cellules tumorales in vivo. tumeurs antigène négatif sont affichés sous forme d'histogrammes en carnet et les tumeurs positives à l'antigène sont affichés sous forme d'histogrammes remplis.
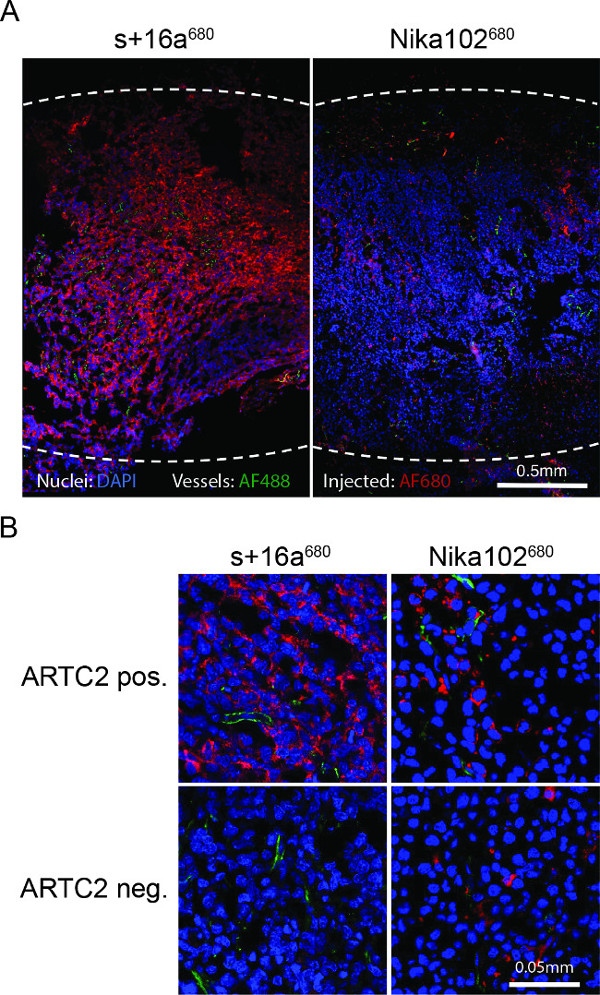
Figure 4:. Ex microscopie fluorescence in vivo (A) Vue d'ensemble de la microscopie à fluorescence cryosections tumorales positives à l'antigène entières 6 h après l'injection de s + 16a 680 ou 680 Nika102. Intensités signal du in vivo par voie intraveineuse enjected AF680 conjugués sans aucun agent secondaire étiquetage sont affichées en rouge. Ex vivo noyaux contrecolorées sont affichés en bleu et les navires en vert. Les lignes pointillées indiquent les marges extérieures des tumeurs entières. (B) Gros plan microscopie à fluorescence des tumeurs positives à l'antigène et de l'antigène négatif.
Discussion
Nous avons utilisé le proche infrarouge fluorophores nanocorps marqués et d'anticorps monoclonaux conventionnels dirigés contre la même cible sur les cellules de lymphome pour une comparaison multimodale in vivo et ex vivo analyses. Nous avons montré que nanocorps sont bien adaptés comme outils de diagnostic pour la détection rapide et spécifique in vivo des lymphomes.
In vivo, s + 16a 680 permis une détection rapide et plus spécifique de xénogreffes de ARTC2 positif. Outre les différentes cinétiques pour un affichage optimal de la tumeur in vivo, l'inconvénient majeur de Nika102 680 était le signal non spécifique élevée de tumeurs et de signaux de fond non spécifiques ARTC2 négatif.
Analyse ex vivo cytométrie de flux de cellules dispersées provenant de tumeurs disséquées ont montré aucune liaison non spécifique à des cellules de lymphome ARTC2 négatif de AF680-conjugués injectés. Ex vivo ont révélé une forte fluorescence et presque homogèneous coloration des cellules tumorales dans les sections ART2C-positive en cas de + 16a de la nanocorps, confirmant que le nanocorps était en mesure d'atteindre les zones reculées, même au sein de la tumeur après 6 h. En revanche, l'anticorps monoclonal a présenté une coloration plus faible et homogène de cellules dans les tumeurs ARTC2 positif après 6 heures. Résultats de l'imagerie mieux avec les anticorps classique peuvent être atteints après 24 h ou 48 h (données non présentées). Pour effectuer une comparaison approfondie des deux constructions différentes tailles, imagerie à des moments différents (série-imagerie) doit être effectuée pour identifier le point de temps d'imagerie optimale pour chaque construction.
Comme d'autres études antérieures, les résultats présentés ici soulignent que in vivo l'imagerie moléculaire avec nanocorps marqués permet l'imagerie de la tumeur même jour rapide et spécifique avec une grande tumeur à-fond ratios 12-15,17-19. Au contraire, les anticorps conventionnels aboutissent à de faibles ratios tumeur à-fond et les signaux non spécifiques de lutte contretumeurs gen-négatives début après l'injection en raison de leur lente clairance du corps. Afin d'obtenir des résultats d'imagerie optimales avec des anticorps conventionnels, le temps d'imagerie fait 24 heures ou même 48 heures après l'injection sont généralement nécessaires. Ces résultats sont en accord avec les études antérieures qui ont suggéré que les anticorps classiques avec un bénéfice thérapeutique avéré ont une utilité limitée en imagerie moléculaire 17,19,26. Par conséquent anticorps conventionnels pourraient être plutôt adapté à des fins thérapeutiques en raison de leur longue demi-vie plasmatique tout nanocorps sont plutôt adaptés à des fins d'imagerie en raison de leur élimination rapide de la circulation. Ces différences sont dues au fait que l'excédent des petits nanocorps (15-17 kDa) est rapidement éliminé par l'élimination rénale tout excès d'anticorps conventionnels plus grands (150 kDa) est retenu dans la circulation. Donc, l'avantage majeur de nanocorps pour l'imagerie moléculaire est le signal de fond bas à des moments d'imagerie début regardless de la dose injectée. Cela permet même imagerie par jour et pourrait être traduisible au réglage. Au contraire cliniques, les anticorps conventionnels doivent être exactement titré à minimiser les signaux de fond non spécifiques, tout en conservant suffisamment de signal spécifique du tissu ciblé (données non publiées).
L'une des limitations de la technique in vivo d'imagerie NIRF est la faible profondeur de pénétration qui permet généralement de l'imagerie sous-cutanée uniquement mais non de modèles de tumeur orthotopique. Toutefois, cette limitation pourrait être surmonté dans un cadre expérimental par les techniques de photo-acoustique tomographiques récemment développées qui permettent imagerie du corps entier de la vie des souris 27. Une autre limite de la technique d'imagerie NIRF est l'évaluation de la dose de tissu par rapport à l'imagerie par radionucléide médiée. Cependant, les Nanobodies peuvent être radiomarqués pour la tomographie par émission de positons (TEP) de modèles de xénogreffes et évaluation quantitative exacte detraceur biodistribution. En effet, nos résultats NIRF-imagerie sont conformes à une récente étude qui a comparé nanocorps et des anticorps conventionnels pour l'imagerie PET. Les auteurs sont également venus à la conclusion que nanocorps permettent imagerie même jour avec une grande tumeur à-fond rapports 15.
Cependant, seul le marquage de produits d'assemblage d'anticorps avec le proche infrarouge de colorant fluorescent AF680 nous a permis la complète in vitro, in vivo et ex vivo comparaison proche infrarouge imagerie par fluorescence en utilisant la cytométrie en flux, la microscopie à fluorescence, et NIRF-imagerie. Pour cette raison, et parce qu'il est non radioactif, très sensible, peu coûteux, et utilise relativement facile à produire des sondes ciblées, nous préconisons l'utilisation de la technique NIRF-imagerie pour l'évaluation de nouvelles constructions d'anticorps dans l'imagerie moléculaire préclinique.
Déclarations de divulgation
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Remerciements
Ce travail a été soutenu par l'école doctorale «Inflammation et la régénération» du Centre de recherche en collaboration 841 de la Deutsche Forschungsgemeinschaft (Alexander Lenz, Valentin Kunick, William Fumey), par le Centre de recherche en collaboration 877 de la Deutsche Forschungsgemeinschaft (Friedrich Koch-Nolte) , par la Fondation Werner Otto (Peter Bannas), par la Fondation Wilhelm Sander (Peter Bannas, Friedrich Koch-Nolte), et par la Deutsche Forschungsgemeinschaft (Martin Trepel, Friedrich Haag et Friedrich Koch-Nolte). Nous remercions l'Université Cancer Center Hamburg (UCCH) dans un établissement de Vivo optique Imaging Core et le personnel de l'UKE de consultation et de leur service de haute qualité. L'installation de base a été financé en partie par des subventions de Deutsche Krebshilfe (Aide allemande contre le cancer).
matériels
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Références
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon