Method Article
나노 바디 및 항체 기반의 검증
* 이 저자들은 동등하게 기여했습니다
요약
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
초록
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
서문
본 보고서에서는 생체 해부가 이종 이식 종양을 유동 세포 계측법 및 형광 현미경을 사용하여 생체 내 이미징 이종 이식 실험 검증을위한 근 적외 형광 표지 된 프로브의 구현을 기술한다. 우리는 단일 도메인 나노 바디 (S + 16A, 17 kDa의) (1)와 생체 내에서 특정 대해 동일한 표적 항원에 대해 지시 된 모노클로 날 항체 (Nika102 150 kDa의) 2,3- 비교 근적외선 림프종 이종 이식 모델에서 형광 이미징. 대상 항원 ADP-ribosyltransferase ARTC2.2은 림프종 세포 4-9로 GPI-고정 세포 표면 체외 효소로 표현된다.
카멜 리드로부터 유도 나노 바디는 중쇄 전용 항체는 가장 작은 항원 - 결합 단편 (10,11)이다. 만 ~ 15 kDa의,이 작은 항체 단편은, 용해 매우 안정적이며 renally 순환 8,10에서 삭제됩니다. 티HESE 특성은 생체 12-20에서 종양 항원의 특정하고 효율적인 타겟팅에 특히 적합하다. 가능한 나노 바디의 공통 항원 타겟 (EGFR1 또는 HER-1), 인간 표피 성장 인자 2 형 (HER-2 또는 CD340), 암 배아 항원 (CEA) 및 혈관 세포 유착 분자 -1 (VCAM-1 표피 성장 인자 수용체 아르 ) 21. 나노 바디 복합체는 염증성 질환 (22)의 암 면역 요법 및 치료를위한 유망한 도구입니다.
최근의 연구는 더 높은 종양 - 투 - 배경 (T / B)는 생체 분자 이미징 애플리케이션 8,17,19에서 기존의 항체보다 -ratios 나노 바디 허용 것으로 나타났습니다. 이 대상이 아닌 조직 (23)에 기존의 항체, 순환에서 느린 통관, 긴 보존의 상대적으로 가난하고 느린 조직 침투에 의해 주로 설명한다. 또한, 종래의 항체의 과량 비특이적 I 축적에 이르게향상된 통기성 및 체류 (EPR)에 의한 N 개의 표적 항원 음성 종양 (24, 25)에 영향. 이것은 종래의 항체의 고용량 따라서 달성 가능한 최대 종양 대 백그라운드 비율을 줄여 특정 신호들뿐만 아니라, 비특이적 신호뿐만 아니라이 증가 할 수 있다는 것을 의미한다. 대조적으로, 나노 바디의 도즈를 증가시키는 것은 아니라 정상 조직 또는 종양 항원 음성 (미발표) 중 항원 양성 종양의 신호를 증가시킨다.
나노 바디 기존 항체의 비교를 넘어, 우리는 인해 EPR 효과에 특정 비특이적 신호를 직접 비교를 위해 동일한 쥐에서 항원 양성 및 -negative 이종 이식의 intraindividual 평가를 설명합니다. 근적외선 형광 물질은 우리가 프로브, 근 적외 형광 영상을 이용하여 생체 내 및 생체 내의 단일 프로브를 이용하는 유동 세포 계측법, 형광 현미경시켰다. 우리의 프로토콜을 적용하면 비 허용이러한 특정 종양 타겟팅에 대한 새로운 항체 구조의 평가와 같은 생체 분자 이미징 실험, 방사성 매우 민감하고, 저렴 최적화.
이 튜토리얼 연구의 목적은 임상 분자 영상의 새로운 항체 구조의 평가를위한 NIRF 이미징의 사용을 강조하는 것입니다.
이 프로토콜에서, 모든 실험은 작은 동물 NIRF 이미징 시스템을 사용하여 수행하고, 형광 활성화 된 세포 분류기 (FACS)는 유동 세포 계측기 및 공 초점 현미경.
프로토콜
참고 : 실험 동물의 윤리적 사용에 대한 국제 가이드 라인에 따라 수행하고, 대학 의료 센터, 함부르크의 지역 동물 복지위원회에 의해 승인되었다.
종양 세포, 마우스, 및 항체를 구축 1. 준비
- 림프종 세포의 준비 및 지하 매트릭스의 분취 (마트 리겔).
- 종양 세포의 주입 전날 살균 팁 상자 (1000 μL 팁) 및 -20 ° C의 냉동고에서 적절한 피펫을 넣어.
- 4 ° C 냉장고 O / N에서 얼음에 지하 매트릭스와 병을 녹여.
- 주사의 날에 얼음 통을 작성하여 피펫 팁과 함께 지하 행렬을 배치하고 얼음에 30 G 바늘 1 ml의 주사기.
- 1.5 ml의 마이크로 원심 튜브에 RPMI 배지 100 ㎕의 부피 나누어지는 림프종 세포와 지하 매트릭스 100 ㎕ 조심스럽게 섞는다. 사전 냉각들로 그리기주사기와 주입까지 얼음에 넣어.
참고 : 좋은 무균 기술을 사용하여 얼음에 지하 행렬의 막힘을 방지하기 위해 모든 시간을 작동 할 수 있습니다.
- 마우스 준비
- 8~10주 오래된를 누드 마우스 (NMRI- Foxn1 N U)를 사용합니다.
- 소장의 형광도 전에 생체 내 이미징 1 주일 동안 알팔파없는 다이어트에 마우스를 유지 줄일 수 있습니다.
- 림프종 세포 주입 유도 챔버에 2 % 이소 플루 란 행하도록 쥐를 마취. 이소 플루오 란을 사용하여 매니 폴드 절차 동안 1-2 %의 이소 플루 란을 유지한다.
- 어깨 옆구리 피하 림프종 세포를 주입한다. 직접 인트라 개별 비교를 위해 각각 우측과 좌측에 항원 - 양성 및 음성 세포 항원을 주입.
- 마우스의 피부를 꼬집어 마우스의 몸에서 멀리 당겨 엄지와 검지 손가락을 사용합니다. 천천히 고르게에 주입아래의 피부 세포의 단일 클러스터 작성 손가락에 의해 만들어진 파우치. 지하 행렬은 장소에 주입 된 세포를 유지하는 데 도움이됩니다.
- 항체를 구축 준비
- 제조업체의 지침에 따라 형광 염료 AlexaFluor-680 (AF680) (여기 파장 = 679 nm의 발광 파장 = 702 ㎚)에 시판 단백질 라벨 키트와 함께 단일 클론 항체와 단일 도메인 나노 바디 레이블. 15,720 몰 -1 cm -1 203,000 몰 -1 cm -1, 각각의 몰 흡광 계수를 이용하여 나노 바디 기존 항체 당 염료의 수를 계산합니다. SDS-PAGE 크기 분류 쿠마 화려한 푸른 얼룩에 의해 항체 구조의 순도를 평가합니다.
- 실제 묘화 연구 전에 시험관 일련의 실험을 수행함으로써 표지 복합체의 특이성을 확인. 표지의 특이성을 테스트tibody 차단 연구를 통해 체외에서 생성하고 불특정 이소 타입은 8,20을 제어합니다.
참고 : 단계에서 항원 음성 및 항원 양성 세포 (또는 다른 세포 라인)에 대한 1.2.4 세포 수는 다른 성장 속도에 따라 적응해야 할 수 있습니다. 이 실험을 위해, 0.5x10 6 DC27.10 ARTC2 부정과 1.5 × 6 DC27.10 ARTC2 양성 세포는 비슷한 크기의 종양을 얻기 위해 사용되었다. 단계 1.3.1에서 형광 물질과 항체 프로브의 표지 및 라벨 효능의 과정은 사용되는 라벨 키트에 따라 다를 수 있습니다.
2. 생체 이미징
- 50 μg의 2 염료 / 분자 : 종양이 직경 ~ 8mm에 도달하면 7~9일 후, AlexaFluor680의 50 μg의 정맥 마우스의 꼬리 정맥 (단클론 항체-AF680에 200 ㎕의 생리 식염수 볼륨에서 항체의 구조를 표시 주입 ≈ ~ 4 ^ 14 형광 색소 ≈ ~ 0.8 μg의 형광 색소, 나노 바디-AF680 : 50 μ0.3 염료 g / 분자 ≈ ~ 5.6 ^ 14 형광 색소 ≈ ~ 1.1 μg의 형광 색소).
- 촬상 시스템을 초기화하고 3 % 이소 플루 란 이전에 촬상 유도 챔버 XGI -8- 마취 시스템을 이용하여 행하도록 쥐를 마취. 촬상 챔버 내에 수용 매니 폴드를 사용하여 이소 플루 란 촬상 과정의 기간 1-2 %의 이소 플루 란을 유지한다.
- 카메라를 향해 지시 종양 가열 이미징 단계에 위치 마우스. 발가락 또는 동물의 꼬리를 곤란하게하여 적절한 마취 모니터; 동물의 반응은 마취가 너무 빛을 나타냅니다.
- 호흡 속도를 모니터링; 마취 호흡 속도가 너무 크게하면 빛과 너무 깊이 호흡율이 감소되는 경우, 깊거나 불규칙적이다. 마취 동안 건조를 방지하기 위해 눈 연고와 동물의 각막을 보호합니다.
- 여기에 대한 615-665 nm의, emissio에 대한 695-770 나노 미터의 형광 필터 세트를 선택n 및 51 배 (512), 화소 매트릭스의 크기와 배경 공제 580-610 nm의 여기. 매체에 자동으로 노출 시간, 픽셀 비닝 (binning)을 설정하고 F는 / 2를 중지합니다.
주 : 짧은 노출 시간이 빠른 프레임 레이트를 사용; 긴 노출 시간은 더 큰 감도를 제공한다. 비닝 CCD 카메라의 픽셀 크기를 제어한다. 비닝을 늘리면 화소 사이즈, 감도, 및 프레임 속도를 증가 시키지만, 공간 해상도를 감소시킨다. F / 정지 카메라 렌즈 개구의 크기를 설정한다. 구멍의 크기는 검출 된 빛의 양 및 설정 장치 및 실험 셋업을 묘화 다를 수 field.Note의 깊이를 제어한다. 최적의 결과에 대한 제조업체의 설명서를 참조하십시오.- 이미징 소프트웨어 최적화 노출 시간에서, F / 정지 및 픽셀 비닝 세포주의 발현 수준에 따라. 양적 결과에 영향을주지 않고 실험 기간 동안 언제든지 이러한 설정을 변경합니다. 또한, 이미징 마법사 소프트웨어가 자동으로 결정하도록매개 변수를 설정합니다.
- 이미지 주입하기 전에 마우스와 항체 구조의 주사 후 6 시간.
주 : 라벨 효능이 최적의 이미징 결과에 필요한 필요한 용량에 영향을 미칠 수 있습니다. 최적의 촬상 결과를 위해 필요한 항체의 구조 때문에 양은 경험적으로 결정되어야한다. 그것은 라벨 효능 및 크기 구조물뿐만 아니라 종양 모델과 대상 항원 발현에 따라 달라질 수있다.
3. 수확 및 종양의 준비
- 얼음 통 채우고 4 % 파라 포름 알데히드 (PFA) 인산염 완충 식염수 (PBS) / 프로테아제 억제제 (AEBSF)과 얼음 PBS / 0.2 % 소 혈청 알부민 (BSA)을 놓는다.
- 이미징 세션이 종료되면, 4 % 이소 플루 란으로의 농도를 증가시킨다. 동물이 호흡을 중단 한 후, 이미징 단계에서 제거하고 자궁 전위를 수행합니다.
- 마운트 스티로폼 블록에 마우스와 70 % 에탄올로 스프레이.
- 사용 가위s와 집게는 외부 피부를 잘라 종양을 노출 조심스럽게 뒤로 당겨. 종양 조직은 그대로 유지하기 위해 메스로 종양을 제거합니다.
- 메스를 사용하여 반으로 잘라 종양. PBS / FACS에 대한 AEBSF 분석과 면역 조직 화학 염색에 대한 4 % PFA와 50 ML 튜브의 다른 절반 포집 관에서 절반을 놓습니다.
- 면역 조직 화학 염색을위한 준비
- 24 시간 동안 4 ° C에서 냉장고에 4 % PFA에 종양을 유지합니다. PBS / 30 % 자당과 관에 종양을 전송하고 튜브의 바닥에 종양 싱크까지 4 ° C에서 냉장고에 보관하십시오.
- cryomolds에 적합한 조각 종양을 잘라. cryomolds에 종양을 넣고 종양이 적용되도록의 OCT 화합물을 입력합니다.
- 드라이 아이스에 금형을 넣고 화합물이 완전히 고정 될 때까지 기다립니다. 냉동 종양 -80 ° C 냉장고에 전송 및 면역 조직 화학 염색을 위해 저장합니다.
- 잘라 마이크로톰 8 μm의 섹션에서 종양을 냉동. 표준 immunohisto를 사용하여화학 프로토콜은 핵을 시각화하기 위해 혈관과 diamidino 페닐 인돌 (DAPI)를 시각화하는 CD31-AF488에 대한 항체로 염색합니다.
참고 : 이미 형광 표지 항체를 포함하기 때문에 종양 섹션은 빛에 매우 민감하다. 가급적 빛에의 노출을 최소화.
- FACS 분석을위한 준비
- 얼음에 페트리 접시를 놓고 2.0 ML의 주사기에서 플런저를 제거합니다. 셀 스트레이너에 종양을 넣고 메스를 사용하여 3 ~ 4 조각으로 부드럽게 잘라. 페트리 접시에 초기 PBS를 붓고 셀 스트레이너 내 종양을 반하게하기 위해 플런저의 평평한 끝을 사용합니다.
- 10ml를 피펫으로 모든 세포를 씻어 초기 PBS와 셀 스트레이너를 플래시합니다. 5 분 동안 500 XG에서 새로운 튜브와 스핀에 세포 현탁액을 전송합니다. 뜨는을 취소하고 10 ml의 PBS / 0.2 % BSA에서 세포를 재현 탁. 세포를 계산합니다.
- 5 ml의 FACS 관에서 나누어지는 1 ~ 5 × 10 6 림프종 세포. 다시 스핀 세포 ((500)XG), 100 μl의 PBS / 0.2 % BSA에 뜨는에 resuspend 폐기합니다.
- 선택적으로, 사용하는 블록의 FcR 항 CD16 / 10 분 동안 얼음 위에서 FcγR에 결합 CD32 단클론 (FcgR3 / 2). PBS로 한 번 세포를 씻으 / 0.2 % BSA를.
- 다른 세포로부터 백혈구를 구별 안티 CD45 단클론 추가합니다. PBS / 0.2 % BSA 두 세척 다음 어둠 속에서 얼음에 20 분 동안 품어.
- 오른쪽 요오드화 프로피 듐와 FACS 분석 얼룩 전에 얼음에 15 분은 일반 PBS로 두 세척 다음 죽은 세포를 식별하기 위해. FACS 분석을위한 150 μL에 재현 탁.
주 : 단계 3.7.4 및 3.7.5 단계에서 다른 항체는 종양 엔티티에 따라 사용될 수있다.
4. FACS 분석
- CD45 양성 세포를위한 게이팅 및 항원 양성 세포를위한 게이팅 큰 산란 겹 차별, 사균의 배제의 형태로 게이트에 관심 인구 게이팅 일련의 도구를 사용.
- 먼저, 게이트 밖으로 세포두 매개 변수 플롯을 사용하여 측면 산란 (SSC-A) 대 앞으로 분산 형 (FSC-A)의 파편. 다음 폐기 전지는 이중. 마지막으로, 게이트 밖으로 비 (CD45) CD45 항원 양성 죽은 / 세포 죽어가는 (LD - 라이브 / 죽은 얼룩).
- 모든 실험에 대해 동일한 템플릿을 사용하여 기록 샘플.
참고 : 하드웨어 및 분석 소프트웨어의 사용에 대한 기술적 조언 제조업체의 프로토콜을 참조하십시오.
5. 현미경 분석
- 기름 침지 렌즈 (40 배 목표)와 공 초점 현미경을 사용하여 스테인드 종양 저온부를 분석합니다. AF680의 그는 네온 633 nm의 레이저 여기, AF488에 대한 아르곤 레이저 및 DAPI에 대한 405 다이오드를 사용합니다.
- 현미경과 호환 소프트웨어를 이용하여 원시 이미지 데이터를 처리. 배경 보정 및 노이즈 필요한 경우 필터링을 수행합니다. 같은 단면 자르기뿐만 아니라 밝기 및 대비 조정 등의 추가 이미지 조정을 수행합니다.
- 마지막으로 GE모든 검출 채널에서 단일 복합 오버레이 이미지를 nerate. 각 층의 밝기와 대비를 조정합니다. 합성 이미지는 세포 (녹색 AF488 얼룩) (DAPI 얼룩, 파랑), 표지 된 항체 구조 (빨간색 AF680 얼룩) 및 혈관의 분포의 현지화를 표시합니다.
생체 이미징 분석 6.
- 이미징 소프트웨어 이미지 파일 열기 및 형광 화상 데이터와 사진 영상 데이터를 결합하여 합성 이미지를 생성한다. 특정 형광 신호로부터 조직자가 형광 배경 신호를 제거하여 화상 표시를 최적화. 이 트레이서 특정 세트의 필터로 취득한 화상으로부터 배경 세트의 필터로 취득한 화상을 감산함으로써 수행 될 수있다.
- 항원 양성 종양 항원 음성 종양 주위의 관심 (ROI)의 동일한 원형 측정 영역을 그립니다. 백그라운드 신호 강도를 결정하기 위해 ROI를 배치 원형형광 신호는 (예를 들어, 다리 뒷다리)으로 낮다 동물의 장소.
- 모든 시점에서 모든 동물에 대해 동일한 ROI를 사용합니다. 위치 결정을위한 종양 마진을 식별하는 사진 흑백 이미지를 사용한다.
- 측정 표에 표시 ROI 데이터. 또한 통계 분석을위한 형광 신호의 정량적 비교를 가능하게 평균 방사 효율 데이터를 사용합니다.
- 디스플레이 및 절대 신호 세기와 같은 데이터를 비교하거나 표적 조직 및 조직으로부터 배경 ROI 측정 된 데이터를 이용하여 신호 대 바탕 비율을 계산한다. 뒷다리에서 결정된 배경 값에 의해 종양 흡수 값을 나눔으로써 종양 대 백그라운드 비율을 계산한다.
- 대조군으로, 또한 생체 내에서의 신호의 특이성을 평가하기 위해 표지 된 이소 타입 대조군과 주입 된 항원 음성 및 항원 양성 동일한 동물에서 종양뿐만 아니라 동물을 분석한다.
결과
형광 표지 된 프로브 NIRF 다른 이미징 기법 (도 1a)의 조합을 허용한다. 우리는 생체 내 이미징 (도 1B)에 대한 특정 형광 표지 된 모노클로 날 항체 및 나노 바디를 비교하기 위해서, 생체 NIRF 이미징을 수행하는 유동 세포 계측법, 형광 현미경 순차적보고자.
마우스는 생체 내 이미징을위한 형광 표지 된 구조의 특이성을 평가하기 위해 나노 바디와 단일 클론 항체의 50 μg의 주사 하였다. 결과는 주사 후 6 시간 (그림 2)에서 나노 바디와 단일 클론 항체 모두 항원 양성 종양의 특정 라벨을 보여 주었다. ROI는 모노클로 날 항체 ~ 6에 비해 나노 바디에 대한 훨씬 더 높은 T / B 비를 12 ~ 보였다 항원 양성 종양의 분석. 또한, 나노 바디는 반면, 항원 음성 종양에서 비특이적 신호 없었다모노클로 날 항체는 항원 음성 종양에서 비특이적 교란 신호를 보여 주었다.
네거티브 종양의 비특이적 신호 외에도, 단일 클론 항체는 전체 동물에서 비특이적 백그라운드 신호를 유도. 이는 renally 배설 너무 커서 과잉 자유 순환 항체 쉽다. 이에 반하여, 나노 바디로 주입 된 동물은 나노 바디의 작은 신장의 제거로 인해 신장에 비특이적 인 신호를 보여 주었다.
계측법 종양 세포 현탁액의 흐름을 분석하는 것은 AF680 주입 후 6 시간 접합체 모두 항원 양성 종양 세포의 고유 라벨을 보였다. 모노클로 날 항체 표지 된 세포에 비해 나노 바디 표지화 된 세포의 강한 형광 신호가 생체 NIRF 이미징 결과를 반영한다. 중요한 것은, 유세포 분석은 두 가지 중 하나를 사용하여 항원 - 음성 세포의 비특이적 라벨이 없음을 밝혀구조 (그림 3).
종양 저온부의 형광 현미경은 나노 바디 주입 후 6 시간으로 항원 양성 세포 강하고 거의 균일 라벨링 하였다. 이에 반하여, 모노클로 날 항체는 매우 약한 오히려 불균일 염색 (도 4a)을 나타내었다. 항원 음성 종양이 격자 공간 (그림 4B)에서 기존의 항체 쇼 비특이적 흩어져 염색 주입 반면 항원 음성 종양, 나노 바디의 주사 후 더 염색 6 시간을 표시하지 않습니다.
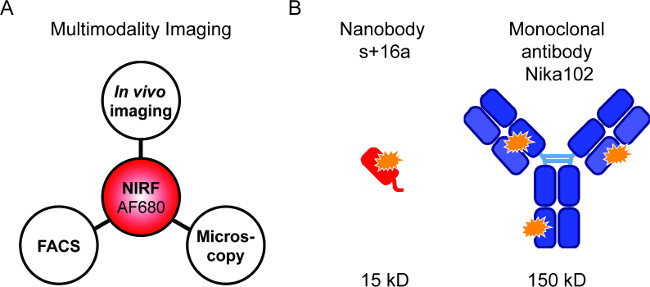
그림 1 : Flourescence 이미징 및 항체 생성합니다. 유동 세포 계측법 및 형광 현미경 다음 생체 내 NIRF 이미징 : AF680-접합체의 평가 (A) 이미징 설치. (B )에서 AlexaFluor680의 도식은 나노 바디의 +의 16A (적색) 및 단일 클론 항체 Nika102 (파란색) 표시. 오렌지 별 AlexaFluor680의 형광 색소를 나타냅니다.
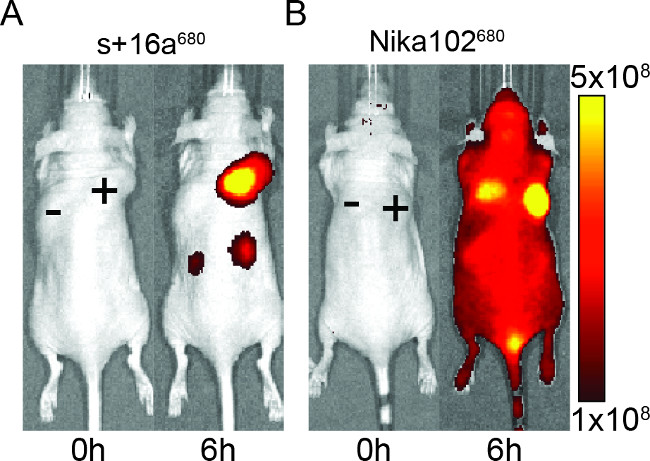
도 2 : 생체 NIRF 이미징의 형광 신호의 이미지 항원 양성 (+) 항원 음성 (-) 나노 바디 (S) +의 (16A) (A) 및 모노클로 날 항체 Nika102 (B)을 주사 한 마우스에서 종양. . 생체 내 이미징 (0 시간)과 주사 후 6 시간 전에 실시 하였다. 신호 강도는 방사 효율 (P / 초 / cm 2 / SR) / (μW / cm 2)으로 표시됩니다.
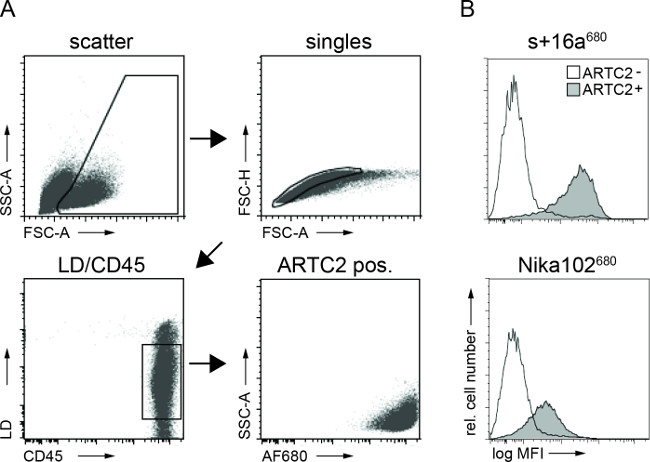
그림 3 :FACS에 대한 FACS 분석 생체 외 종양 세포 현탁액으로부터 세포 결합 항체의 구조. (A) 게이팅 전략은 종양 세포의 분석. (B) 히스토그램 특히 생체 내에서 종양 세포에 결합 정맥 내 주사 AF680 공역 나노 바디 (16A)의 S +와 Nika102 항체의 양을 표시. 항원 음성 종양이 채워지지 히스토그램 및 항원 양성 종양으로 표시됩니다 채워진 막대 그래프로 표시됩니다.
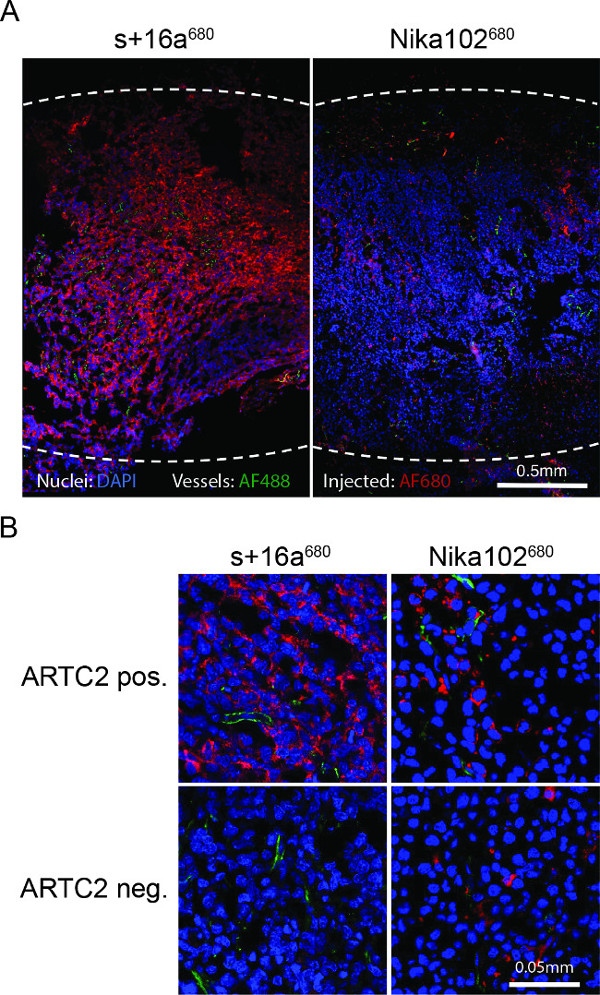
그림 4 :. 6 시간의 + 16A (680) 또는 Nika102 (680)의 주입 후 전체 항원 양성 종양 저온부의 생체 내 형광 현미경 (A) 개요 형광 현미경. 생체 내 정맥에서의 신호 강도모든 보조 라벨링 에이전트없이 투사 AF680-접합체는 빨간색으로 표시됩니다. 예 생체 대조 핵 녹색 파란색과 혈관에 표시됩니다. 점선은 전체 종양의 외부 여백을 나타냅니다. (B) 항원 양성 항원 음성 종양의 근접 형광 현미경.
토론
우리는 생체 내 및 생체 분석의 복합 비교를 위해 림프종 세포에 동일한 대상에 대하여 지시 근적외선 형광 표지 된 나노 바디와 기존의 단일 클론 항체를 사용 하였다. 우리는 나노 바디 잘 림프종의 신속하고 특정 생체 검출을위한 진단 도구로서 적합한 것으로 나타났다.
생체 내에서, + 16A 680 ARTC2 양성 이종 이식의 빠르고 더 구체적인 검출을 허용이야. 별도로 생체 내에서 가장 종양 시각화를위한 다양한 반응 속도에서, Nika102 680의 주요 단점은 ARTC2 음성 종양 특이 배경 신호로부터 높은 특이 신호였다.
해부 종양이 주입 AF680-접합체의 ARTC2 음성 림프종 세포에 비특이적 결합 없었다에서 생체 유세포는 분산 된 세포를 분석한다. 생체 내 형광 거의 homogen 강한 계시나노 바디는 6 시간 후 종양 이내에는 원격 지역에 도달 할 수되었음을 확인 나노 바디의 + (16a)의 경우 ART2C 양성 종양 부분에있는 세포의 OU를 염색. 대조적으로, 단일 클론 항체는 6 시간 후에 ARTC2 양성 종양 세포의 염색 불균일 및 약한 나타났다. 종래 항체 나은 이미징 결과는 24 시간 또는 48 시간 후에 달성 될 수있다 (데이터는 보이지 않음). 두 개의 상이한 크기의 구조체의 철저한 비교를 수행하기 위해 상이한 시간 점 (직 촬상)에서 촬상 각 구조에 대해 최적의 촬상 시각을 식별하기 위해 수행되어야한다.
이전의 다른 연구들과 마찬가지로, 여기에보고 된 결과는 생체 내에서 표시 나노 바디와 분자 영상은 높은 종양 - 투 - 배경 비율 12-15,17-19와 신속하고 특정 당일 종양 영상을 수 있다는 점을 강조. 이에 반하여, 기존의 항체는 낮은 종양 - 투 - 배경 비율 및 항에서 비특이적 신호 발생때문에 몸에서 자신의 느린 간격으로 초기 주입 후 세대 음성 종양. 종래 항체 최적 촬상 결과를 얻기 위해, 촬영 시간은 24 시간 또는 사출 흔히 필요한 후에도 48 시간을 가리킨다. 이러한 연구 결과는 입증 된 치료 효과와 기존의 항체 분자 영상 17,19,26에서 유틸리티를 제한하는 것이 제안 이전의 연구와 일치하고 있습니다. 나노 바디 인해 순환에서 자신의 신속한 통관에 영상을 위해 오히려 적합하면서 따라서 기존의 항체는 그들의 긴 혈장 반감기 치료 목적 오히려 적합 할 수 있습니다. 이러한 차이점은 기존의 대형 항체 (150 kDa의) 과량의 순환에 유지하면서 작은 나노 바디 (15-17 kDa의) 임의의 과량이 빠르게 신장을 통해 클리어 제거된다는 사실에 기인한다. 따라서 분자 영상 용 나노 바디의 주요 이점은 촬상 이른 시점에서 낮은 배경 신호이다 regardl주입 용량의 ESS. 이것은 당일 촬상 가능하고 임상.에 반하여 병진 수 종래 항체 정확히 표적 조직 (미발표)로부터 특정 신호를 충분히 유지하면서, 비특이적 배경 신호를 최소화하도록 적정되어야한다.
생체 NIRF 이미징 기술의 한계 중 하나는 일반적 아니지만 동소 종양의 피하 모델에만 촬상을 허용 낮은 침투 깊이이다. 그러나,이 제한은 생쥐 (27) 생활의 전신 영상을 허용 최근에 개발 된 단층 촬영 사진 음향 기술로 실험 설정에서 극복 될 수 있습니다. 방사선 핵종 - 매개 이미징에 비해 NIRF 이미징 기술의 다른 제한은 조직 도즈의 평가이다. 그러나, 나노 바디는 이종 이식 모델과 정확한 정량적 평가의 양전자 방출 단층 촬영 (PET) 영상에 대한 방사성 표지 될 수있다추적 생체 분포. 사실, 우리의 NIRF 이미징 결과는 나노 바디와 PET 영상에 대한 기존의 항체를 비교하여 최근의 연구에 따라 있습니다. 저자는 또한 나노 바디가 높은 종양 - 투 - 배경 비율 15 당일 영상을 허용 결론에 도달했다.
그러나, 근적외선 형광 염료 AF680와 항체 구조의 단지 라벨은 생체 내에서, 우리를 시험 관내 포괄적시키고 생체 근적외선 형광 촬상 비교 유동 세포 계측법, 형광 현미경, 및 NIRF 이미징 사용. 그것은, 방사성 저렴 고감도이며 비교적 쉽게 생산할 표적 프로브를 사용하기 때문에 이러한 이유로, 우리는 전임상 분자 이미징 새로운 항체 구조의 평가 NIRF 이미징 기법의 사용을지지.
공개
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
감사의 말
이 작품은 독일 연구 협회의 공동 연구 센터 877 (프리드리히 코치 - 놀테)에 의해 대학원 '염증과 재생'독일 연구 협회의 공동 연구 센터 (841) (알렉산더 렌즈, 발렌틴 Kunick, 윌리엄 Fumey)의,에 의해 지원되었다 , 빌헬름 샌더 재단 베르너 오토 재단 (피터 Bannas), (피터 Bannas, 프리드리히 코치 - 놀테)에 의해 독일 연구 협회 (마틴 Trepel, 프리드리히 하겐과 프리드리히 코치 - 놀테)에 의해. 우리는 생체 광학 이미징 핵심 시설과 직원 UKE 상담 및 높은 품질의 서비스에서 대학 암 센터 함부르크 (UCCH를) 감사합니다. 핵심 시설은 도이치 Krebshilfe (독일어 암 보조)에서 보조금에 의해 부분적으로 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
참고문헌
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유