Method Article
التحقيق في متشابك وسم / القبض على والصليب التقاط باستخدام الحاد شرائح الحصين من القوارض
In This Article
Summary
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Abstract
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introduction
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocol
وقد وافق جميع الإجراءات الحيوانية من لجنة المؤسسي رعاية الحيوان واستخدام (IACUC) من جامعة سنغافورة الوطنية.
1. إعداد الدماغي الاصطناعي السائل (ACSF)
- إعداد ACSF يتكون من (مم) 124 كلوريد الصوديوم، 3.7 بوكل، 1.0 MgSO 4 .7H 2 O، و 2.5 CaCl 2 .2H 2 O، و 1.2 KH 2 PO 4، 24.6 NaHCO 3، و 10 D-الجلوكوز. ضمان درجة الحموضة في ACSF ما بين 7،2-7،4 عندما انفجر من التشبع مع O 2 و 5٪ CO 2 الخليط (كربوجين). 21 استخدام هذا ACSF لكل من التشريح، وإعداد شريحة ونضح 95٪ خلال التسجيلات الكهربية.
ملاحظة: استخدام جهاز تنظيف لقياس وعقد ACSF. باستخدام جهاز نجس قد تؤدي إلى حلول غائم أو تشكيل الرواسب. استخدام الماء منزوع الأيونات لجميع الاستعدادات. - إعداد 2 L 10X ACSF الأسهم باستثناء NaHCO 3 وD-الجلوكوز في قارورة حجمية. إضافة الكواشف إلى الماء منزوع الأيونات في الترتيب التالي: كلوريد الصوديوم (144.96g)، بوكل (5.52g)، MgSO 4 .7H 2 0 (4.92g)، CaCl 2 .2H 2 0 (7.56 ز)، KH 2 PO 4 (3.28 ز) وأعلى ما يصل الى حجم 2 L. اثارة باستمرار لمدة 30 دقيقة على الأقل باستخدام محرك مغناطيسي للتأكد من حل جميع الكواشف. تخزين الأسهم في 4 درجة مئوية وتستخدم في غضون 2 أسابيع.
- قبل تشريح والتجارب، ويخفف من الأسهم ACSF في قارورة حجمية جنبا إلى جنب مع إضافة الكميات المطلوبة من NaHCO 3 و D-الجلوكوز. ل1 L الحل، وتمييع 100 مل من الأسهم إلى 1 L بعد إضافة 2.07 غرام NaHCO 3 و 1.802 ز D-الجلوكوز. يجب أن يكون ACSF حل واضح خال من أي راسب أو الجزيئات غير منحل.
- بارد حوالي 200-300 مل من ACSF على الجليد، لاستخدامها أثناء تشريح. تأكد من أن ACSF تستخدم لتشريح ما بين 2-4 درجة مئوية. استخدام ACSF المتبقية لelectropتجارب hysiological. فقاعة جميع الحلول ACSF من التشبع مع كربوجين (5٪ CO 2، 95٪ O 2) باستمرار. في انتظار ACSF لتبرد، وإعداد منطقة تشريح وغرفة شريحة.
2. إعداد غرفة واجهة
ملاحظة: دائرة شريحة واجهة الدماغ، وتستخدم لاحتضان شرائح والحفاظ عليها خلال التسجيلات الكهربية (الشكل 2B)، ويتكون من قسمين. مجلس النواب يحتوي على الماء المقطر الحفاظ على 32 ° C بواسطة وحدة تحكم في درجة الحرارة وانفجر بشكل مستمر مع كربوجين.
- تشغيل وحدة تحكم في درجة الحرارة ومسبقا أنه في 32 ° C. يغسل مجلس الشيوخ لمدة 10 إلى 15 دقيقة عن طريق تشغيل الماء المقطر من خلال أنبوب تدفق. تأكد من أن الغرفة العليا نظيفة قبل وضع الشبكة. تأكد من أن مستوى المياه في الغرفة السفلى حوالي 70٪ مملوءة بالماء المقطر.
- ضعالشباك في مجلس الشيوخ لتوفير سطح يستريح لشرائح (الشكل 2C). ضبط أنابيب تدفق للتأكد من أن مستوى الحل هو ترطيب كاف المنطقة كلها للمرمى. وضع غطاء فوق الشبكة للحفاظ على جو كربوجين مرطب داخل غرفة العليا.
- ضبط معدل التدفق إلى 1 مل / دقيقة. الحفاظ على هذا المعدل تدفق طوال فترة الحضانة شريحة والتجربة. بدء carbogenating وطازجة 1X ACSF وغمر أنابيب تدفق في ACSF. سماح 20 دقيقة لACSF أن مشبعة مع كربوجين وللغرفة العليا المراد شغلها معها.
3. إعداد الحاد شرائح الحصين
ملاحظة: يتكون بروتوكول تشريح (1) إزالة الدماغ من الحيوان إلى ACSF الباردة و(2) عزل وتقطيع الحصين. من أجل الخلايا العصبية لتبقى قابلة للحياة، عزل ووضع الدماغ في ACSF الباردة بسرعة وإكمال كلهعملية تشريح ضمن 3-5 دقيقة بما في ذلك.
- إزالة الدماغ في ACSF الباردة
- وضع أدوات تشريح في الطريقة هو مبين في الشكل 1A. ترتيب الأدوات وفقا لترتيب استخدامها لتسهيل عملية تشريح. قبل البدء، تأكد من جميع الأدوات تشريح جاهزة.
- جبل شفرة حلاقة، وتنظيفها مع خلات الإيثيل، والإيثانول المطلق والماء المقطر، على المروحية الأنسجة اليدوية (الشكل 1B)، ثبته بحزم وضمان طليعة يتم محاذاة بالتساوي. اختبار تقطيع قطعة من ورق الترشيح للتأكد من أن شفرة يتم تأمين بحزم. تعيين انزلاق رنيه ميكرومتر إلى نقطة الانطلاق لها.
- الموت ببطء الحيوان باستخدام ثاني أكسيد الكربون (CO 2) في غرفة الاستقراء وقطع رأس مع مقص ضمادة أو المقصلة. باستخدام مقص القزحية، وإزالة الجلد والفرو فوق الجمجمة. اجراء خفض خلال الخلفي لإزالة brainstem.Make شق صغير على طول الالبريد الجانب الأيمن من الجمجمة وشق أطول على اليسار.
الحذر! جعل مجرد شق صغير في الجانب الذي يستخدم للتجارب لتجنب الإضرار بها. عند إدخال مقص، تأكد من أن القوة المطبقة هي صعودا لتجنب تلف في خلايا المخ. - إزالة بعناية الجمجمة مع العظام مقراض بدءا من اليسار إلى الجانب الأيمن من الجمجمة للكشف عن القشرة. ويمكن أيضا أن ينظر إلى طبقة رقيقة من الجافية. إزالة بعناية لوحات أمامية مع قراضة. إزالة معظم الجافية جنبا إلى جنب مع لوحات الأمامية.
الحذر! كن حذرا بأن لا الجافية شريحة من خلال أنسجة المخ. - إزالة الجافية المتبقية، إن وجدت، وتحديدا في تقاطع بين القشرة والمخيخ مع نهاية شقة من ملعقة. للحصول على خطوات 3.1.5 و 3.1.6، والحفاظ على الضغط صعودا أي بعيدا عن الدماغ لتجنب الإضرار بها. باستخدام ملعقة، مغرفة بلطف الدماغ في طبق بتري مليئة البارد وACSF carbogenated (2-4 ° C)، جيش التحرير الشعبى الصينىدائرة الهندسة المدنية على كتلة تبريد الألومنيوم.
- عزل الحصين
- باستخدام مشرط، وجعل قطع على التوالي لإزالة المخيخ وقطع أخرى لإزالة الجزء الأمامي من الدماغ (حوالي ربع). اجراء خفض الضحلة على طول خط الوسط.
- إزالة بعناية القشرة مع قشارة المنجلية، بدءا من خط الوسط لكشف الحصين الظهرية. إزالة طبقة من القشرة فوق الحصين. استخدام الأصابع أو ملقط الزاوية لدعم الدماغ. جعل قطع صغيرة للصوار الحصين. إزالة بلطف الحصين مع قشارة المنجل بدءا من الحصين الظهرية باستخدام حركات المتداول.
الحذر! أن يكون لطيف لتجنب تمتد وتمزيق الحصين. - إزالة أي القشرة والأنسجة الضامة المحيطة الحصين معزولة مع قشارة المنجلية.
- تشريح الأنسجة قرن آمون ونقل شرائح على غرفة اجهة
- ضع قطعة من ACSF-ينقع ورق الترشيح (الصف 1، 30 ملم) على مرحلة التقطيع للتقطيع اللحم اليدوي. حلج القطن ووضع الأنسجة الحصين على ورقة الترشيح. نقل ورقة الترشيح لمحاذاة قرن آمون في التوجه السليم فيما يتعلق شفرة لتقطيع اللحم بحيث يتم شرائح الحصين في زاوية من نحو 70 درجة إلى الخمل.
- وصمة عار الحل الزائدة المحيطة الأنسجة قرن آمون مع ورقة مرشح مطوية (الصف 1، 85 مم) وترك الحصين الرطب قليلا. تشريح الحصين مستعرض بدء. شريحة وتجاهل الأنسجة من نهاية متطرفة من الحصين حيث التشكل شريحة ليست واضحة.
- شريحة الأنسجة المتبقية إلى شرائح 400 ميكرون سميكة. التقاط شرائح الحصين بلطف من شفرة بفرشاة مع شعيرات ناعمة باستخدام حركات الضرب طيف ووضع الشرائح في دورق صغير مليء ACSF carbogenated البارد. نفذ الخطوات 3.3.1-3.3.3 في أسرع وقت ممكن لأن ما يتعرض الأنسجة قرن آمون في الهواء.
ملاحظة: عموما ثلثي قرن آمون هو شرائح و4-6 شرائح مع التشكل واضحة يمكن أن تكون مستعدة. - نقل شرائح بلطف على الشباك في غرفة شريحة باستخدام ماصة باستور نظيفة من البلاستيك مع طرف واسع (الذي أدلى به قطع بعيدا 2-3 سم من الحافة). ضبط دقيق للموقف شرائح على الشبكة باستخدام حقنة صغيرة مع طرف عازمة. ضع شرائح بطريقة تسهل موقع القطب والتسجيل. تحقق للتأكد من أن شرائح ويحيط بما فيه الكفاية ACSF ولكن لم يتم المغمورة أو العائمة (الشكل 2C-D). تغطية غرفة واحتضان شرائح لمدة 2-3 ساعة.
ملاحظة: إن طبقة الخلايا الهرمية في شرائح صحية يجب أن تظهر بعض الشفافية.
4. تسجيل من الردود CA3-CA1 متشابك
ملاحظة: الكهربية انشاء المستخدمة في مجال تسجيل المحتملين في الشكل 2A. A الفارعةينصح قفص اليوم بشدة إذا كان التداخل الكهربائي هو خارج نطاق سيطرة بعد أسس سليمة من الإعدادات الكهربائية. تتوفر تجاريا العديد من أنواع مختلفة من الغرف المغمورة واجهة. ومع ذلك، ويفضل غرف الواجهة كما شرائح المعرض الردود متشابك أكثر قوة في نفوسهم.
- تحديد المواقع من الأقطاب الكهربائية
- بدوره على الأجهزة الكهربائية (التحفيز والتشجيع ومكبرات الصوت) لاستخدامها. جبل وتأمين محفزة وتسجيل الأقطاب في أصحاب شبكي من micromanipulators.
ملاحظة: نحن نستخدم أحادي القطب، الأقطاب الفولاذ المقاوم للصدأ المغلفة ورنيش المقاومة 5 MΩ لكلا محفزة وتسجيل الأهداف. - قبل الاستخدام، وإدراج هذه الأقطاب داخل الشعيرات الدموية الزجاج سحبت وآمنة مع الغراء الايبوكسي تعريض فقط جزء صغير من طرف القطب (الشكل 2E). وهذا يعطي قوة للأقطاب مرهف خلاف ذلك، ويساعد على تأمينها بقوة في ايلىأصحاب ctrode.
- تسترشد تحت المجهر، ضع القطب محفزة (ق) في المشععة طبقة من المنطقة CA1 لتحفيز ألياف ضمانات شافر والقطب تسجيل في المنطقة شجيري قمي من CA1 لتسجيل (fEPSP) ردود الميدان الكامن الاستثاري بعد المشبكي.
ملاحظة: الاقتراب من سطح السائل فوق شريحة مع الأقطاب يعطي الصوت الذي يساعد على تحديد موقع بسرعة على سطح شريحة (المقدمة، يتم توصيل مكبر للصوت مكبر للصوت). - في متشابك علامات والقبض على التجارب، وفقا لحاجة التجربة، موقف اثنين أو ثلاثة تحفيز كهربائي (S1، S2 أو S3) على جانبي القطب تسجيل لتحفيز اثنين أو أكثر مستقلة ولكن متداخلة المدخلات. ضع محفزة وتسجيل الأقطاب حوالي 200 ميكرون وبصرف النظر.
- إذا لزم الأمر، حدد موقع القطب تسجيل آخر في الطبقة الطبقة الهرمية لتسجيل ارتفاع عدد السكان (الشكل 3A)، وعندما كلا منوقد تطرق أقطاب شريحة، وذلك باستخدام برنامج الحصول على، وإعطاء التحفيز اختبار للتأكد من إشارة fEPSP المناسبة.
ملاحظة: نحن نستخدم ثنائية الطور والبقول ثابت الجاري (مدة الدافع 0.1 مللي ثانية / نصف موجة) لتحفيز الاختبار. - مرة واحدة يتم الحصول على إشارة fEPSP المناسبة، وانخفاض بعناية الأقطاب حوالي 200 ميكرون عميقة استخدام المقابض المناورة الجميلة من المتلاعبين. سماح 20 دقيقة للشرائح لاسترداد. اختبار الاستقلال المسار مع إقران النبض تسهيل بروتوكول 27،28.
- بدوره على الأجهزة الكهربائية (التحفيز والتشجيع ومكبرات الصوت) لاستخدامها. جبل وتأمين محفزة وتسجيل الأقطاب في أصحاب شبكي من micromanipulators.
- المدخلات والمخرجات علاقة
- تحديد العلاقة بين المدخلات والمخرجات (التحفيز وارد مقابل fEPSP المنحدر) لكل المدخلات عن طريق قياس قيمة المنحدر في مجموعة من شدة الحالية. تنفيذ هذا بين 20 أمبير إلى 100 أمبير. ثم تعيين كثافة التحفيز لكل المدخلات للحصول على 40٪ من الحد الأقصى لfEPSP المنحدر. الحفاظ على هذا ثابت في كافة مراحل التجربة.
- بعد 15-20 دقيقة، بدء تسجيل خط الأساس. مراقبة والكامن الاستثاري بعد المشبكي المنحدر عن كثب خلال هذه الفترة، وإعادة تعيين كثافة التحفيز إذا كان المنحدر يتقلب أكثر من 10٪ من القيمة المحددة ويبدأ خط أساس جديد. سجل لا يقل عن 30 دقيقة أو 1 ساعة الأساس مستقر قبل المتابعة.
ملاحظة: للحصول على اختبار أو التحفيز خط الأساس، ونحن نستخدم أربعة الاحتلالات من 0.2 هرتز ثنائي الطور والبقول الحالية مستمرة (0.1 ميللي ثانية في قطبية) تعطى كل 5 دقائق. ثم يعتبر متوسط المنحدر من هذه الردود أربعة كما كرر واحدة. يتم تصفيتها على إشارات وتضخيمها من قبل الفرق مكبر للصوت، رقمية باستخدام تحويل التناظرية إلى الرقمية ورصدها عبر الإنترنت مع البرامج حسب الطلب.
- تحريض LTP / LTD باستخدام بروتوكولات التحفيز
ملاحظة: تم تصنيف كل LTP وLTD في وقت مبكر وأواخر LTP / LTD بناء على متطلبات تخليق البروتين. ترجمة الأخيرة تتطلب و / أو النسخ لأواخر صيانته [للمراجعة الاطلاع على 4]. مجموعة متنوعة من نماذج التحفيز الكهربائي يمكن specificallذ لحث على أشكال مختلفة من LTP وLTD.- WTET: 100 هرتز، 21 البقول الحالية مستمرة ثنائية الطور (0.2 ميللي ثانية لكل مرحلة).
- STET: ثلاث رشقات نارية من 100 البقول لثانية واحدة (100 هرتز) كل 10 دقيقة (نبض عرض 0.2 ميللي ثانية لكل مرحلة).
- 900 رشقات نارية خلال مدة 15 دقيقة. ويتكون من 3 1 انفجار البقول (0.2 مللي ثانية عرض) مع فاصل interpulse من 50 مللي ثانية (20 هرتز). الفاصل الزمني انفجار أمور هو 1 ثانية (عدد النبضات 2700).
5. تنظيف غرفة شريحة ونظام الإرواء
- بعد تسجيل قد انتهت، وجمع شرائح الحصين لمزيد من التحليل الكيميائي الحيوي أو تجاهل آخر مناسب. إيقاف إمدادات كربوجين وتحكم في درجة الحرارة. غسل الفوار كربوجين في الماء المقطر.
- تنظيف الشباك تماما مع الفرشاة والماء المقطر. غسل تلاعب لمدة 15-20 دقيقة مع الماء المقطر بمعدل تدفق أعلى. مرة واحدة في 3-4 أيام، وتغيير الماء المقطر فيحجرة أقل من الغرفة وأيضا تنظيف الغرفة بانتظام مع 3٪ من محلول بيروكسيد الهيدروجين لتجنب نمو الفطريات.
النتائج
تم استخدام منهجية وصفها لدراسة أشكال طويلة الأمد من LTP / LTD والتفاعلات النقابي في مثل وضع علامات متشابك وعبر القبض على من شرائح الحصين الحادة من الفئران الكبار. وقد ثبت 23 هذه التقنية فعالة لإجراء التجارب مع كل من الفئران (ويستار) ومجموعة متنوعة من الماوس سلالات 30،31. وقد استخدمت منهجية بنجاح للتسجيلات LTP مستقرة تصل إلى 8-12 ساعة. 32
و'الوسم' التي وضعتها تكزيز ضعيفة من مدخل واحد (S1) يلتقط الناجمة عن تكزيز قوية من المدخلات أخرى مستقلة ولكن متداخلة "عبوات المرضى الجاهزة" (S2، الشكل 3B، والدوائر شغل) وبذلك تحول شكل المتحللة خلاف ذلك من LTP (في وقت مبكر -LTP) في S1 إلى واحد طويل الأمد (الشكل 3B، والدوائر المفتوحة) (على سبيل المقارنة من المبكر LTP الناجمة عن WTET نرى 20،33). عبوات المرضى الجاهزة التي استولت عليها الضعفاءبحاجة الى مجموعة تكزيز العلامة لا تأتي بالضرورة من التي يسببها STET في وقت متأخر من LTP ولكن يمكن أيضا أن تقدم من قبل SLFS التي يسببها أواخر LTD. ويشار إلى هذا النوع من التفاعل الإيجابي بين النقابي LTP وLTD باسم "عبر وضع علامات / القبض على". وWTET التي يسببها المبكر LTP في S1 يحصل المسلحة في وقت متأخر من LTP (الشكل 3C، والدوائر المفتوحة) عن طريق الاستيلاء على عبوات المرضى الجاهزة التي تقدمها SLFS التي يسببها أواخر LTD في S2 (الشكل 3C، والدوائر شغل). إحصائية تم الإبقاء التقوية كبيرة أو الاكتئاب في S1 و S2 في كلتا الحالتين بالمقارنة مع خط الأساس الخاصة بها (يلكوكسن الاختبار؛ P <0.05).
للتفاعل العلامة PRP أن يحدث، النظام الزمني من الحدثين (ضعيف قبل قوامها / قوي قبل ضعيفا) ليست حاسمة طالما لا يزال النافذة الزمنية بين الحدثين في نطاق 30-60 دقيقة. قد يكون من الحكمة لتشمل متشابك الثالث، مستقلا، ولكن التداخل فيوضع واستخدامه كوسيلة لمراقبة خط الأساس لمراقبة استقرار التسجيلات. يجب التحقق من صحة بروتوكولات التحفيز الكهربائية المستخدمة للحث على أشكال المبكر بها والمتأخرة من LTP / LTD في التجارب المدخلات واحد لالاتساق والموثوقية قبل استخدامها في التجارب STC. كما نود أن نؤكد على أهمية منهجية إعداد شريحة موضح في البروتوكول منذ نجاح هذه التجارب يعتمد بشكل كبير على نوعية الشرائح.
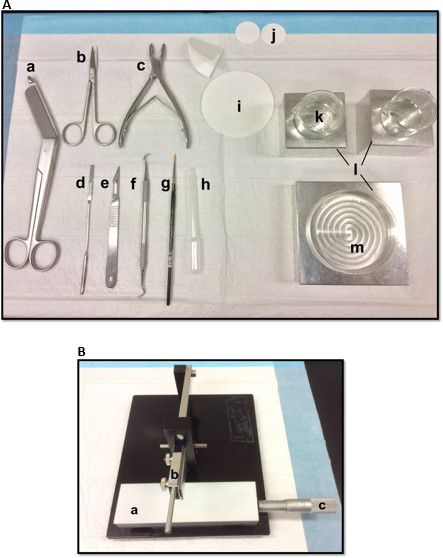
الشكل 1. (A) الأدوات المستخدمة في تشريح الحصين: (أ) ضمادة المقص (ب) ايريس المقص (ج) مقراض العظام (د) ملعقة رقيقة، (ه) المبضع عدد 11) و (قشارة المنجلية (ز) لينة فرشاة الطلاء -bristle (ح) من البلاستيك ماصة باستير (ط) ورقة فلتر (85mm و) (ي) ورقة فلتر (30MM) (ك) أكواب زجاج (ل) كتل الألومنيوم التبريد لتتناسب مع طبق بتري والأكواب(م) طبق بتري (B) دليل المروحية الأنسجة. (أ) منصة (ب) قطع ذراع مع شفرة صاحب (ج) رنيه ميكرومتر، القرار 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. الكهربية انشاء للتسجيلات الميدان المحتملين تتكون من (A) التحفيز والتشجيع (ب) مكبر للصوت التفاضلية (ج) التناظرية إلى الرقمية تحويل (د) راسم (ه) جهاز كمبيوتر مع برنامج الحصول على (و) Vibration- مقاومة فوق المنضدة (ز) المجهر مع> 4X التكبير (ح) واجهة الدماغ شريحة غرفة (ط) نظام نضح لACSF وكربوجين العرض (ي) تحكم في درجة الحرارة (ك) مصدر إضاءة (ل) المتلاعبين مع أصحاب الكهربائي. (B) واجهة الدماغ شريحةغرفة (C) و (D) شرائح قرن آمون في غرفة واجهة. (E) غير القابل للصدأ القطب الصلب مختومة في الزجاج الشعرية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
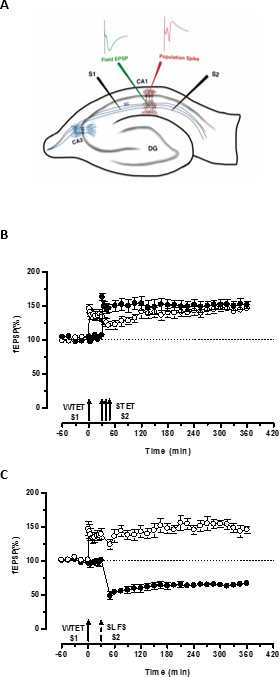
الشكل 3. (A) تمثيل تخطيطي من قرن آمون شريحة ومسرى موقع عرضية لتسجيل حقل المحتملة: في هذا التمثيل، يتم وضع قطبين تحفيز (S1 و S2) في المشععة طبقة من المنطقة CA1 لتحفيز دولتين مستقلتين ولكن تداخل مدخلات متشابك على الخلايا العصبية CA1 الهرمية. قطبين تسجيل خارج الخلية، واحدة لتسجيل الميدان الكامن الاستثاري بعد المشبكي (احتمال مثير آخر متشابك) من مقصورة شجيري قمي وآخر لتسجيل الجسدية ارتفاع عدد السكان من الخلايا الهرميةالهيئات، وتقع في المشععة الطبقة والطبقة الهرمية على التوالي. CA1- قرن آمون المنطقة 1، CA3- قرن آمون المنطقة 3، التلفيف المسنن DG-والألياف ضمانات SC- شافر، S1- تحفيز الكهربائي 1، S2 تحفيز الكهربائي 2. (B) ضعيف أمام نموذج قوي لدراسة STC: تكزيز الضعيفة (WTET) يتم تطبيقها على S1 (الدوائر المفتوحة) لإحداث المبكر LTP تليها تكزيز قوية (STET) من S2 (الدوائر شغل) في 30 دقيقة للحث في وقت متأخر من LTP. من المبكر LTP في S1 يحصل المسلحة في وقت متأخر من LTP تظهر علامات والقبض على التفاعل (ن = 6) (C) ضعيف أمام نموذج قوي لدراسة شاملة لوضع علامات: هو فعل المبكر LTP التي كتبها WTET في S1 (دوائر مفتوحة)، يليه من تحريض أواخر LTD في S2 (الدوائر شغل) باستخدام SLFS بعد 30 دقيقة. في S1، يتم تحويل المبكر LTP إلى وقت متأخر من LTP دائم 6 ساعات تظهر عبر وضع علامات والقبض على (ن = 6). سهم واحد يمثل ضعف تكزيز بطلب للحصول على حمل المبكر LTP. الثلاثي من السهام يمثلتكزيز قوية لإحداث أواخر LTP. السهم المكسور يمثل نقطة الوقت الذي تم تطبيقه SLFS للمدخلات متشابك التمثيلي للحث أواخر LTD. أشرطة الخطأ تشير SEM. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
شريحة الحصين الحادة هو نظام نموذجا ممتازا لدراسة LTP والعمليات اللدونة الفنية الأخرى مثل STC وعبر الالتقاط. أنه يحفظ الكثير من الشبكة الهيكلية الصفحي من الدوائر الحصين، يسمح المواقع القطب دقيقة وتقدم إلى جانب، منصة مفتوحة للتلاعب neuropharmacological السريع دون حاجز الدم في الدماغ.
توضح هذه المقالة منهجية لإعداد شرائح الحصين الحادة قابلة للحياة من الفئران الشباب البالغين واستخدامها لتحقيق STC وعبر العنونة. وقد أكدت الأبحاث السابقة أن نوع الجنس والعمر للحيوانات من العوامل الهامة التي يجب مراعاتها لاستخدامها في الدراسات الكهربية. وتستخدم 27،28 الحيوانات الكبار لذلك الشباب مع وظائف مستقبلات الكبار أعرب بالكامل (فئران ويستار الذكور الذين تتراوح أعمارهم بين 5-7 أسابيع). 23 عدم التماثل في الاتصالات بين الحصين اليسار واليمين وقد لوحظ في القوارض و29تم الإبلاغ عن اختلافات كبيرة في NMDA مستقبلات التعبير وكذلك 34. وقد استخدمنا الحصين الأيمن من أجل أن تكون متسقة مع دراساتنا LTP السابقة. 23،32 ومع ذلك، أي من الحصين يمكن استخدامها طالما يتم الحفاظ على الاتساق.
كما هو الحال في أي بروتوكول، فمن المهم جدا لأداء العزل وتقطيع الإجراءات بسرعة ولكن مع الحرص على أن لا تمدد الأنسجة التالفة، وأصدرت جافة أو ميتة. الاختلافات في درجة الحموضة ودرجة الحرارة والتركيب الايوني من الحلول يمكن أن يكون لها تأثير عميق على الجدوى من شرائح والنتائج. وبالتالي ينبغي تجنب مثل هذه الاختلافات. وقد لوحظ أن الغلوتامات إطلاق الكالسيوم التي تعتمد على مستقبلات التي تحدث خلال خطوات إعداد يمكن أن تؤثر بشكل لا رجعة فيه تخليق البروتين في الأنسجة العصبية 35،36، 37. ويمكن استخدام ماكينات تقطيع النسيج اليدوي تساعد على تقليل ذلك عن طريق السماح للعملية أن يتم الانتهاء بسرعة جدا بالمقارنة مع السادسbraslicers. ومع ذلك، العديد من المختبرات أيضا تستخدم على نحو فعال vibraslicers مع الاحتياطات اللازمة للحفاظ على سلامة شريحة. ثمة عامل آخر مهم هو أن تنظر إلى فترة حضانة طويلة قبل بدء التجارب. وقد لوحظ أن يكون حاسما حقا لتحقيق الاستقرار في مستويات الدولة وتفعيل كيناز التمثيل الغذائي في شرائح بعد أن تسبب الاضطرابات أثناء إعداد 23. هذا الاستقرار ضروري من أجل التناسق في التسجيلات على المدى الطويل. نعيد التأكيد على هذه الملاحظة واقتراح الساعات حضانة طويلة حوالي 3 ساعات.
ومن المعروف أن العديد من المعلمات التحفيز للحث على LTP، ولكن الآليات الجزيئية أثارت في كل حالة قد لا تكون هي نفسها (للمراجعة نرى 38). هذا يمكن أن تؤثر على متانة وغيرها من خصائص LTP التي، بدورها، يمكن أن تؤثر على نتائج متشابك علامات والقبض على التجارب. وبالتالي فمن المهم للتحقق من صحة نماذج التحفيز وخصائصمن LTP المنتزعة تحت ظروف المختبر الأداء والحفاظ على الاتساق.
ونحن عموما لا تعتبر التجارب مع كبير جدا وابلا من الألياف قبل المشبكي ومع fEPSPs القصوى أقل من 0.5 فولت والتجارب التي تنطوي على تغييرات كبيرة في كرة الألياف أثناء يتم رفض أيضا التسجيلات. وعلاوة على ذلك، في حين أن أداء مسار اثنين أو ثلاثة مسار-التجارب، فمن المهم لضمان استقلال الطريق. هذا يمكن القيام بها مع إقران النبض بروتوكول التيسير 28.
واحد السلبي للنظم تسجيل واجهة هو تشكيل قطرات التكثيف على الأقطاب خلال ساعات تسجيل طويلة بسبب الاختلافات في درجات الحرارة والرطوبة بين الغرفة والمناطق المحيطة بها. تحتاج هذه القطرات إلى أن نشف بعناية من وقت لآخر. وإلا فإن قطرات يمكن أن يتقطر على شرائح وتؤدي إلى اضطراب أو حتى فقدان الإشارات. نعالج هذه عادة بذ النشاف بمهارة قطرات تسترشد تحت المجهر باستخدام ورق الترشيح مرهف الفتيل، دون لمس الأقطاب الكهربائية. ومع ذلك، فإن أفضل حل هو استخدام نظام التدفئة المركزية، مثل نظام ETC التي وضعها الباحثون في جامعة أدنبرة.
وعلى صعيد الختامية، ومجموعة متنوعة من المنهجيات موجودة في المختبرات في جميع أنحاء العالم التي تستخدم لإعداد شرائح الحصين لأغراض تجريبية مختلفة. كل من الإجراء يقدم بعض المزايا على الآخر. واحد يحتاج إلى تحسين بعناية التفاصيل الدقيقة للبروتوكول لتتناسب مع الغرض من التجربة. نأمل أن هذه المادة تساعد في تحسين بعض جوانب المنهجية لدراسة العمليات في وقت متأخر من النقابي مثل STC وعبر الالتقاط.
Disclosures
برعاية الوصول المفتوح لهذه المقالة الفيديو التي Cerebos المحيط الهادئ المحدودة.
Acknowledgements
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materials
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
References
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved