Method Article
Untersuchung von Synaptic Tagging / Erfassung und Lang Capture mit akuten Schnitten des Hippocampus von Nagetiere
In diesem Artikel
Zusammenfassung
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Zusammenfassung
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Einleitung
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protokoll
Alle tierischen Verfahren wurden von der Institutional Animal Care und Verwenden Committee (IACUC) der National University of Singapore zugelassen.
1. Herstellung von künstlichen Liquor (ACSF)
- Vorbereitung des ACSF, bestehend aus (in mM) 124 NaCl, 3,7 KCl, 1,0 MgSO 4 · 7H 2 O, 2,5 CaCl 2 · 2H 2 O, 1,2 KH 2 PO 4, 24,6 NaHCO 3 und 10 D-Glucose. Sicherstellen, dass der pH-Wert des ACSF liegt zwischen 7,2 bis 7,4, wenn geblasen, um mit 95% O 2 und 5% CO 2 Mischung (Carbogen). 21 Verwenden Sie diese ACSF sowohl für die Präparation, Scheibe Vorbereitung und für die Perfusion während der elektrophysiologischen Ableitungen Sättigung.
HINWEIS: Verwenden Sie saubere Geräte zum Messen und Halten des ACSF. Verwendung unreinen Gerät kann bis bewölkt Lösungen oder Bildung von Niederschlägen führen. Verwenden Sie deionisiertes Wasser für alle Zubereitungen. - Bereiten Sie einen 2 L 10x ACSF Lager ohne NaHCO3 und D-Glucose in einem volumetrischen Kolben. In Reagenzien an VE-Wasser in der folgenden Reihenfolge: NaCl (144.96g), KCl (5,52 g), MgSO 4 · 7H 2 0 (4,92 g), CaCl 2 · 2H 2 0 (7,56 g), KH 2 PO 4 (3,28 g) und Top-up auf ein Volumen von 2 L. Stir kontinuierlich für mindestens 30 min mit einem Magnetrührer, um sicherzustellen, alle Reagenzien gelöst sind. Bewahren Sie die Lager in 4 ° C lagern und innerhalb von 2 Wochen.
- Vor der Präparation und den Experimenten verdünnt das ACSF Lager in einem volumetrischen Kolben zusammen mit der Zugabe der erforderlichen Mengen an NaHCO 3 und D-Glucose. Für 1 L Lösung, verdünnter 100 ml der auf 1 L nach der Zugabe von 2,07 g NaHCO 3 und 1,802 g D-Glucose. Die ACSF sollte frei von Niederschlag oder ungelöste Partikel eine klare Lösung zu sein.
- Coole etwa 200-300 ml ACSF auf Eis, um bei der Präparation verwendet werden. Sicherzustellen, dass die für die Präparation verwendet ACSF zwischen 2-4 ° C. Verwenden Sie die restlichen ACSF für electrophysiological Experimenten. Blasen alle ACSF Lösungen mit Carbogen (5% CO 2, 95% O 2) kontinuierlich Sättigung. Während des Wartens auf die ACSF abkühlen, bereiten Sie die Dissektion Bereich und die Schnittkammer.
2. Vorbereitung der Schnittstellenkammer
HINWEIS: Eine Schnittstelle Hirnschnittkammer, für die Inkubation der Scheiben und während der elektrophysiologischen Ableitungen Beibehaltung (2B) verwendet wird, besteht aus zwei Kammern. Die untere Kammer enthält destilliertes Wasser bei 32 ° C gehalten wird durch eine Temperatursteuerung und kontinuierlich mit Carbogen durchgeblasen.
- Schalten Sie den Temperaturregler und speichern Sie ihn bei 32 ° C. Die obere Kammer für 10 bis 15 Minuten mit dem durch die Zuflussrohr läuft destilliertem Wasser waschen. Stellen Sie sicher, dass die obere Kammer ist sauber, bevor Sie das Netz. Überprüfen Sie, dass Wasserniveau in der unteren Kammer ist etwa 70% mit destilliertem Wasser gefüllt.
- Legen Sie dienet in der oberen Kammer, um eine Auflagefläche für Scheiben (2C) zu liefern. Einstellen der Ausflussrohr, um sicherzustellen, dass die Lösung Pegel ausreichend die gesamte Fläche der Reinbenetzung. Setzen Sie den Deckel über dem Netz, um eine befeuchtete Carbogen Atmosphäre innerhalb der oberen Kammer zu halten.
- Stellen Sie die Flussrate auf 1 ml / min. Halten Sie diese Durchflussrate in der gesamten Scheibe Inkubationszeit und des Experiments. Starten carbogenating die frisch zubereiteten 1x ACSF und tauchen Sie den Zulaufschlauch in das ACSF. Lassen Sie 20 Minuten für die ACSF mit Carbogen und für die obere Kammer, mit ihm gefüllt werden gesättigt werden.
3. Herstellung von akuten Schnitten des Hippocampus
HINWEIS: Die Präparation Protokoll besteht aus (1) Entfernung von Gehirn aus dem Tier in kaltem ACSF und (2) Isolierung und Schneiden des Hippocampus. Damit Neuronen lebensfähig zu bleiben, zu isolieren, und legen Sie das Gehirn in kaltem ACSF schnell und runden das ganze abProzess einschließlich Schneiden ca. 3-5 min.
- Entfernung des Gehirns in kaltes ACSF
- Legen Sie die Dissektion Werkzeuge in der in 1A gezeigten Weise. Ordnen die Werkzeuge entsprechend der Reihenfolge ihrer Verwendung, um die Dissektion zu erleichtern. Bevor Sie beginnen, sicherzustellen, dass alle Dissektionswerkzeuge sind bereit.
- Montieren einer Rasierklinge, mit Ethylacetat, absolutem Ethanol und destilliertem Wasser gereinigt, auf die manuelle Gewebe Chopper (1B), sichern Sie sie fest und sorgen dafür, dass die Schneidkante gleichmäßig ausgerichtet sind. Test Zerhacken eines Stücks Filterpapier, um sicherzustellen, dass die Klinge fest angebracht ist. Stellen Sie den Schiebe Noniusmikrometer in seine Ausgangsposition.
- Euthanize das Tier unter Verwendung von Kohlendioxid (CO 2) in einem Induktionskammer und enthaupten mit Verbandschere oder Guillotine. Mit Hilfe einer Iris Schere, entfernen Sie die Haut und das Fell über dem Schädel. Einen Schnitt durch den hinteren So entfernen Sie die brainstem.Make einen kleinen Schnitt entlang the rechten Seite des Schädels und einer längeren Einschnitt auf der linken Seite.
VORSICHT! Nur einen kleinen Einschnitt an der Seite, die für die Experimente verwendet wird, um sie nicht zu beschädigen. Beim Einsetzen der Schere, stellen Sie sicher, dass die aufgebrachte Kraft nach oben, um Schädigungen des Gehirns zu vermeiden. - Den Schädel Entfernen Sie vorsichtig mit einem Knochen Rongeur ausgehend von der linken auf die rechte Seite des Schädels, um die Rinde zu offenbaren. Eine dünne Schicht von Dura kann auch gesehen werden. Die Frontplatten mit der Zange vorsichtig entfernen. Verringert sich die Dura zusammen mit den Stirnplatten.
VORSICHT! Achten Sie darauf, dass die Dura nicht durch das Hirngewebe zu schneiden. - Das verbleibende Dura, falls vorhanden, insbesondere in der Verbindung zwischen Cortex und Cerebellum mit dem flachen Ende einer Spachtel. Für die Schritte 3.1.5 und 3.1.6, halten Druck nach oben dh weg vom Gehirn um Beschädigungen zu vermeiden. Mit dem Spatel, sanft Schaufel das Gehirn in eine Petrischale mit kaltem und carbogenated ACSF (2-4 ° C) gefüllt, plaauf einem Aluminium-Kühlblock ced.
- Isolation des Hippokampus
- Mit einem Skalpell, stellen ein gerader Schnitt, um das Kleinhirn und anderen Schnitt zu entfernen, um den vorderen Teil des Gehirns (rund ein Viertel) zu entfernen. Einen flachen Schnitt entlang der Mittellinie.
- Die Rinde entfernen Sie vorsichtig mit einer Sichel-Scaler, ausgehend von der Mittellinie, um die dorsalen Hippocampus zu offenbaren. Entfernen Sie die Schicht der Hirnrinde über dem Hippocampus. Verwenden Sie den Fingern oder einer Pinzette abgewinkelt, um das Gehirn zu unterstützen. Machen Sie einen kleinen Schnitt an der Hippocampus Kommissur. Entfernen Sie vorsichtig die Hippocampus mit der Sichel Scaler ausgehend von den dorsalen Hippocampus mit Rollbewegungen.
VORSICHT! Seien Sie sanft, um zu vermeiden Dehnen und Reißen des Hippocampus. - Entfernen Sie alle Cortex und Bindegewebe um die isolierten Hippocampus mit der Sichel-Scaler.
- Schneiden des Hippocampus-Gewebe und die Übertragung der Scheiben auf die Schnittstelle Kammer
- Legen Sie ein Stück ACSF-getränkte Filterpapier (Grade 1, 30 mm) an der Schneidstufe des Handhobel. Scoop und legen Sie das Hippocampus-Gewebe auf das Filterpapier. Bewegen Das Filterpapier in den Hippocampus zu einer korrekten Ausrichtung in Bezug auf die Messer der Aufschnittmaschine auszurichten, so dass der Hippocampus in einem Winkel von etwa 70 o zum Fimbria geschnitten.
- Tupfen Sie die überschüssige Lösung rund um das Hippocampus-Gewebe mit einem gefalteten Filterpapier (Grade 1, 85 mm) Verlassen des Hippocampus etwas nass. Starten Sie Schneiden des Hippocampus quer. Scheibe und entsorgen Gewebe aus dem äußersten Ende des Hippocampus, wo die Schichtmorphologie ist nicht klar.
- Schneiden Sie die restlichen Gewebe in 400 & mgr; m-dicke Scheiben schneiden. Pick up Hippocampus sanft von der Klinge mit einer Bürste mit weichen Borsten mit sanften Wischbewegungen und legen Sie die Scheiben in einem kleinen Becherglas mit kaltem carbogenated ACSF gefüllt. Die obigen Schritte 3.3.1-3.3.3 so schnell wie möglich, da die Hippocampusgewebe wird der Luft ausgesetzt.
HINWEIS: In der Regel zwei Drittel des Hippocampus wird in Scheiben geschnitten, und 4-6 Scheiben mit klaren Morphologie hergestellt werden kann. - Übertragen Sie die Scheiben vorsichtig auf das Netz in der Schnittkammer mit einem sauberen Plastik Pasteur-Pipette mit einer breiten Spitze (durch Wegschneiden 2-3 cm von der Spitze aus). Vorsichtig stellen Sie die Position der Scheiben auf dem Netz unter Verwendung einer kleinen Spritze mit einer gebogenen Spitze. Positionieren Sie die Scheiben in einer Weise, die Elektroden Lage und Aufzeichnung ermöglicht. Überprüfen Sie, ob die Scheiben ausreichend ACSF umgeben sind aber nicht unter Wasser oder variabel (2C-D). Decken Sie die Kammer und inkubieren Sie die Scheiben für 2-3 Std.
HINWEIS: Die Pyramidenzellschicht in den gesunden Scheiben sollte eine gewisse Transparenz zu zeigen.
4. Aufzeichnung der CA3-CA1 synaptischen Antworten
HINWEIS: Die Elektrophysiologie Set-up für Feldpotential Aufzeichnung verwendet ist in 2A gezeigt. Ein FaraTag Käfig wird dringend empfohlen, wenn die elektrische Störungen ist außerhalb der Kontrolle nach der ordnungsgemäße Erdung der elektrischen Einstellungen. Viele verschiedene Arten von untergetaucht und Schnittkammern sind im Handel erhältlich. Allerdings sind Schnittkammern als Scheiben weisen robuster synaptischen Antworten in ihnen bevorzugt.
- Positionierung der Elektroden
- Einschalten des elektrischen Gerätes (Stimulatoren und Verstärker) verwendet werden. Montieren und sichern Sie die anregende und Aufzeichnungselektroden in den Plexiglas Inhaber der Mikromanipulatoren.
HINWEIS: Wir verwenden monopolare, lackbeschichtet, Edelstahl-Elektroden von 5 MOhm Widerstand für beide anregende und Aufzeichnungszwecke. - Vor der Anwendung setzen Sie diese Elektroden im Inneren der zogene Glaskapillaren und mit Epoxid-Kleber Aussetzen nur kleiner Teil der Elektrodenspitze (2E). Das gibt Kraft, um den sonst schlanken Elektroden und hilft, sie fest in der ele sichernctrode Inhaber.
- Unter dem Mikroskop geführt, positionieren Sie die Stimulationselektrode (n) in der Stratum radiatum der CA1-Region um die Schaffer Sicherheiten Fasern und die Aufzeichnungselektrode in der apikalen dendritischen Region CA1 zu stimulieren, um Feld-EPSP (fEPSP) Antworten aufzuzeichnen.
HINWEIS: Annäherung an die Flüssigkeitsoberfläche oberhalb der Scheibe mit den Elektroden gibt einen Sound, der schnell die Oberfläche der Scheibe (zur Verfügung gestellt, ist der Verstärker mit einem Lautsprecher verbunden ist) zu finden hilft. - Synaptischen Tagging und Erfassungsversuchen entsprechend der Notwendigkeit des Experiments Position zwei oder drei Stimulationselektroden (S1, S2 oder S3) auf jeder Seite der Aufzeichnungselektrode, die zwei oder mehr unabhängige aber überlappende Eingänge stimulieren. Positionieren Sie die anregende und Aufzeichnungselektroden etwa 200 um auseinander.
- Ggf. Anderes Aufzeichnungselektrode im Stratum pyramidale Schicht zum Aufzeichnen population spike (3A) .Wenn sowohl dasElektroden haben die Scheibe berührt, mit der Erfassungssoftware, geben eine Teststimulation, um eine ordnungsgemäße fEPSP Signal zu gewährleisten.
HINWEIS: Wir verwenden zweiphasige, Konstantstromimpulse (Impulsdauer 0,1 ms / Halbwelle) für Teststimulation. - Sobald eine ordnungsgemäße fEPSP Signal erhalten wird, lassen Sie den Elektroden etwa 200 & mgr; m tief mit Feinbewegungsknöpfe der Manipulatoren. Lassen Sie 20 Minuten für die Scheiben zu erholen. Testen Sie den Weg der Unabhängigkeit mit einem gekoppelten Puls Erleichterung Protokoll 27,28.
- Einschalten des elektrischen Gerätes (Stimulatoren und Verstärker) verwendet werden. Montieren und sichern Sie die anregende und Aufzeichnungselektroden in den Plexiglas Inhaber der Mikromanipulatoren.
- Eingabe-Ausgabe-Beziehung
- Bestimmen Sie die Input-Output-Relation (afferente Stimulation vs fEPSP Steigung) für jeden Eingang durch Messung der Steigungswert in einem Bereich von Stromstärken. Führen Sie diese zwischen 20 uA bis 100 uA. Setzen Sie dann die Stimulationsintensität für jeden Eingang bis 40% der maximalen fEPSP Steigung zu erhalten. Bewahren Sie diese Konstante während des Experiments.
- Nach 15-20 Minuten, starten Sie die Aufnahme der Basislinie. Überwachen Sie die fEPSP Hang eng in dieser Zeit und setzen Sie die Reizintensität, wenn die Steigung schwankt mehr als 10% vom Sollwert und starten Sie eine neue Baseline. Nehmen Sie mindestens 30 Minuten oder 1 Stunde stabile Grundlinie, bevor Sie fortfahren.
HINWEIS: Für den Test oder der Baseline-Stimulation verwenden wir vier Durchläufe von 0,2 Hz biphasisch konstanter Stromimpulse (0,1 ms pro Polarität) gegeben alle 5 min. Eine mittlere Steigung der vier Reaktionen wird dann als eine Wiederholungs betrachtet. Die Signale werden gefiltert und durch einen Differenzverstärker verstärkt wird, mit Hilfe eines Analog-zu-Digital-Wandler und mit maßgeschneiderten Software online überwacht.
- Induktion von LTP / LTD mit Stimulationsprotokolle
HINWEIS: In der LTP und LTD wurden bereits klassifizierte und späte-LTP / LTD basierend auf den Anforderungen der Proteinsynthese; Letzteres erfordert eine Translation und / oder Transkription für seine späte Wartung [zur Übersicht siehe 4]. Eine Vielzahl von elektrischen Stimulations Paradigmen können specifically induzieren die verschiedenen Formen der LTP und LTD.- WTET: 100 Hz, 21 biphasischen Konstantstromimpulse (0,2 msec pro Phase).
- STET: Drei Ausbrüche von 100 Impulse für eine Sekunde (100 Hz) alle 10 min (Pulsbreite von 0,2 ms pro Phase).
- 900 Bursts über einen 15 Minuten Dauer. 1 Burst besteht aus 3 Pulse (0,2 ms Breite) mit einem Zwischenpulsintervall von 50 ms (20 Hz). Die Inter-Burst-Intervall 1 sec (Gesamtzahl der Impulse 2700).
5. Reinigung der Schnittkammer und Perfusion System
- Nachdem die Aufzeichnung beendet ist, sammeln die Hippocampus-Schnitten für weitere biochemische Analyse oder auch in geeigneter Weise zu verwerfen. Schalten Sie das Carbogen Versorgung und Temperaturregler. Waschen Sie die Carbogen Bubbler in destilliertem Wasser.
- Gründlich reinigen das Netz mit einer Bürste und destilliertem Wasser. Waschen Sie die Anlage für 15-20 Minuten mit destilliertem Wasser mit einer höheren Durchflussrate. Einmal in 3-4 Werktagen, ändern Sie die destilliertes Wasser in dieuntere Fach der Kammer und auch sauber die Kammer regelmäßig mit 3% Wasserstoffperoxid-Lösung Pilzwachstum zu vermeiden.
Ergebnisse
Die beschriebene Methode wurde verwendet, um lang anhaltende Form von LTP / LTD und ihre assoziativen Wechselwirkungen wie synaptischen Tagging und Queraufnahme von akuter Hippocampusschnitten von adulten Ratten. 23. Diese Technik hat sich als wirksam für Experimente bei Ratten nachgewiesen (Wistar) und eine Vielzahl von Mausstämmen 30,31. Die Methode wurde erfolgreich zur stabilen LTP-Aufnahmen von bis zu 8-12 Stunden verwendet worden. 32
Der "Tag" durch die schwache Tetanisierung der einen Eingang (S1) eingestellt fängt die 'PRPs' durch die starke Tetanisierung eines anderen unabhängigen, aber überlappenden Eingangs induzierte (S2; 3B, gefüllte Kreise), wodurch die Umwandlung der sonst verfallende Form der LTP (Anfang -LTP) in S1 in eine lang anhalt einem (3B, offene Kreise) (Zum Vergleich der frühen LTP durch WTET induzierte siehe 20,33). Die durch die schwache erfasst PRPsTetanisierung set tag nicht notwendigerweise von der STET-induzierte late-LTP kommen, sondern kann auch durch die SAKE-induzierte late-LTD zur Verfügung gestellt werden. Diese Art von positiven assoziativen Wechselwirkung zwischen LTP und LTD wird als "Cross-Tagging / capture" bezeichnet. Die WTET-induzierten frühen LTP in S1 wird bis späten LTP (3C, offene Kreise) durch die Erfassung der PRPs durch die SAKE-induzierte late-LTD in S2 vorgesehen (3C, ausgefüllte Kreise) verstärkt. Statistisch signifikante Potenzierung oder Depression in S1 und S2 in beiden Fällen beibehalten wird, wenn gegenüber den eigenen Basislinie (Wilcoxon-Test, p <0,05).
Für das Tag-PRP-Interaktion zu treten, (schwach-before-starke / strong zuvor schwach) ist die zeitliche Reihenfolge der beiden Ereignisse nicht entscheidend, solange das Zeitfenster zwischen den beiden Ereignissen im Bereich von 30 bis 60 bleibt Minuten. Es wäre klug, um einen dritten, unabhängigen, aber überlappenden synaptischen in beinhaltengesetzt und verwenden Sie es als Ausgangssteuerung, um die Stabilität der Aufnahmen zu überwachen. Die elektrischen Stimulationsprotokolle verwendet werden, um Früh- und Spätformen LTP / LTD induzieren, muss im Einzeleingabeversuche für die Konsistenz und Zuverlässigkeit, bevor Sie sie in STC Experimente validiert werden. Wir möchten auch auf die Bedeutung der im Protokoll beschriebene Scheibe Vorbereitung Methodik betonen, da der Erfolg dieser Experimente stützt sich stark auf die Qualität der Scheiben.
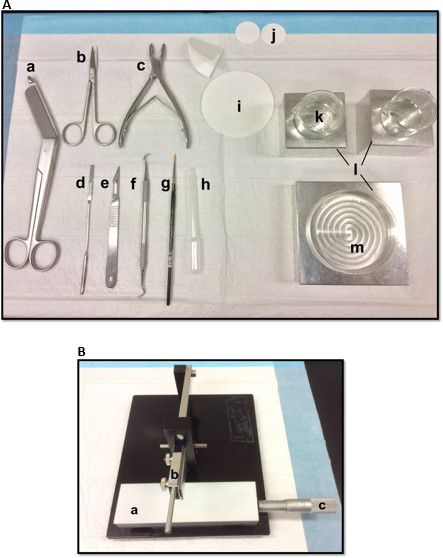
Abbildung 1. (A) Werkzeuge in der Präparation der Hippocampus verwendet: (a) Verbandschere (b) Iris Schere (c) Hohlmeißel (d) Thin Spachtel, (e) Scalpel Nummer 11 (f) Sichel-Scaler (g) Weiche -bristle Pinsel (h) Kunststoffpasteurpipette (i) Filterpapier (85mm) (j) Filterpapier (30 mm) (k) Bechergläser (l) Aluminiumkühlblöcke auf Petrischale und Becher passen(m) Petrischale. (B) Manuelle Gewebe Chopper. (a) Platform (b) Schneiden Arm mit Blatthalter (c) Noniusmikrometer, Auflösung 10 Mikrometer. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Elektroaufbau für Feldpotentialaufzeichnungen, die aus (A) Stimulatoren (b) einen Differenzverstärker (c) einen Analog-Digital-Umsetzer (D) Oszilloskop (e) Computer mit Erfassungssoftware (f) Vibrations- beständige Tischplatte (g) Mikroskop mit> 4-fache Vergrößerung (h) Schnittstelle Hirnschnittkammer (i) ein Perfusionssystem für ACSF und Carbogen Versorgung (j) Temperaturregler (k) eine Beleuchtungsquelle (l) Manipulatoren mit Elektrodenhalter. (B) Schnittstelle Gehirn-sliceKammer. (C) und (D) des Hippocampus in der Schnittstellenkammer. (E) Edelstahl-Elektrode in einer Glaskapillare versiegelt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
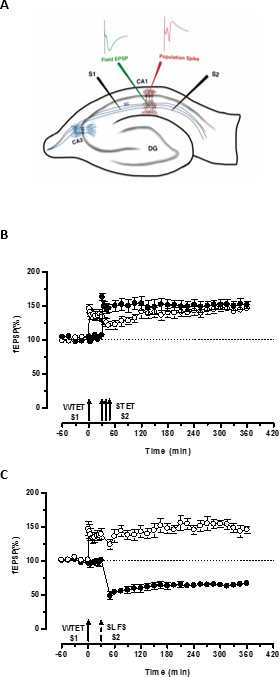
Abbildung 3. (A) Schematische Darstellung eines Quer Hippocampus Scheibe und Elektrode Standort für Feldpotential Aufnahme: In dieser Darstellung werden zwei Stimulationselektroden (S1 und S2) im Stratum radiatum der CA1-Region positioniert, um zu stimulieren zwei unabhängige, aber überlappenden synaptischen Eingänge auf CA1 Pyramidenzellen. Zwei extrazellulären Aufzeichnungselektroden, ein bis Feld EPSP (exzitatorische postsynaptische Potential) von der apikalen dendritischen Fach aufzunehmen und ein anderes zu somatischen population spike von der Pyramidenzelle aufnehmenEinrichtungen sind in dem Stratum radiatum und Stratum pyramidale beziehungsweise. CA1- Ammonshorn-Region 1, CA3- Ammonshorn Bereich 3, GD, Gyrus dentatus, SC- Schaffer Sicherheiten Fasern, S1- Stimulationselektrode 1, S2-stimulierenden Elektrode 2 (B) Schwache vor starken Paradigma STC studieren: Schwach Tetanisierung (WTET) mit S1 zum Induzieren early-LTP gefolgt von starken Tetanisierung (STET) von S2 (ausgefüllte Kreise) bei 30 min bis späten LTP zu induzieren aufgebracht (offene Kreise). Die frühe-LTP in S1 wird bis späten LTP verstärkt, die Tagging und erfassen Interaktion (n = 6), (C) Schwach vor starken Paradigma für die grenzüber Tagging studieren. Früh-LTP durch WTET in S1 (offene Kreise), gefolgt induzierte durch die Induktion von Spät LTD in S2 (ausgefüllte Kreise) mit SLFS nach 30 min. In S1 wird die Early-LTP bis späten LTP verwandelt dauerhaften 6 Stunden zeigt Quer Tagging und Capture (n = 6). Einzel Pfeil stellt schwachen Tetanisierung zur Induktion der frühen LTP angewendet. Triplet der Pfeile darstelltstarke Tetanisierung zur Induktion späten LTP. Die gestrichelten Pfeil repräsentiert den Zeitpunkt, zu dem SAKE wurde dem Vertreter der synaptischen Eingang angelegt, um spät LTD induzieren. Fehlerbalken zeigen SEM. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Akuter Hippocampusschnitt ist ein ausgezeichnetes Modellsystem für die Untersuchung von LTP und andere funktionelle Plastizität Prozesse wie STC und Queraufnahme. Es bewahrt viel von der laminaren Strukturnetz der Hippocampus-Schaltungen ermöglicht eine präzise Elektrodenstellen und bietet neben, eine offene Plattform für die schnelle neuro Manipulation ohne Blut-Hirn-Schranke.
Dieser Artikel beschreibt die Methodik zur Herstellung von lebensfähigen akuten Schnitten des Hippocampus von jungen erwachsenen Ratten und mit ihnen zu STC und Cross-Tagging zu untersuchen. Zurück Forschung hat betont, dass Geschlecht und Alter der Tiere sind wichtige Faktoren, um für den Einsatz in elektrophysiologischen Studien zu berücksichtigen. 27,28 Daher junge erwachsene Tiere mit voll zum Ausdruck Erwachsenen Rezeptorfunktionen (männliche Wistar-Ratten im Alter von 5-7 Wochen) verwendet werden. 23 Asymmetrien in den Verbindungen zwischen den linken und rechten Hippocampus bei Nagern 29 festgestellt undHauptunterschiede in der NMDA-Rezeptor-Expression haben sowie 34 gemeldet. Wir haben die rechten Hippocampus um jedoch verwendet im Einklang mit unseren früheren LTP Studien. 23,32 entweder der Hippocampi werden, solange die Konsistenz aufrechterhalten werden.
Wie in jedem Protokoll, ist es sehr wichtig, die Isolation und Schneiden Verfahren schnell, aber darauf achten, dass das Gewebe nicht unter Spannung steht, beschädigt, trocken oder hypoxischen gemacht zuführen. Die Schwankungen des pH-Wertes, der Temperatur und Ionenzusammensetzung der Lösungen können tiefgreifende Wirkung auf die Lebensfähigkeit der die Scheiben und die Ergebnisse haben. Daher ist ein solcher Variationen sollten vermieden werden. Es wurde beobachtet, dass Glutamat-Rezeptor-abhängige Calciumfreisetzung während der Herstellungsschritte auftreten irreversibel beeinflussen Proteinsynthese in Nervengewebe 35,36, 37. Mit manuellen Gewebeschneidemaschinen können helfen, dies, indem das Verfahren zu minimieren, um sehr schnell abgeschlossen werden, verglichen mit vibraslicers. Allerdings sind viele Labore auch effektiv nutzen vibraslicers mit notwendigen Vorkehrungen, um slice Lebensfähigkeit zu bewahren. Ein weiterer wichtiger Faktor ist die lange Inkubationszeit vor dem Start der Experimente. Dies wurde festgestellt, um wirklich von entscheidender Bedeutung für die Stabilität in Stoffwechsellage und Kinase-Aktivierung Niveaus in den Scheiben, nachdem die Störung während der Vorbereitung 23 verursacht zu erreichen. Eine solche Stabilität ist für die Einheitlichkeit der Langzeitaufzeichnungen notwendig. Wir erneut zu betonen, auf dieser Beobachtung und schlagen die lange Inkubationszeit Zeiten von etwa 3 Stunden.
Eine Vielzahl von Stimulationsparameter sind dafür bekannt, LTP zu induzieren, aber die molekularen Mechanismen, die in jedem Fall hervorgerufen möglicherweise nicht die gleichen sind (für einen Überblick siehe 38) sein. Dies kann die Haltbarkeit und andere Eigenschaften der LTP, die wiederum die Ergebnisse der synaptischen Tagging und Capture Experimente betreffen beeinflussen. Daher ist es wichtig, die Stimulations Paradigmen und Merkmale validierender hervorgerufenen LTP unter den Bedingungen der Durchführung von Labor- und die Konsistenz.
Wir in der Regel nicht Experimenten betrachten Sie mit sehr großen präsynaptischen Faser Volleys und mit maximaler fEPSPs weniger als 0,5 mV und die Experimente mit erheblichen Veränderungen in der Faser volley während der Aufnahmen werden ebenfalls abgelehnt. Während ferner die Durchführung von zwei-Weg oder Drei-Weg-Experimente ist es wichtig, den Weg Unabhängigkeit zu gewährleisten. Dies kann mit einem gekoppelten Puls Erleichterung Protokoll 28 durchgeführt werden.
Ein Nachteil der Schnittstelle Aufzeichnungssystemen ist die Bildung von Kondensationstropfen auf den Elektroden während der langen Aufzeichnungszeiten aufgrund der Temperatur- und Feuchtigkeitsunterschiede zwischen der Kammer und der Umgebung. Diese Tröpfchen müssen sorgfältig von Zeit zu Zeit ausgelöscht werden. Andernfalls werden die Tröpfchen auf die Scheiben abtropfen und behindern oder sogar Verlust der Signale. Wir in der Regel bewältigen diese by gekonnt Blotting die Tropfen unter dem Mikroskop mit einem schlanken Filterpapierdocht geführt, ohne Berührung der Elektroden. Allerdings wäre die beste Lösung sein, eine zentrale Heizungsanlage, wie der ETC-System von der University of Edinburgh Forschern entwickelt verwenden.
Auf eine abschließende Bemerkung, eine Vielzahl von Methoden bestehen in Laboratorien weltweit, die zur Herstellung von hippocampalen Schnitten für verschiedene experimentelle Zwecke verwendet. Jedes der Verfahren bietet einige Vorteile gegenüber den anderen. Man muss sorgfältig optimiert die kleinsten Details des Protokolls, um den Zweck des Experiments entsprechen. Wir hoffen, dass dieser Artikel hilft bei der Verbesserung der einige Aspekte der Methodik zur Untersuchung spät assoziative Prozesse wie STC und Cross-Capture.
Offenlegungen
Offener Zugang zu diesem Video Artikel wird von Cerebos Pacific Limited gesponsert.
Danksagungen
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materialien
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Referenzen
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten