Method Article
חקירה של Synaptic תיוג / לכידה וצלב-לכידה באמצעות חריפות בהיפוקמפוס פרוסות ממכרסמים
In This Article
Summary
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Abstract
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introduction
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocol
נהלי כל החיה אושרו על ידי הוועדה המוסדית הטיפול בבעלי חיים והשימוש (IACUC) מהאוניברסיטה הלאומית של סינגפור.
1. הכנת הנוזל השדרתי המלאכותי (ACSF)
- הכן את ACSF בהיקף של (מ"מ) 124 NaCl, 3.7 KCl, 1.0 MgSO 4 .7H 2 O, 2.5 CaCl 2 .2H 2 O, 1.2 KH 2 PO 4, 24.6 NaHCO 3, ו -10 D-גלוקוז. להבטיח את ה- pH של ACSF הוא בין 7.2-7.4 כאשר בועות לרוויה עם 95% O 2 ו -5% תערובת CO 2 (carbogen). 21 השתמשו ACSF זה עבור שתי הנתיחה, הכנת פרוסה ולזלוף במהלך קלטות אלקטרו.
הערה: השתמש במנגנון נקי למדידה ומחזיק ACSF. שימוש במנגנון נקי עלולה להוביל לפתרונות או היווצרות של משקעים מעונן. השתמש במים ללא יונים לכל ההכנות. - הכן מלאי ACSF 10x 2 L לא כולל NaHCO 3 ו- D-גלוקוז בבקבוק נפח. להוסיף חומרים כימיים למים ללא יונים בסדר הבא: NaCl (144.96g), KCl (5.52g), 4 MgSO .7H 2: 0 (4.92g), CaCl 2 .2H 2 0 (ז 7.56), KH 2 PO 4 (3.28 ז) ועליון עד נפח של 2 ל 'מערבבים ברציפות לפחות 30 דקות באמצעות stirrer מגנטי כדי להבטיח את כל חומרים כימיים מומסים. אחסן את המניה ב 4 o C ולהשתמש בתוך 2 שבועות.
- לפני הנתיחה והניסויים, לדלל את מניות ACSF בבקבוק נפח יחד עם תוספת הסכומים הנדרשים של NaHCO 3 ו- D-גלוקוז. לפתרון 1 ליטר, לדלל של המניה 100 מיליליטר לליטר 1 לאחר הוספת 2.07 גר 'NaHCO 3 ו- D-גלוקוז 1.802 גרם. ACSF צריך להיות פתרון ברור ללא כל משקע או חלקיקים שלא נמס.
- מגניב על 200-300 מיליליטר של ACSF על קרח, לשימוש במהלך נתיחה. ודא שACSF משמש לניתוח הוא בין 2-4 מעלות צלזיוס. השתמש בACSF שנותר לelectropניסויי hysiological. כל פתרונות ACSF בועת הרוויה עם carbogen (5% CO 2, 95% O 2) ברציפות. בזמן ההמתנה לACSF להתקרר, להכין את השטח לנתיחה ותא פרוסה.
2. הכנת ממשק קאמרי
הערה: תא פרוסת מוח ממשק, המשמשת לדוגר את הפרוסות ושמירתם במהלך קלטות אלקטרו (איור 2), מורכב משני תאים. התא התחתון מכיל מים מזוקקים שמרו על 32 מעלות צלזיוס על ידי בקר טמפרטורה ומבעבע ברציפות עם carbogen.
- הפעל את בקר הטמפרטורה ומראש זה ב 32 מעלות צלזיוס. שטוף את החדר העליון במשך 10 עד 15 דקות על ידי הפעלת מים מזוקקים דרך צינור יבוא. ודא שהחדר העליון הוא נקי לפני הנחת הרשת. בדוק שמפלס המים בתא התחתון הוא כ -70% מלאים במים מזוקקים.
- הנח אתנקי בחדר העליון כדי לספק משטח מנוחה לפרוסות (איור 2 ג). התאם את צינורות יצוא כדי להבטיח שרמת הפתרון מספיק להרטיב את האזור כולו לרשת. מניחים את המכסה מעל הרשת כדי לשמור על אווירת carbogen humidified בתוך התא העליון.
- התאם את קצב הזרימה עד 1 מיליליטר / דקה. לשמור על קצב זרימה זה לאורך כל תקופת הדגירה הפרוסה והניסוי. התחל carbogenating ACSF 1x מוכן הטרי ולטבול את צינורות הזרימה לACSF. לאפשר 20 דקות לACSF להיות רווי בcarbogen ולחדר העליון להיות מלא עם זה.
3. הכנת פרוסות בהיפוקמפוס חריפה
הערה: פרוטוקול הנתיחה מורכב (1) להסרת של מוח מבעלי החיים לACSF קר ו( 2) בידוד וחיתוך של ההיפוקמפוס. על מנת שתאי העצב להישאר קיימא, לבודד ולמקם את המוח בACSF הקר במהירות ולהשלים את כלתהליך כולל חיתוך בתוך 3-5 דקות.
- ההסרה של המוח לACSF הקר
- הנח את הכלים לנתיחה באופן שמוצג באיור 1 א. מסדרים את הכלים על פי סדר שימוש כדי להקל על תהליך הניתוח. לפני שמתחיל, להבטיח את כל הכלים לנתיחה מוכנים.
- הר סכין גילוח, לנקות עם אתיל אצטט, אתנול מוחלט ומים מזוקקים, על מסוק הרקמה הידני (איור 1), לאבטח אותו בחוזקה ולהבטיח כי חוד החנית מיושר באופן שווה. מבחן קיצוץ פיסת נייר סינון כדי להבטיח שהלהב מאובטח היטב. הגדר את מיקרומטר Vernier הזזה לעמדת המוצא שלה.
- להרדים את החיה באמצעות פחמן דו חמצני (CO 2) בתא אינדוקציה ולערוף עם מספריים תחבושת או גיליוטינה. באמצעות מספריים איריס, להסיר את העור ופרווה מעל הגולגולת. לעשות חתך דרך האחורי כדי להסיר את brainstem.Make חתך קטן לאורך הדואר צד ימין של הגולגולת וחתך כבר בצד השמאל.
זהירות! הפוך רק חתך קטן בצד שמשמש לניסויים, כדי למנוע פגיעה בו. כאשר מכניסים את המספריים, לוודא כי הכוח ליישם הוא כלפי מעלה, כדי למנוע נזק למוח. - מוציא בזהירות את הגולגולת עם עצם rongeur מתחיל משמאל לצד ימין של גולגולת כדי לחשוף את הקליפה. שכבה דקה של דורה ניתן גם לראות. מוציא בזהירות את הצלחות חזיתיות עם rongeur. הסר ביותר של הדורה, יחד עם הצלחות הקדמיות.
זהירות! היזהר שהדורה לא לחתוך דרך רקמת המוח. - הסר את הדורה שנותרה, אם בכלל, במיוחד בצומת בין קליפת המוח ובמוח קטן עם הקצה השטוח של מרית. לצעדים 3.1.5 ו3.1.6, לשמור על לחץ כלפי מעלה כלומר, מן המוח, כדי למנוע פגיעה בו. שימוש במרית, בעדינות לגרוף את המוח לתוך צלחת פטרי מלאה ב( 2-4 מעלות צלזיוס) הקרה וACSF carbogenated, PLACED על בלוק קירור אלומיניום.
- בידוד של ההיפוקמפוס
- באמצעות אזמל, לעשות חתך ישר להסיר את המוח הקטן וקיצוץ נוסף כדי להסיר את החלק הקדמי של המוח (הרבעון כ אחד). לעשות חתך רדוד לאורך קו האמצע.
- מוציא בזהירות את הקליפה עם scaler מגל, החל מקו האמצע כדי לחשוף את ההיפוקמפוס הגבי. להסיר את השכבה של קליפה מעל היפוקמפוס. להשתמש באצבעות או מלקחיים זווית לתמוך במוח. לעשות חתך קטן להשליך בהיפוקמפוס. הוצא בעדינות את ההיפוקמפוס עם scaler המגל החל מההיפוקמפוס הגב באמצעות תנועות מתגלגלות.
זהירות! להיות עדין כדי למנוע מתיחה וקריעת היפוקמפוס. - הסר את כל קליפת המוח ורקמות חיבור סביב היפוקמפוס המבודד עם scaler המגל.
- חותך את הרקמה בהיפוקמפוס והעברת פרוסות על תא הממשק
- מניחים פיסת ACSF-נייר ספוג מסנן (כיתה 1, 30 מ"מ) בשלב החיתוך של מבצעה הידני. סקופ ולמקם את הרקמה בהיפוקמפוס על נייר הסינון. הזז את נייר הסינון כדי ליישר את ההיפוקמפוס בכיוון נכון ביחס ללהב של מבצעה, כך שההיפוקמפוס הוא פרוס בזווית של כ -70 o לfimbria.
- למחוק את הפתרון העודף סביב הרקמה בהיפוקמפוס עם נייר סינון מקופל (1 כיתה, 85 מ"מ) עוזב את ההיפוקמפוס מעט רטובה. להתחיל לחתוך בהיפוקמפוס רוחבי. פרוסה וזורקי רקמה מהקצה הקיצוני של ההיפוקמפוס בי מורפולוגיה פרוסה לא ברורה.
- פורסים את הרקמה שנותרה לפרוסות 400 מיקרומטר-עבות. להרים פרוסות בהיפוקמפוס בעדינות מהלהב עם מברשת עם זיפים רכים באמצעות תנועות swiping עדינות ומניחים את הפרוסות לתוך כוס קטנה מלאות ACSF carbogenated הקר. בצע את שלבי 3.3.1-3.3.3 במהירות אפשרית מאז הרקמה בהיפוקמפוס חשופה לאוויר.
הערה: באופן כללי שני שלישים של ההיפוקמפוס הוא פרוסים, וניתן להכין 4-6 פרוסות עם מורפולוגיה ברורה. - העבר את הפרוסות בעדינות על גבי הרשת בתא פרוסה בעזרת פיפטה נקייה פסטר מפלסטיק עם קצה רחב (שנעשתה על ידי חיתוך במרחק 2-3 סנטימטר של הקצה). להתאים בזהירות את העמדה של פרוסות ברשת באמצעות מזרק קטן עם קצה מכופף. מקם את הפרוסות באופן שמאפשר מיקום האלקטרודה והקלטה. בדוק כדי לוודא שהפרוסות מוקפות מספיק על ידי ACSF אך אינם שקועות או צף (איור 2C-D). מכסה את תא דגירה את הפרוסות במשך 2-3 שעות.
הערה: שכבת התאים פירמידליים בפרוסות הבריאים צריכה להראות קצת שקיפות.
4. הקלטה של תגובות CA3-CA1 Synaptic
הערה: הגדרת אלקטרופיזיולוגיה משמשת להקלטת פוטנציאל שדה מוצגת באיור 2 א. פארהכלוב היום מומלץ מאוד אם ההפרעה החשמלית היא מעבר לשליטה לאחר ההארקה הנכונה של הגדרות חשמל. סוגים רבים ושונים של תאים שקועים וממשק זמינים מסחרי. עם זאת, תאי ממשק מועדפים כתגובות הסינפטי חזקות יותר תערוכת פרוסות בהם.
- מיקום של אלקטרודות
- הפעילו את מכשירים החשמליים לשימוש (לגירוי ומגברים). הר ולאבטח את האלקטרודות המגרה והקלטה בבעלי פרספקס של micromanipulators.
הערה: אנו משתמשים בmonopolar,, אלקטרודות מצופים לכה נירוסטה של התנגדות 5 MΩ למטרות המגרה והקלטה. - לפני השימוש, להכניס אלקטרודות אלה בתוך נימי זכוכית משך ובטוחים עם דבק אפוקסי חושף רק חלק קטן מקצה האלקטרודה (איור 2E). זה נותן כוח לאלקטרודות אחרת דקות ועוזר לאבטח אותם בחוזקה בeleבעלי ctrode.
- מודרך מתחת למיקרוסקופ, מקם את האלקטרודה מגרה (ים) בradiatum השכבה של אזור CA1 כדי לעורר את הסיבים בטחונות שפר ואת האלקטרודה ההקלטה באזור הדנדריטים הפסגה של CA1 להקליט תגובות (fEPSP) שדה-EPSP.
הערה: מתקרבת פני הנוזל מעל הפרוסה עם אלקטרודות נותנת קול המסייע לאתר במהירות את פני השטח של הפרוסה (בתנאי, המגבר מחובר לרמקול). - בניסויי תיוג ולכידה הסינפטי, על פי הצורך של הניסוי, אלקטרודות עמדה שתיים או שלושה גירוי (S1, S2 או S3) משני צדי האלקטרודה ההקלטה כדי לעורר שתיים או יותר עצמאיים אך חופף תשומות. מקם את האלקטרודות המגרה והקלטה על 200 מיקרומטר מלבד.
- במידת צורך, איתור האלקטרודה הקלטה אחרת בשכבת pyramidale השכבה להקלטת ספייק אוכלוסייה (איור 3 א) .When שניאלקטרודות נגעו פרוסה, באמצעות תוכנת הרכישה, לתת גירוי מבחן כדי להבטיח אות fEPSP נכונה.
הערה: אנו משתמשים בפולסים biphasic, זרם קבוע (משך דחף 0.1 msec / חצי גל) לגירוי מבחן. - ברגע שאות fEPSP נכונה מתקבלת, להוריד בזהירות את האלקטרודות על 200 מיקרומטר עמוק באמצעות כפתורי תנועת קנס של מניפולטורים. לאפשר 20 דקות לפרוסות להתאושש. בדוק את עצמאות המסלול עם פרוטוקול סיוע לזווג דופק 27,28.
- הפעילו את מכשירים החשמליים לשימוש (לגירוי ומגברים). הר ולאבטח את האלקטרודות המגרה והקלטה בבעלי פרספקס של micromanipulators.
- ביחס תשומה-תפוקה
- לקבוע את יחס קלט-פלט (גירוי מביא לעומת מדרון fEPSP) עבור כל קלט על ידי מדידת ערך המדרון בטווח של עוצמות הנוכחיות. לבצע את זה בין 20 מיקרו-אמפר עד 100 מיקרו-אמפר. לאחר מכן קבע את עוצמת גירוי לכל קלט להשיג 40% ממדרון fEPSP המרבי. שמור מתמיד לאורך כל הניסוי.
- לאחר 15-20 דקות, להתחיל בהקלטה הבסיסית. צג Fמדרון EPSP הדוק בתקופה זו ולאפס את עוצמת הגירוי אם המדרון משתנה יותר מ -10% מהשווי שנקבע ולהתחיל בנקודת ההתחלה חדשה. שיא דקות לפחות 30 או בסיס יציב שעה 1 לפני שימשיכו.
הערה: למבחן או הגירוי בנקודת ההתחלה, אנחנו משתמשים בארבעה מטאטא של פולסים 0.2 הרץ biphasic, קבועים הנוכחיים (0.1 msec לקוטביות) ניתנו כל 5 דקות. שיפוע ממוצע של ארבע תגובות אלה נחשב אז כחוזר אחד. האותות מסוננים ומוגברים על ידי מגבר ההפרש, דיגיטציה באמצעות ממיר אנלוגי לדיגיטלי ומעקב באינטרנט עם תוכנה מותאמת אישית.
- אינדוקציה של LTP / בע"מ באמצעות פרוטוקולי גירוי
הערה: שני LTP ו LTD סווג כמוקדם ומאוחר-LTP / בע"מ המבוסס על הדרישות של סינתזת חלבון; התרגום האחרון מחייב ו / או שעתוק לתחזוקה מאוחר [לסקירה ראה 4]. מגוון של פרדיגמות גירוי חשמליות יכול specifically לגרום צורות השונות של LTP ו LTD.- WTET: 100 הרץ, 21 פעימות זרם קבועות biphasic (0.2 msec לשלב).
- לא לתקן: שלוש התפרצויות של לשנייה אחת (100 הרץ) כל 10 דקות (Pulse 0.2 msec הרוחב לפאזה) 100 פעימות.
- 900 התפרצויות במשך זמן 15 דקות. פרץ 1 כולל 3 פעימות (0.2 רוחב אלפיות שני) עם מרווח של 50 אלפיות שניים interpulse (20 הרץ). המרווח בין הפרץ הוא 1 שניות (מספר כולל של 2,700 פעימות).
5. ניקוי של Slice קאמרי ומערכת זלוף
- לאחר ההקלטה נגמרה, לאסוף את פרוסות בהיפוקמפוס לאנליזה ביוכימית נוספת או אחר להשליך כראוי. כבה את אספקת carbogen ובקר טמפרטורה. שטוף את bubbler carbogen במים מזוקקים.
- לנקות את הרשת באופן יסודי עם מברשת ומים מזוקקים. שטוף את האסדה במשך 15-20 דקות במים מזוקקים בקצב זרימה גבוה יותר. פעם ב3-4 ימים, להחליף את המים מזוקקים בתא תחתון של התא וגם נקי הקאמרית באופן קבוע עם 3% מי חמצן פתרון כדי למנוע פטריית צמיחה.
תוצאות
המתודולוגיה שתוארה כבר בשימוש ללמוד צורות ארוכות טווח של LTP / בע"מ והאינטראקציות האסוציאטיביים שלה כגון תיוג הסינפטי ולכידה צולבת מפרוסות בהיפוקמפוס חריפות של חולדות מבוגרות. 23 טכניקה זו הוכחה כיעילה בניסויים עם שני החולדות (Wistar) ועוד מגוון של עכבר זני 30,31. המתודולוגיה ששמשה בהצלחה להקלטות LTP יציבה של עד 8-12 שעות. 32
'התג' שנקבע על ידי tetanization החלש של קלט אחד (S1) לוכד את 'PRPs' הנגרמת על ידי tetanization החזק של עוד קלט עצמאי אך חופף, ובכך הופכת את הצורה (S2 איור 3, עיגולים מלאים) אחרת מתפוררת של LTP (מוקדמת -LTP) בS1 לתוך אחד לטווח ארוך (איור 3, חוגים פתוחים) (לשם השוואה של תחילת-LTP הנגרמת על ידי WTET לראות 20,33). PRPs נתפס על ידי חלשתג סט tetanization לא צריך לבוא דווקא מהסוף-LTP מושרה לא לתקן אבל גם יכול להיות מסופק על ידי מאוחר בע"מ המושרה SLFS. סוג זה של אינטראקציה חיובית בין אסוציאטיבית LTP ו LTD נקרא 'תיוג צולב / לכידה'. מוקדם LTP המושרה WTET בS1 מקבל חיזוק לסוף-LTP (איור 3 ג, חוגים פתוחים) על ידי לכידת PRPs מסופק על ידי מאוחר בע"מ המושרה SLFS בS2 (איור 3 ג, עיגולים מלאים). סטטיסטית הגברה או דיכאון משמעותי נשמרה בS1 ו- S2 בשני המקרים, בהשוואה לתחילת מחקר משלו (מבחן Wilcoxon; P <0.05).
ללהתרחש האינטראקציה התג-PRP, כדי הזמני של שני אירועים (חלש-חזק-לפני / חזק-חלש-לפני) הוא לא קריטי כל עוד חלון הזמן שבין שני האירועים נשאר בטווח של 30-60 דקות. זה יהיה חכם כדי לכלול הסינפטי שלישי, עצמאי אך חופף בלשים ולהשתמש בו כבסיס לשליטה לפקח על היציבות של הקלטות. פרוטוקולי הגירוי החשמליים המשמשים כדי לעודד צורות מוקדמות, ומאוחר של LTP / בע"מ חייבים להיות מאומתים באחת-קלט ניסויים לעקביות ואמינות לפני השימוש בהם בניסויי STC. כמו כן, אנו רוצים להדגיש את החשיבות של המתודולוגיה הכנת פרוסה המתוארת בפרוטוקול מאז ההצלחה של ניסויים אלה מסתמכת במידה רבה על איכות הפרוסות.
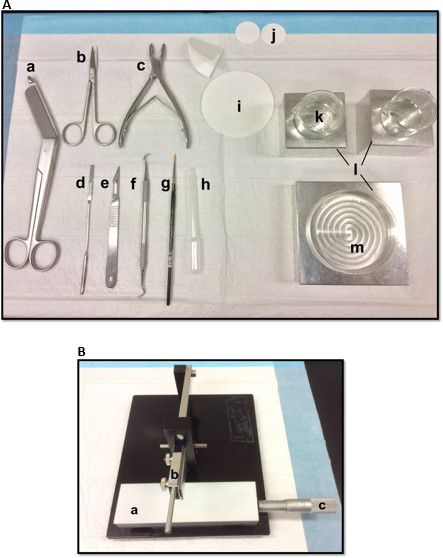
איור 1. כלים () המשמשים לנתיחה של ההיפוקמפוס: (א) מספריים תחבושת (ב) איריס מספריים (ג) rongeur עצם (ד) מרית דקה, מספר אזמל 11 (ו) scaler מגל (ז) (ה) רכה מברשת צבע -bristle פיפטה פלסטיק פסטר נייר (i) מסנן (85mm) (י) נייר סינון (30mm) (יא) כוסות זכוכית (L) בלוקים קירור אלומיניום כדי שיתאימו למנה וכוסות פטרי (ח)צלחת (מ ') פטרי. מסוק רקמה ידני (B). (א) פלטפורמה (ב) חיתוך זרוע עם להב בעל (ג) Vernier מיקרומטר, רזולוציה 10 מיקרון. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. אלקטרופיזיולוגיה הגדרה לקלטות שדה-פוטנציאלי בהיקף של גירוי (א) (ב) מגבר ההפרש (ג) אנלוגית לדיגיטלי ממיר (ד) אוסצילוסקופ (ה) מחשב עם תוכנת רכישה (ו) Vibration- טבלה עליונה עמיד מיקרוסקופ (ז) עם 4x הגדלה (ח) תא המוח פרוסה ממשק מקור תאורה (L) מערכת טפטוף לאספקת ACSF וcarbogen (י) בקר טמפרטורה (k) (i) מניפולטורים> עם מחזיקי אלקטרודה. (ב) במוח-פרוסת ממשקקאמרי. (ג) & (ד) פרוסות בהיפוקמפוס בתא הממשק. אלקטרודה פלדה (E) נירוסטה אטומה בנימי זכוכית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
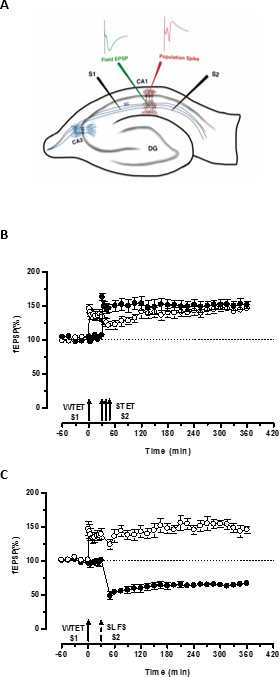
איור 3. ייצוג סכמטי של מיקום פרוסה ואלקטרודה בהיפוקמפוס רוחבי להקלטת שדה-פוטנציאלי (): בייצוג זה, שתי אלקטרודות גירוי (S1 ו- S2) ממוקמות בradiatum השכבה של אזור CA1 כדי לעורר שתי עצמאי אך חופף תשומות הסינפטי על נוירונים הפירמידה CA1. שתי אלקטרודות הקלטה תאית, אחד להקליט שדה-EPSP (פוטנציאל הפוסט-סינפטי מעורר) מהתא הדנדריטי הפסגה ועוד להקליט ספייק אוכלוסייה גופני מתא הפירמידהגופים, נמצאים בradiatum השכבה והשכבה pyramidale בהתאמה. CA1- קורנו ammonis אזור 1, CA3- קורנו ammonis אזור 3, gyrus המשונן DG-, סיבי טחונות SC- שפר, S1- אלקטרודה מגרה 1, אלקטרודה S2-גירוי 2. (ב) חלש לפני הפרדיגמה חזקה ללמוד STC: tetanization החלש (WTET) מוחל S1 (עיגולים פתוחים) לגרימה המוקדם LTP אחרי tetanization החזק (לא לתקן) של S2 (עיגולים מלאים) ב- 30 דקות כדי לגרום לאיחור-LTP. מוקדם LTP בS1 מקבל חיזוק לסוף-LTP מראה תיוג וללכוד אינטראקציה (n = 6) (ג) חלש לפני הפרדיגמה חזקה ללמוד תיוג צולב:. מוקדם LTP הוא מושרה על ידי WTET בS1 (עיגולים פתוחים) ואחרי על ידי האינדוקציה של סוף-בע"מ בS2 (עיגולים מלאים) באמצעות SLFS לאחר 30 דקות. בS1, המוקדם LTP הופך לסוף-LTP שנמשך 6 שעות מראים תיוג צולב ולכידה (n = 6). חץ אחד מייצג tetanization החלש הגיש בקשה לזירוז מוקדם LTP. שלישייה של חיצים מייצגתtetanization החזק גרימת מאוחר LTP. החץ השבור מייצג את נקודת הזמן שבי SLFS היה מוחלת על הקלט הסינפטי הנציג לגרום מאוחר בע"מ. ברים שגיאה מצביעים SEM. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
פרוסת היפוקמפוס חריפה היא מערכת מודל מצוינת ללימוד LTP ותהליכי פלסטיות תפקודיים אחרים כגון STC ולכידה צולבת. היא שומרת הרבה של הרשת המבנית מינרית של המעגלים בהיפוקמפוס, מאפשר מקומות אלקטרודה מדויקים ומציע לצד, פלטפורמה פתוחה למניפולציה neuropharmacological מהירה ללא מחסום דם-מוח.
מאמר זה מתאר את המתודולוגיה להכנת פרוסות בהיפוקמפוס חריפה קיימא מחולדות מבוגרות צעירות ומשתמש בהם כדי לחקור STC ותיוג צולב. המחקרים קודמים הדגישו כי מין וגיל של בעלי החיים הם גורמים חשובים להביא בחשבון לשימוש במחקרי אלקטרופיזיולוגיה. 27,28 בעלי חיים מבוגרים לכן צעירים עם פונקציות ביטוי מלא למבוגרים קולט (חולדות Wistar גברים בגילים 5-7 שבועות) משמשים. 23 סימטריות בקשרים בין ההיפוקמפוס השמאל וימין כבר ציין במכרסמים 29 והבדלים עיקריים בביטוי הקולטן NMDA דווחו גם כן 34. אנחנו השתמשנו בהיפוקמפוס הנכון כדי להיות בקנה אחד עם המחקרים הקודמים שלנו LTP. 23,32 עם זאת, אף אחד מhippocampi יכול לשמש עוד עקביות נשמר.
כמו בכל פרוטוקול, זה מאוד חשוב לבצע את הבידוד וטיפול חיתוך נהלים במהירות אבל לוקח שהרקמה לא נמתחה, פגום, שניתנו יבש או חוסר חמצן. השינויים ב- pH, טמפרטורה והרכב יוני של הפתרונות יכולים להיות השפעה עמוקה על יכולת הקיום של הפרוסות ואת התוצאות. לפיכך יש להימנע וריאציות כאלה. זה נצפה כי שחרור סידן גלוטמט קולט-תלוי המתרחש במהלך שלבי הכנה בלתי הפיך יכול להשפיע על סינתזת חלבון ברקמת עצבים 35,36, 37. שימוש slicers רקמות ידני יכול לעזור להקטין את זה כך שהוא מאפשר את התהליך להסתיים מהר מאוד בהשוואה לvibraslicers. עם זאת, מעבדות רבות גם להשתמש ביעילות vibraslicers עם אמצעי זהירות דרוש לשמירה על כדאיות פרוסה. גורם חשוב נוסף שיש לשקול הוא תקופת הדגירה הארוכה לפני תחילת הניסויים. זה כבר ציין להיות באמת חיוני להשגת יציבות ברמות מדינה והפעלת קינאז חילוף חומרים בפרוסות לאחר ההפרעה שנגרמה במהלך ההכנה 23. יציבות זו דרושה לעקביות בהקלטות לטווח ארוך. אנו מדגישים שוב, בתצפית זו ומציעים שעות דגירה הארוכות של שעות על 3.
מגוון רחב של פרמטרים גירוי ידוע לגרום LTP, אבל המנגנונים המולקולריים שהושרו בכל מקרה לא יכולים להיות אותו הדבר (לסקירה ראה 38). זה יכול להשפיע על העמידות ומאפיינים אחרים של LTP ש, בתורו, יכול להשפיע על התוצאות של ניסויי תיוג ולכידה הסינפטי. לכן חשוב כדי לאמת את פרדיגמות הגירוי ומאפייניםשל LTP שהושרו בתנאים של המעבדה ביצוע ולשמור על עקביות.
בדרך כלל אנחנו לא מחשיבים ניסויים עם מטחי סיבי presynaptic גדולים מאוד ועם fEPSPs המקסימאלי פחות מ -0.5 mV והניסויים הכוללים שינויים משמעותיים במטח הסיבים במהלך ההקלטות גם דחו. יתר על כן, בעת ביצוע ניסויים דו-מסלול או שלושה-מסלול, זה חשוב כדי להבטיח את עצמאות המסלול. זה יכול להתבצע עם פרוטוקול סיוע לזווג דופק 28.
חסרון אחד של מערכות הקלטת הממשק הוא ההיווצרות של טיפות התעבות על אלקטרודות בשעות ההקלטה הארוכות בשל הבדלי הטמפרטורה ולחות בין התא והסביבה. טיפות אלה צריכים להיות בזהירות מחקו מעת לעת. אחרת הטיפות יכולות לטפטף על הפרוסות ולגרום הפרעה או אפילו הפסד של אותות. אנחנו בדרך כלל להתמודד עם זה בy סופג מיומנות הטיפות מודרכות תחת מיקרוסקופ באמצעות פתיל נייר סינון דק, בלי לגעת באלקטרודות. עם זאת, הפתרון הטוב ביותר יהיה להשתמש במערכת הסקה מרכזית, כגון מערכת ETC שפותחה על ידי חוקרים מאוניברסיטת אדינבורו.
בנימה סיכום, מגוון של שיטות קיימים במעבדות ברחבי העולם, המשמשות להכנת פרוסות בהיפוקמפוס למטרות ניסויים שונות. כל אחד מההליך מציע כמה יתרונות על פני אחרים. אחד צריך לייעל זהירות פרטי הפרטים של הפרוטוקול כדי להתאים למטרת הניסוי. אנו מקווים שמאמר זה מסייע בשיפור היבטים מסוימים של המתודולוגיה ללימוד תהליכים מאוחרים אסוציאטיביים כגון STC ולכידה צולבת.
Disclosures
הגישה פתוחה למאמר זה וידאו בחסות Cerebos פסיפיק מוגבל.
Acknowledgements
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materials
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
References
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved