Method Article
Исследование Synaptic Tagging / Захват и кросс-захвата с помощью острой срезах гиппокампа от грызунов
В этой статье
Резюме
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Аннотация
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Введение
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
протокол
Все процедуры на животных были одобрены уходу и использованию комитета Институциональные животных (IACUC) Национального университета Сингапура.
1. Подготовка Искусственный спинномозговой жидкости (ACSF)
- Подготовка ACSF, состоящий из (в мм) 124 NaCl, 3,7 KCl, 1,0 MgSO 4 · 7H 2 O, 2,5 CaCl 2 · 2H 2 O, 1,2 КН 2 РО 4, 24,6 NaHCO 3 и 10 D-глюкозы. Обеспечить рН ACSF между 7,2-7,4, когда пропускают до насыщения 95% O 2 и 5% СО 2 смеси (карбогена). 21 Используется ACSF как для вскрытия, подготовки и среза для перфузии в течение Электрофизиологические записи.
ПРИМЕЧАНИЕ: Используйте чистую аппарат для измерения и проведения ACSF. Использование нечистого аппарат может привести к мутных растворов или образование осадка. Используйте деионизированную воду для всех препаратов. - Подготовьте 2 L 10x ACSF акции исключая NaHCO 3 и Д-глюкоза в мерной колбе. Добавить реагенты к деионизированной воде в следующем порядке: NaCl (144.96g), KCl (5.52g), MgSO 4 · 7H 2 0 (4.92g), CaCl 2 · 2H 2 0 (7,56 г), KH 2 PO 4 (3,28 г) и долить до объема 2 L. непрерывно перемешивают в течение по крайней мере 30 мин с использованием магнитной мешалки, чтобы обеспечить все реагенты растворены. Храните запас в 4 о С и использовать в течение 2 недель.
- До вскрытия и экспериментов, разбавить ACSF запас в мерной колбе вместе с добавлением требуемых количеств NaHCO 3 и D-глюкозы. За 1 л раствора, развести в 100 мл акции до 1 л, после добавления 2,07 г NaHCO 3 и 1,802 г D-глюкозы. ACSF должно быть четкое решение без каких-либо осадка или нерастворимых частиц.
- Прохладный 200-300 мл ACSF на льду, которые будут использоваться во время вскрытия. Убедитесь, что используется ACSF для вскрытия между 2-4 ° С. Используйте оставшиеся ACSF для electrophysiological эксперименты. Bubble все ACSF решения до насыщения карбогена (5% СО 2, 95% О 2) непрерывно. В то время как ожидая ACSF остыть, подготовить область рассечение и ломтик камеру.
2. Подготовка интерфейса палаты
ПРИМЕЧАНИЕ: Интерфейс мозг кусочек камера, используется для инкубации срезов и поддержание их в электрофизиологических записей (рис 2б), состоит из двух отсеков. Нижняя камера содержит дистиллированную воду поддерживали при 32 ° С при помощи регулятора температуры и непрерывно продувают карбогена.
- Включение регулятора температуры и заранее его при 32 ° С. Вымойте верхнюю камеру для 10 до 15 мин, запустив дистиллированную воду через трубки приток. Убедитесь, что верхняя палата чистый перед размещением в сети. Убедитесь, что уровень воды в нижней камере составляет около 70% заполнен дистиллированной водой.
- Поместитесеть в верхней палате, чтобы обеспечить покой поверхность для срезов (рис 2С). Регулировка трубки оттока, чтобы гарантировать, что уровень раствора в достаточной степени смачивания всей площади сетки. Поместите крышку над сеткой, чтобы поддерживать увлажненного карбогена атмосферу в горнице.
- Регулировка расхода 1 мл / мин. Поддержание этой скорости потока в течение всего периода инкубации и кусочек эксперимента. Начните carbogenating свежеприготовленную 1x ACSF и погрузите трубку притока в ACSF. Разрешить 20 мин для ACSF быть насыщен карбогена и верхней камеры должны быть заполнены с ней.
3. Подготовка острых срезов гиппокампа
Примечание: Протокол вскрытия состоит из (1) Удаление мозга от животного в холодном ACSF и (2) Выделение и нарезки гиппокампа. Для того, чтобы нейроны остаются жизнеспособными, изолировать и поместить в холодную мозг ACSF быстро и завершить весьПроцесс в том числе нарезки в течение 3-5 мин.
- Удаление мозга в холодную ACSF
- Выложите рассечение инструментов в порядке, показанном на рисунке 1А. Упорядочить инструменты по порядку использования, чтобы облегчить процесс вскрытия. Перед началом убедитесь, что все рассечение инструментов готовы.
- Установите лезвие, очищенный этилацетатом, абсолютного этанола и дистиллированной воды, на ручной ткани измельчитель (рис 1B), закрепите ее прочно и убедитесь, что передний край выровнена. Тест измельчения кусок фильтровальной бумаги для того, чтобы лезвие надежно закреплены. Установите скользящий Vernier микрометра в исходное положение.
- Эвтаназии животных с использованием диоксида углерода (CO 2) в индукции камеры и обезглавить с ножницами повязку или гильотина. Использование ножницы Iris, удалить кожу и мех над черепом. Сделайте разрез через задний для удаления brainstem.Make небольшой надрез вдоль гоE Щелкните правой стороне черепа и больше разрез слева.
ВНИМАНИЕ! Сделать только небольшой разрез в сторону, которая используется для экспериментов, чтобы не повредить его. При установке ножницы, убедитесь, что сила, приложенная это вверх, чтобы избежать повреждения мозга. - Осторожно снимите череп с костью костными кусачками, начиная с левой на правую сторону черепа, чтобы выявить кору. Тонкий слой твердой мозговой оболочки можно также рассматривать. Осторожно снимите лобовыми с костными кусачками. Удалить большую часть твердой мозговой оболочки вместе с лобовыми.
ВНИМАНИЕ! Будьте осторожны, чтобы твердая не резать через ткани мозга. - Извлеките оставшуюся твердую мозговую оболочку, если таковые имеются, в частности, в соединении между корой и мозжечком с плоским концом шпателя. Для этапах 3.1.5 и 3.1.6, поддержания давления вверх т.е. от мозга, чтобы избежать его повреждения. Использование шпателя, аккуратно выкопать мозг в Петри с холодной и carbogenated ACSF (2-4 ° С), плаКНИ на алюминиевый блок охлаждения.
- Выделение гиппокампа
- Использование скальпеля, сделать прямой срез, чтобы удалить мозжечок и другой разрез, чтобы удалить переднюю часть мозга (примерно четверть). Сделайте неглубокий разрез вдоль средней линии.
- Осторожно снимите кору с серпом масштабирования, начиная от средней линии, чтобы показать спинной гиппокамп. Удалить слой коры выше гиппокампа. Используйте пальцы или угловой пинцет, чтобы поддержать мозг. Сделайте небольшой надрез в гиппокампе спайки. Аккуратно снимите гиппокамп с серповидно-масштабирования, начиная с дорсального гиппокампа с использованием подвижного движения.
ВНИМАНИЕ! Будьте нежны, чтобы избежать растяжения и разрыв гиппокамп. - Удалите мозга и соединительной ткани вокруг изолированной гиппокампа с серповидно-масштабирования.
- Нарезка ткани гиппокампа и передачи ломтики на интерфейс камеры
- Поместите кусок ACSF-пропитанной фильтровальной бумаги (1 класс, 30 мм) на стадии нарезки ручного резки. Совок и поместите ткани гиппокампа на фильтровальной бумаге. Перемещение фильтровальную бумагу, чтобы выровнять гиппокамп в правильной ориентации по отношению к лезвию резки так, что гиппокамп нарезанный под углом около 70 ° к бахромка.
- Промокните избыток раствора вокруг ткани гиппокампа с сложенном фильтровальной бумаги (сорт 1, 85 мм), оставляя гиппокамп слегка влажной. Начните нарезки гиппокамп в поперечном направлении. Кусочек ткани и отбросить от крайней гиппокампа, где морфология ломтик не ясно.
- Нарежьте оставшийся ткани в 400 мкм толщиной ломтиками. Возьмите срезах гиппокампа мягко от лезвия с помощью кисти с мягкой щетиной, используя нежные движения, проводя и поместите ломтики в небольшой стакан, наполненный холодной carbogenated ACSF. Выполнить шаги 3.3.1-3.3.3 как можно быстрее, так как гиппокампа ткань подвергается воздействию воздуха.
ПРИМЕЧАНИЕ: Обычно две трети гиппокампе ломтиками, ломтики и 4-6 с четкой морфологии могут быть получены. - Перенесите ломтики аккуратно на сетку в ломтик камеры, используя чистую пластиковые пипетки Пастера с широким наконечником (сделанное срезая 2-3 см наконечника). Тщательно регулировать положение срезов в сети с использованием небольшого шприца с загнутым кончиком. Расположите кусочки таким образом, что облегчает расположение электродов и запись. Убедитесь, что ломтики достаточно окружен ACSF но не погружен или плавающей (фиг.2с-D). Накройте камеру и инкубировать ломтиками 2-3 ч.
ПРИМЕЧАНИЕ: пирамидальная слой клеток у здоровых ломтиками должны проявить прозрачность.
4. Запись CA3-СА1 Synaptic Ответы
ПРИМЕЧАНИЕ: электрофизиологии настройки для потенциала поля записи показан на рисунке 2А. Фарадень клетка настоятельно рекомендуется, если электрические помехи находится вне контроля после надлежащего заземления электрических установок. Много различных типов погружных и интерфейсных камер являются коммерчески доступными. Тем не менее, интерфейс камеры являются предпочтительными в качестве экспоната ломтики более надежных ответов в синаптических них.
- Позиционирование электродов
- Включите электрооборудования (стимуляторы и усилители), которые будут использоваться. Горы и обеспечить стимулирующие электроды и записи в оргстекла владельцев микроманипуляторами.
ПРИМЕЧАНИЕ: Мы используем монополярной, лак покрытием, электродов из нержавеющей стали сопротивления 5 МОм для обеих стимулирующих и записи целей. - Перед использованием, вставьте эти электроды внутри выдернутыми стеклянных капилляров и закрепите эпоксидным клеем подвергая только небольшую часть наконечника электрода (рис 2E). Это дает силы, чтобы в противном случае тонких электродов и помогает обеспечить их твердо в элеДержатели ctrode.
- Руководствуясь под микроскопом, расположите стимулирующий электрод (ы) в роговом radiatum области СА1, чтобы стимулировать залога волокна Шеффера и записи электрод в апикальной дендритной области СА1 записать полевых ВПСП (fEPSP) ответов.
Примечание: Приближение к поверхности жидкости выше среза с электродами дает звук, который помогает определить местонахождение быстро поверхность среза (при условии, усилитель подключен к громкоговорителю). - В синаптических пометки и захвата экспериментов, в соответствии с необходимостью эксперимента, положение двух или трех стимулирующих электродов (S1, S2 или S3) по обе стороны от регистрирующего электрода, чтобы стимулировать два или более независимых, но перекрывающихся входов. Расположите стимулирующие электроды и записи о 200 мкм друг от друга.
- При необходимости, найдите другую запись электрод в пласт pyramidale слоя для записи шип населения (рис 3а) .При какэлектроды коснулся кусочек, используя программное обеспечение сбора, дать тест стимуляции для обеспечения надлежащего сигнала fEPSP.
ПРИМЕЧАНИЕ: Мы используем импульсы двухфазные, постоянного тока (длительность импульса 0,1 мс / полуволновых) для стимуляции тест. - После того, как соответствующий сигнал fEPSP получается, осторожно опустите электроды около 200 мкм с использованием глубокого мелкие ручки движение манипуляторов. Разрешить 20 мин для ломтики, чтобы восстановиться. Проверьте пути независимости с протоколом по упрощению парных импульсов 27,28.
- Включите электрооборудования (стимуляторы и усилители), которые будут использоваться. Горы и обеспечить стимулирующие электроды и записи в оргстекла владельцев микроманипуляторами.
- Ввод-вывод отношение
- Определить ввода-вывода соотношение (афферентных стимуляции против fEPSP склоне) для каждого входа с помощью измерения значение наклона в диапазоне текущих интенсивностей. Выполните это между 20 мкА до 100 мкА. Затем установить интенсивность стимуляции для каждого входа, чтобы получить 40% от максимального наклона fEPSP. Держите эту константу в течение всего эксперимента.
- После 15-20 мин, начать запись базовый уровень. Монитор пВПСП наклон тесно в течение этого периода, и сбросить интенсивность стимула, если наклон колеблется более чем на 10% от установленного значения и начать новый базовый уровень. Запись по крайней мере, 30 мин или 1 ч стабильный базовый уровень, прежде чем продолжить.
ПРИМЕЧАНИЕ: Для теста или базового стимуляции, мы используем четыре зачисток, импульсов 0,2 Гц двухфазных постоянного тока (0,1 мс в полярности), данные каждые 5 мин. Средняя крутизна этих четырех ответов затем рассматривается как один повторяют. Сигналы фильтруется и усиливается дифференциальным усилителем, оцифрованы с помощью аналого-цифрового и мониторинг в Интернете с программного обеспечения на заказ.
- Индукция LTP / LTD, используя протоколы стимуляции
Примечание: Оба LTP и LTD были классифицированы как ранние и поздние БПЛ / LTD на основе требований синтеза белка; последний требует перевода и / или транскрипция для позднего обслуживания [для обзора см 4]. Разнообразие электрических парадигм стимуляции может specificallу побудить различные формы LTP и LTD.- WTET: 100 Гц, 21 импульсов двухфазные постоянный ток (0,2 мс на фазу).
- СТЕТ: Три вспышки 100 импульсов в течение одной секунды (100 Гц) каждые 10 мин (широтно-импульсной 0,2 мс на фазу).
- 900 всплески длительностью более 15 мин. 1 вспышка состоит из 3 импульсов (0,2 мс ширина) с различным интервалом 50 мс (20 Гц). Интер интервал всплеск 1 сек (общее количество импульсов 2700).
5. Очистка Slice палаты и перфузии системы
- После записи закончена, собирать срезах гиппокампа для дальнейшего биохимического анализа, либо отказаться соответствующим образом. Отключите подачу карбогена и регулятор температуры. Вымойте карбогена барботер в дистиллированной воде.
- Очистите сетку тщательно с щеткой и дистиллированной воды. Промыть буровой течение 15-20 мин в дистиллированной воде при более высокой скорости потока. После того, как в 3-4 дней, изменить дистиллированной воды вНижнее отделение камеры, а также очистить камеру регулярно с 3% -ным раствором перекиси водорода, чтобы избежать роста грибов.
Результаты
Описанная методология была использована для изучения долгосрочных формы LTP / LTD и его ассоциативных взаимодействий, такие как синаптического мечения и поперечного захвата с острыми срезах гиппокампа взрослых крыс. 23 Эта методика оказалась эффективной для экспериментов с обеих крыс (Wistar) и разнообразие штаммов мыши 30,31. Данная методика успешно используется для стабильных LTP записей до 8-12 ч. 32
СО «тег» устанавливается слабой тетанизацией один вход (S1) захватывает, вызванное сильным тетанизацией другой независимый, но перекрытия входа 'ППУ "(S2; 3В, заполненные круги), таким образом, превращая в противном случае затухающий форму LTP (раннее -LTP) в S1 в длительной одного (рис 3B, кружки) (Для сравнения в начале БПЛ, вызванного WTET см 20,33). В ППУ захваченные слабыйтетанизация набор тегов не обязательно исходить от STET-индуцированной конце БПЛ, но также может быть предусмотрено SLFS-индуцированной поздней LTD. Этот тип положительного ассоциативного взаимодействия LTP и LTD упоминается как "кросс-мечению / захвата". WTET-индуцированной рано БПЛ в S1 получает усиленный до конца БПЛ (3С, кружки), захватив Prps предусмотренные SLFS-индуцированной конце-ЛТД в S2 (рис 3C, заполненные кружки). Статистически значимое потенцирование или депрессия сохраняется в S1 и S2 в обоих случаях, когда по сравнению с его собственным базовым (критерия Вилкоксона, р <0,05).
Для тегов ПРП взаимодействие происходит, временной порядок двух событий (слабых, прежде чем-сильный / сильной, прежде чем-слабый) не является решающим, пока окно времени между двумя событиями, остается в пределах 30-60 минут. Было бы целесообразно, чтобы включать в себя третий, независимый, но перекрытие Synaptic вставить и использовать его в качестве контроля исходных контролировать стабильность записи. Электрические протоколы стимуляции, используемые, чтобы вызвать ранние и поздние формы LTP / ООО, должны быть проверены в одной входных экспериментов для согласованности и надежности перед их использованием в STC экспериментов. Мы также хотели бы подчеркнуть важность методологии подготовки ломтик, описанной в протоколе, так как успех этих экспериментов в значительной степени зависит от качества срезов.
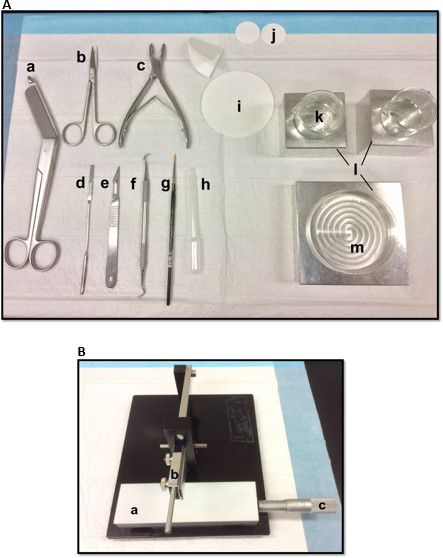
Рисунок 1. (A) Инструменты, используемые в рассечение гиппокампа: (а) бинты ножницы (б) Ирис ножницы (с) Кость костные кусачки (г) Тонкий шпатель, (е) Скальпель номер 11 (е) Серп масштабирования (г) Мягкий -bristle кисти (ч) Пластиковые пипетки Пастера (я) фильтровальная бумага (85мм) (J) фильтровальная бумага (30 мм) (к) Стеклянные стаканы (л) блоки Алюминиевые охлаждения, чтобы соответствовать Петри и стаканы(м) Петри. (Б) Руководство ткани измельчитель. (а) Платформа (б) резки руку с лезвием держателя (C) Вернье микрометра, разрешение 10 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. электрофизиологии настройки для полевых записей, состоящих потенциал (а) стимуляторы (б) дифференциальный усилитель (с) аналого-цифрового преобразователя (г) осциллограф (е) компьютер с программным обеспечением приобретение (F) вибро- устойчивы столешница (г) микроскоп с> 4x увеличение (ч) Интерфейс мозг-срез камеры (я) системы перфузии для ACSF и карбогена питания (J) регулятора температуры (к) источник освещения (л) манипуляторов с держателями электродов. (В) Интерфейс мозг-ломтиккамера. (С) и (D), срезы гиппокампа в интерфейсе камеры. сталь электрод (Е) из нержавеющей запечатаны в стеклянный капилляр. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
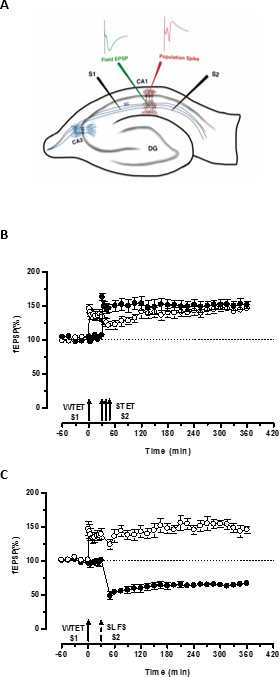
Рисунок 3. (А) Схематическое представление поперечного среза гиппокампа и электрода место для поля-потенциал записи: В этом представлении, два стимулирующих электродов (S1 и S2) расположены в роговом radiatum области СА1, чтобы стимулировать два независимых, но перекрывание синаптические входы на СА1 пирамидальных нейронов. Два внеклеточные электроды записи, чтобы записать один полевой ВПСП (возбуждающим постсинаптического потенциале) от апикальной дендритной отсека, а другой для записи соматической шип населения от пирамидальной клеткеорганы, находятся в роговом radiatum и рогового pyramidale соответственно. CA1- Корню ammonis область 1, CA3- Корню ammonis область 3, DG-зубчатая извилина, SC-Schaffer залога волокна, S1-стимулирующий электрод 1, S2-стимулирующий электрод 2. (В) Слабый перед сильными парадигмы изучения STC: Слабый тетанизация (WTET) применяется к S1 (кружки) для индуцирования раннего LTP с последующим сильным тетанизацией (STET) из S2 (закрашенные кружки) в 30 мин, чтобы вызвать позднюю БПЛ. Раннее БПЛ в S1 получает усиленный до конца БПЛ показывая маркировку и захватить взаимодействие (п = 6) (С) Слабая перед сильными парадигмы для изучения кросс-тегов:. В начале БПЛ индуцируется WTET в S1 (кружки), а затем индукцией поздней LTD в S2 (закрашенные кружки) с использованием SLFS через 30 мин. В S1, ранняя БПЛ трансформируется в конце БПЛ прочного 6 ч, показывающий поперечное тегов и захват (N = 6). Одноместный стрелка представляет слабую Тетанизация применяется для стимулирования раннего LTP. Триплет стрелок представляетсильный тетанизация для индукции конце-LTP. Разбитый стрелка представляет момент времени, в который SLFS был применен к представительной синаптической вход, чтобы побудить конце-LTD. Столбики ошибок указывают SEM. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Острый гиппокампа ломтик является отличным модельной системой для изучения LTP и других функциональных процессов, таких как пластичность и STC поперечного захвата. Это сохраняет много ламинарного структурной сети гиппокампа схем, позволяет получить точные местоположения электродов и предлагает наряду, открытую платформу для быстрого нейрофармакологической манипуляции без гематоэнцефалического барьера.
Эта статья описывает методику подготовки жизнеспособных острых срезов гиппокампа из молодых взрослых крыс и их использование для изучения STC и кросс-тегов. Предыдущие исследования подчеркнули, что пол и возраст животных, являются важными факторами, чтобы рассмотреть для использования в электрофизиологии исследований. 27,28 Поэтому молодые взрослые животные с полностью выраженными функциями взрослых рецепторов (самцов крыс линии Вистар в возрасте 5-7 недель), используются. 23 асимметрию в соединениях между левым и правым гиппокампа были отмечены у грызунов и 29Основные различия в экспрессии рецепторов NMDA сообщалось, а 34. Мы использовали правильный гиппокамп, чтобы быть совместимыми с наших предыдущих работах LTP. 23,32 Тем не менее, любой из гиппокампа может быть использован до тех пор, консистенция поддерживается.
Как и в любой протокол, это очень важно, чтобы выполнить изоляцию и нарезки процедуры быстро, но заботиться, что ткань не растягивается, поврежден вынесенное сухой или гипоксического. Изменения рН, температуры и ионного состава растворов может иметь существенное влияние на жизнеспособность срезов и результаты. Следовательно такие вариации следует избегать. Было замечено, что глутамат рецептор-зависимое высвобождение кальция происходит во время стадий приготовления может необратимо повлиять синтез белка в нервной ткани 35,36, 37. Использование ручных срезов тканей может помочь свести к минимуму это, позволяя процесс будет завершен очень быстро, по сравнению с VIbraslicers. Тем не менее, многие лаборатории также эффективно использовать vibraslicers с необходимыми предосторожностями, чтобы сохранить жизнеспособность ломтик. Еще одним важным фактором является длинный инкубационный период перед началом экспериментов. Это было отмечено, что на самом деле решающее значение для достижения стабильности в метаболических государственных и активации киназы уровнях ломтиками после нарушения, вызванные во время подготовки 23. Такая стабильность необходима согласованность долгосрочных записей. Мы вновь подчеркиваем на этом наблюдении и предложить длинные инкубационные часов около 3 часов.
Разнообразие параметров стимуляции, как известно, индуцируют LTP, но молекулярные механизмы, вызываемые в каждом случае не может быть такой же (для обзора см 38). Это может повлиять на прочность и другие характеристики, которые LTP, в свою очередь, может повлиять на результаты синаптических пометки и снимать экспериментов. Поэтому важно, чтобы проверить стимуляции парадигмы и характеристикиВызванные из ЛТП в условиях исполнительской лаборатории и поддерживать согласованность.
Как правило, мы не считаем, эксперименты с очень большими пресинаптических залпов волокна и с максимальными fEPSPs менее 0,5 мВ и экспериментов, связанных существенные изменения в волокна залп во время записи также отклонены. Кроме того, при выполнении двух или трех пути-пути экспериментов, важно, чтобы обеспечить пути независимости. Это может быть осуществлено с протоколом упрощению парных импульсов 28.
Один недостаток систем записи интерфейс является формирование конденсации капель на электродах в течение долгих часов записи в связи с различиями температуры и влажности между камерой и окрестностях. Эти капли должны быть тщательно уничтожены, время от времени. В противном случае капли могут капать на ломтики и вызвать нарушение или даже потерю сигналов. Мы обычно решить эту бу умело промокания капельки экскурсии под микроскопом, используя тонкую фильтровальную бумагу фитиля, не касаясь электродов. Тем не менее, лучшим решением было бы использовать централизованную систему отопления, такие как ETC системы, разработанной в Эдинбургском университете исследователей.
На заключительном примечании, разнообразие методик существуют в лабораториях по всему миру, которые используются для приготовления срезов гиппокампа для различных экспериментальных целей. Каждый из процедуры дает некоторые преимущества по сравнению с другими. Нужно тщательно оптимизировать мельчайшие детали протокола, чтобы удовлетворить цель эксперимента. Мы надеемся, что эта статья поможет в улучшении некоторые аспекты методологии для изучения поздно ассоциативных процессов, таких как СПУ и кросс-захвата.
Раскрытие информации
Открытый доступ для этого видео статьи авторами Cerebos Pacific Limited.
Благодарности
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Материалы
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Ссылки
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены