Method Article
Investigação de Synaptic Tagging / Captura e-captura Cruz usando aguda fatias do hipocampo de roedores
Neste Artigo
Resumo
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Resumo
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introdução
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocolo
Todos os procedimentos com animais foram aprovados pelo cuidado e uso Comitê Institucional Animal (IACUC) da Universidade Nacional de Cingapura.
1. Preparação de Cerebrospinal Artificial Fluid (ACSF)
- Prepara-se o ACSF que consiste em (em mM) 124 de NaCl, 3,7 de KCl, 1,0 MgSO 4 .7H 2 O, 2,5 CaCl 2 .2H 2 O, 1,2 KH 2 PO 4, 24,6 NaHCO3, e 10 D-glucose. Assegurar o pH da ACSF entre 7,2-7,4 quando é feito borbulhar para a saturação com 95% de O2 e 5% de CO 2 a mistura (carbogénio). 21 A utilização deste ACSF tanto para a dissecção, a preparação e para a fatia de perfusão durante as gravações electrofisiológicos.
NOTA: Use aparelho limpo para medir e segurando o ACSF. Usando o aparelho impuro pode conduzir a soluções turvas ou formação de precipitados. Use água deionizada por todos os preparativos. - Prepare a 2 L de 10x estoque ACSF excluindo NaHCO3 e D-glucose numa balão volumétrico. Adicionar os reagentes em água desionizada na seguinte ordem: NaCl (144.96g), KCl (5,52 g), MgSO 4 .7H 2 0 (4,92 g), CaCl2 .2H 2 0 (7,56 g), KH 2 PO 4 (3,28 g) e de topo até um volume de 2 L. Agita-se continuamente durante pelo menos 30 min utilizando um agitador magnético para garantir que todos os reagentes são dissolvidos. Armazenar o estoque em 4 ° C e usar dentro de 2 semanas.
- Antes da dissecção e as experiências, diluir o estoque ACSF num balão volumétrico, juntamente com a adição de quantidades necessárias de NaHCO3 e D-glucose. Para uma solução de L, dilui-se 100 ml de solução stock para 1 L, após a adição de 2,07 g de NaHCO 3 e 1,802 g de D-glucose. O ACSF deve ser uma solução transparente livre de qualquer precipitado ou partículas não dissolvidas.
- Fresco cerca de 200-300 ml de ACSF no gelo, para ser usado durante a dissecção. Certifique-se de que a ACSF utilizado para dissecção é entre 2-4 ° C. Use a ACSF restante para electropexperimentos hysiological. Bolha todas as soluções até à saturação ACSF com carbogénio (5% de CO2, 95% de O 2) continuamente. Enquanto espera para o ACSF para esfriar, preparar a área de dissecção e da câmara de fatia.
2. Preparação de interface Secção
NOTA: Uma câmara de fatia interface cérebro, utilizados para incubação as fatias e mantê-los durante registos electrofisiolicos (Figura 2B), consiste em dois compartimentos. A câmara inferior contém água mantida a 32 ° C destilada por um controlador de temperatura e continuamente borbulhada com carbogénio.
- Ligue o controlador de temperatura predefinida e que a 32 ° C. Lavou-se a câmara superior por 10 a 15 minutos de corrida água destilada através do tubo de entrada. Certifique-se de que a câmara superior é limpo antes de colocar o líquido. Verificar que o nível de água na câmara inferior é cerca de 70% cheio com água destilada.
- Coloque olíquido na câmara superior para proporcionar uma superfície de descanso para as fatias (Figura 2C). Ajustar o tubo de saída para assegurar que o nível da solução é suficientemente molhar toda a área da rede. Coloque a tampa acima da rede para manter uma atmosfera humidificada carbogénio dentro da câmara superior.
- Ajustar o caudal de 1 ml / min. Manter esta taxa de fluxo ao longo do período de incubação e a fatia experimento. Comece carbogenating a ACSF 1x preparados e mergulhe o tubo de influxo para o ACSF. Permitir 20 min para o ACSF para ser saturada com carbogéneo e para a câmara superior para ser enchido com ela.
3. Preparação de agudos fatias do hipocampo
NOTA: O protocolo de dissecção consiste de (1) remoção do cérebro do animal em ACSF frio e (2) Isolamento e corte do hipocampo. Para que os neurônios para permanecer viável, isolar e colocar o cérebro em ACSF frio rapidamente e completar o todoprocesso que inclui o corte dentro de 3-5 min.
- A remoção do cérebro em ACSF frio
- Separe as ferramentas de dissecação na maneira mostrada na Figura 1A. Organizar as ferramentas de acordo com a ordem de uso para facilitar o processo de dissecação. Antes de começar, certifique-se de todas as ferramentas de dissecação estão prontos.
- Montar uma lâmina de barbear, limpos com acetato de etilo, etanol absoluto e água destilada, para o cortador de tecidos manual (Figura 1B), fixe-o com firmeza e assegurar que a vanguarda é uniformemente alinhadas. Teste cortando um pedaço de papel de filtro para assegurar que a lâmina está fixada firmemente. Definir o deslizamento Vernier micrômetro à sua posição inicial.
- Eutanásia dos animais utilizando o dióxido de carbono (CO 2) numa câmara de indução e decapitar com tesouras ligadura ou guilhotina. Usando uma tesoura de íris, retire a pele e pêlo acima do crânio. Faça um corte através do posterior para remover a brainstem.Make uma pequena incisão ao longo thum e lado direito do crânio e uma longa incisão na parte esquerda.
CUIDADO! Adicione apenas uma pequena incisão para o lado que é utilizado para as experiências para evitar danos. Ao inserir as tesouras, certifique-se de que a força aplicada é para cima a fim de evitar danos no cérebro. - Cuidadosamente remover o crânio com um osso rongeur a partir da esquerda para a direita do crânio para revelar o córtex. Uma fina camada de dura-máter pode também ser visto. Remova cuidadosamente as placas frontais com o rongeur. Remover a maior parte da dura-máter, juntamente com as placas frontais.
CUIDADO! Tenha cuidado para que a dura-máter não cortar o tecido cerebral. - Remover a dura-máter restante, se houver, especificamente na junção entre o córtex e cerebelo com a extremidade plana de uma espátula. Para obter etapas 3.1.5 e 3.1.6, ou seja, manter uma pressão para cima, longe do cérebro para evitar danos. Utilizando a espátula, colher suavemente o cérebro para uma placa de petri cheia com água fria e ACSF carbogenated (2-4 ° C), PLAced sobre um bloco de alumínio de arrefecimento.
- O isolamento do hipocampo
- Usando um bisturi, fazer um corte em linha reta para remover o cerebelo e outro corte para remover a parte anterior do cérebro (cerca de um quarto). Faça um corte raso ao longo da linha média.
- Remover cuidadosamente o córtex com um raspador de foice, a partir da linha média para revelar as hipocampo dorsal. Remover a camada de córtex acima do hipocampo. Use dedos ou uma pinça angular para apoiar o cérebro. Faça um pequeno corte para a comissura do hipocampo. Remova cuidadosamente o hipocampo com o scaler foice a partir do hipocampo dorsal usando movimentos ondulantes.
CUIDADO! Seja gentil para evitar esticar e rasgar o hipocampo. - Remova qualquer córtex e tecidos conjuntivos em torno do hipocampo isolado com o scaler foice.
- Cortando o tecido do hipocampo e transferir as fatias para a câmara de interface
- Coloque um pedaço de ACSF-papel de filtro embebido (Grau 1, 30 mm) na fase de corte do cortador manual. Colher e colocar o tecido do hipocampo para o papel de filtro. Mover o papel de filtro para alinhar o hipocampo numa orientação adequada em relação à lâmina do cortador de modo a que o hipocampo é cortado com um ângulo de cerca de 70 O para a fímbria.
- Seque a solução em excesso em torno do tecido do hipocampo com um papel de filtro dobrado (Grau 1, 85 mm), deixando o hipocampo ligeiramente molhado. Começar a cortar transversalmente o hipocampo. Fatia e eliminar o tecido a partir do extremo do hipocampo onde a morfologia fatia não é clara.
- Corte o tecido remanescente em 400 fatias mm de espessura. Pegue fatias do hipocampo suavemente da lâmina com uma escova com cerdas macias usando movimentos suaves swiping e coloque as fatias em um pequeno copo cheio com ACSF carbogenated frio. Executar os passos 3.3.1-3.3.3 tão rapidamente quanto possível uma vez que o tecido do hipocampo é exposta ao ar.
NOTA: De um modo geral, dois terços do hipocampo é cortado, e 4-6 fatias com morfologia clara pode ser preparado. - Transfira as fatias suavemente sobre a rede na câmara de fatia usando uma pipeta de Pasteur de plástico limpo com uma ponta larga (feito com a retirada de 2-3 cm da ponta). Ajustar cuidadosamente a posição das fatias na rede, usando uma pequena seringa com uma ponta dobrada. Posicione as fatias de uma maneira que facilita a localização do eletrodo e gravação. Verificar para assegurar que as fatias são suficientemente rodeado por ACSF mas não estão submersos ou flutuante (Figura 2C-D). Cubra a câmara e incubar as fatias de 2-3 horas.
NOTA: A camada de células piramidais nas fatias saudáveis devem mostrar alguma transparência.
4. A gravação de Respostas CA3-CA1 Synaptic
NOTA: O electrofisiologia set-up usado para gravação de campo potencial é mostrado na Figura 2A. A Faragaiola dia é fortemente recomendada se a interferência elétrica está além do controle após o aterramento adequado dos ajustes elétricos. Muitos tipos diferentes de câmaras submersas e de interface estão disponíveis comercialmente. No entanto, câmaras de interface são preferidos como fatias apresentam respostas sinápticas mais robustos em si.
- Posicionamento de eletrodos
- Ligue o aparelho eléctrico (estimuladores) e amplificadores para ser utilizado. Montar e fixar os eletrodos de estimulação e gravação nos suportes de acrílico dos micromanipuladores.
NOTA: Nós usamos monopolar, revestido de laca, eletrodos de aço inoxidável de resistência 5 mohms, tanto para fins de estimulação e gravação. - Antes de usar, inserir esses eletrodos no interior dos capilares de vidro puxado e prenda com cola epóxi expondo apenas uma pequena porção da ponta do eletrodo (Figura 2E). Isto dá força para os eletrodos de outra forma delgado e ajuda a protegê-los firmemente no ELEctrode titulares.
- Guiado sob o microscópio, posicione o eletrodo (s) estimulante no estrato radiante da região de CA1 para estimular as fibras colaterais Schaffer e do eletrodo de registro na região apical dendrítica de CA1 para gravar (fEPSP) respostas de campo-EPSP.
NOTA: Aproximando-se da superfície do líquido acima da fatia com os eléctrodos dá um som que ajuda a localizar rapidamente a superfície da fatia (fornecida, o amplificador está ligado a um altifalante). - Em experiências de marcação e de captura sinápticos, de acordo com a necessidade do experimento, posição dois ou três eléctrodos estimulantes (S1, S2 ou S3) de cada lado do eléctrodo de registo para estimular a duas ou mais entradas independentes, mas que se sobrepõem. Posicione os eletrodos estimulantes e de gravação cerca de 200 mm de distância.
- Se necessário, localizar outro eléctrodo de registo na camada de estrato pyramidale para gravação de pico população (Figura 3A) .Quando a amboseletrodos ter tocado a fatia, usando o software de aquisição, dar um estímulo de teste para garantir um sinal fEPSP adequada.
NOTA: Nós usamos bifásicos, pulsos de corrente constante (duração de impulso de 0,1 ms / meia onda) para a estimulação de teste. - Uma vez que um sinal fEPSP adequada é obtida, baixe cuidadosamente os eletrodos cerca de 200 um profundo usando botões Movimento Belas dos manipuladores. Permitir que 20 min durante as fatias para recuperar. Teste a independência caminho com um protocolo de facilitação emparelhado pulso 27,28.
- Ligue o aparelho eléctrico (estimuladores) e amplificadores para ser utilizado. Montar e fixar os eletrodos de estimulação e gravação nos suportes de acrílico dos micromanipuladores.
- Relação de entrada-saída
- Determinar a relação de entrada-saída (estimulação aferente vs fEPSP inclinação) para cada entrada através da medição do valor da inclinação a uma gama de intensidades de corrente. Execute esta entre 20 mA a 100 mA. Em seguida, definir a intensidade de estimulação para cada entrada para se obter 40% da inclinação máxima fEPSP. Manter esta constante ao longo da experiência.
- Após 15-20 minutos, começar a gravar a linha de base. Monitorar o fEPSP inclinação de perto durante este período e repor a intensidade do estímulo se a inclinação varia mais de 10% do valor definido e iniciar uma nova linha de base. Grave, pelo menos, 30 min ou 1 hr linha de base estável antes de prosseguir.
NOTA: Para o teste ou a estimulação da linha de base, usamos quatro varreduras de 0,2 Hz bifásicos, pulsos de corrente constante (0,1 ms por polaridade) dadas a cada 5 minutos. Uma inclinação média destas quatro respostas é então considerado como uma repetição. Os sinais são filtrados e amplificados por um amplificador diferencial, digitalizadas utilizando um conversor analógico-para-digital e monitorizada on-line com o software feito por encomenda.
- A indução da LTP / LTD utilizando os protocolos de estimulação
NOTA: Ambos LTP e LTD foram classificados como precoce e tardia-LTP / LTD com base nos requisitos de síntese de proteínas; a tradução exigindo último e / ou transcrição para sua manutenção tarde [para revisão ver 4]. Uma variedade de paradigmas de estimulação eléctrica pode specifically induzir as diferentes formas de LTP e LTD.- WTET: 100 Hz, 21 bifásicos pulsos de corrente constante (0,2 ms por fase).
- STET: Três explosões de 100 pulsos por um segundo (100 Hz) a cada 10 minutos (Pulse largura de 0,2 ms por fase).
- 900 rajadas mais de 15 minutos de duração. 1 explosão consiste de 3 impulsos de largura (0,2 mseg) com um intervalo interpulso de 50 ms (20 Hz). O intervalo inter explosão é de 1 seg (número total de pulsos 2.700).
5. Limpeza da Câmara Slice e Perfusão Sistema
- Após a gravação terminar, recolher as fatias do hipocampo para posterior análise bioquímica ou então descartar adequadamente. Desligue o abastecimento de carbogênio e controlador de temperatura. Lave o bubbler carbogénio em água destilada.
- Limpe o líquido cuidadosamente com uma escova e água destilada. Lava-se a sonda para 15-20 min com água destilada a um caudal mais elevado. Uma vez em 3-4 dias, alterar a água destilada nocompartimento inferior da câmara, e também limpos regularmente com a câmara de solução de peróxido de hidrogénio a 3% para evitar o crescimento de fungos.
Resultados
A metodologia descrita foi utilizada para estudar formas duradouras de LTP / LTD e suas interações associativas, tais como marcação sináptica e-captura cruzamento fatias do hipocampo agudos de ratos adultos. 23 Esta técnica tem se mostrado eficaz para experimentos com ambos os ratos (Wistar) e uma variedade de estirpes de rato 30,31. A metodologia tem sido utilizada com sucesso para gravações LTP estável de até 8-12 h. 32
O 'tag' definido pelo tetanização fraco de uma entrada (S1) capta o induzido pela forte tetanização de outra entrada independente, mas sobreposição »PPR '(S2; Figura 3B, círculos preenchidos) transformando assim a forma de outra forma decadente de LTP (precoce -LTP) em S1 em uma longa duração um (Figura 3B, círculos abertos) (Para efeito de comparação de early-LTP induzida por WTET ver 20,33). Os PPR capturados pelo fracotag conjunto tetanização não precisa vir necessariamente do induzida pela STET de fim de LTP, mas também pode ser fornecida pelo induzida por SLFS late-LTD. Este tipo de interação positiva entre associativa LTP e LTD é referido como 'cruz-tagging / capture ". O induzida por WTET early-LTP em S1 fica reforçada a fim de LTP (Figura 3C, círculos abertos), capturando os PPRs fornecidos pelo induzida por SLFS late-LTD em S2 (Figura 3C, círculos preenchidos). Estatisticamente significativa potenciação ou depressão foi mantida em S1 e S2, em ambos os casos, quando comparada com a sua própria linha de base (teste de Wilcoxon; P <0,05).
Para a interacção Tag-PRP a ocorrer, a ordem temporal dos dois eventos (fraco-antes-forte /-forte antes-fraco) não é crucial, desde que a janela de tempo entre os dois eventos permanece dentro da gama de 30-60 minutos. Seria sensato para incluir um terceiro, independente, mas a sobreposição sináptica emcolocar e usá-lo como um controle de linha de base para monitorar a estabilidade das gravações. Os protocolos de estimulação elétrica utilizados para induzir formas precoce e tardia da LTP / LTD devem ser validados em experimentos de entrada única para a consistência e confiabilidade antes de usá-los em experimentos STC. Também gostaríamos de enfatizar a importância da metodologia de preparação fatia descrito no protocolo uma vez que o sucesso dessas experiências depende muito da qualidade das fatias.
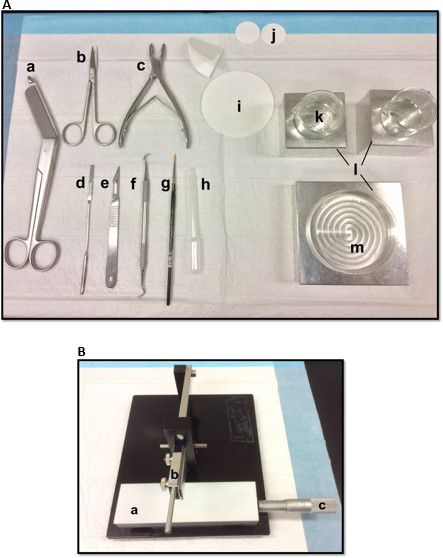
Figura 1. (A) Ferramentas utilizadas na dissecção das hipocampo: (a) Bandage Scissors (b) Iris tesoura (c) rongeur óssea (d) espátula fina, (e) número 11 Scalpel (f) scaler Sickle (g) Macio -bristle pincel (h) plástico Pasteur pipeta (i) papel de filtro (85 milímetros) (j) papel de filtro (30 mm) (k) taças de vidro (l) blocos de refrigeração de alumínio para caber placa de petri e taçasprato (m) Petri. (B) cortador de tecidos Manual. (a) Platform (b) Corte braço com lâmina titular (c) Vernier micrómetros, resolução de 10 microns. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Electrofisiologia set-up para gravações potencial de campo consiste em (a) estimuladores (b) um amplificador diferencial (c) um análogo-digital conversor (d) osciloscópio (e) computador com software de aquisição (f) vibratória table-top resistente (g) microscópio com> 4x ampliação (h) interface cérebro-slice de câmara (i) um sistema de perfusão para ACSF e carbogénio alimentação (j) o controlador de temperatura (k) uma fonte de iluminação (l) manipuladores com porta-eletrodos. (B) de interface cérebro-slicecâmara. (C) e (D) fatias do hipocampo na câmara de interface eletrodo de aço. (E) inoxidável selado em um capilar de vidro. Por favor clique aqui para ver uma versão maior desta figura.
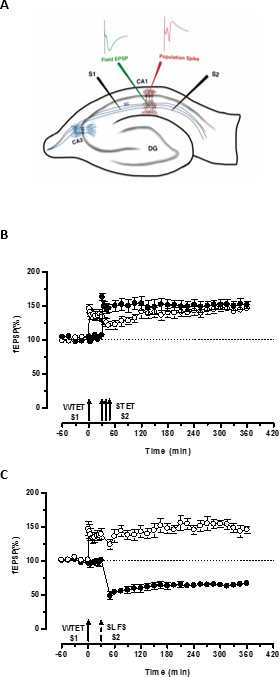
Figura 3. (A) Representação esquemática de uma fatia do eléctrodo e localização transversal do hipocampo para gravação potencial de campo: Nesta representação, dois eléctrodos estimulantes (S1 e S2) estão posicionados no stratum radiatum da região CA1 para estimular dois independente mas sobreposição entradas sinápticas Onto neurônios piramidais CA1. Dois eletrodos de registro extracelular, uma para gravar campo-EPSP (potencial excitatório pós-sináptico) do compartimento dendrítica apical e outro para gravar somática pico população a partir da célula piramidalorganismos, estão localizados no stratum radiatum e estrato pyramidale respectivamente. CA1- cornu Ammonis região 1, CA3- cornu Ammonis região 3, giro denteado DG-, fibras colaterais SC- Schaffer, S1- estimulando eletrodo 1, eletrodo S2 estimulante 2. (B) Fraco antes forte paradigma para estudar STC: tetanização Fraco (WTET) é aplicada a S1 (círculos abertos) para a indução de LTP-precoce seguido de tetanização forte (STET) de S2 (círculos a cheio) aos 30 min para induzir a fim de LTP. A-LTP no início S1 fica reforçada a fim de LTP mostrando a marcação e capturar a interação (n = 6) (C) Fraco antes forte paradigma para estudar cruz-tagging:. Early-LTP é induzida por WTET em S1 (círculos abertos), seguida pela indução de tarde em LTD-S2 (círculos a cheio) usando SLFS após 30 min. Em S1, o início de LTP é transformado em late-LTP duradoura 6 horas mostrando cross-tagging e captura (n = 6). Seta simples representa tetanização fraco aplicado para induzir early-LTP. Triplet de flechas representatetanização forte para induzir late-LTP. A seta a tracejado representa o ponto de tempo em que SLFS foi aplicado à entrada sináptica representante para induzir a fim de LTD. As barras de erro indicam SEM. Clique aqui para ver uma versão maior desta figura.
Discussão
Fatia hipocampal aguda é um excelente sistema modelo para o estudo da LTP e outros processos de plasticidade funcionais, tais como STC e captura-cruzada. Ela conserva grande parte da rede estrutural laminar dos circuitos do hipocampo, permite que os locais precisos de eléctrodos e oferece ao lado, uma plataforma aberta para manipulação neurofarmacológica rápida sem a barreira sangue-cérebro.
Este artigo descreve a metodologia para a preparação de fatias do hipocampo agudas viáveis de ratos adultos jovens e usá-los para investigar STC e cross-tagging. Pesquisas anteriores já haviam enfatizado que o sexo ea idade dos animais são factores importantes a considerar para uso em estudos de eletrofisiologia. 27,28 Portanto animais jovens adultos com funções de receptores adultos plenamente expressos (ratos Wistar machos com idade entre 5-7 semanas) são utilizados. 23 Assimetrias nas ligações entre o hipocampo esquerdo e direito foram observados em roedores e 29grandes diferenças na expressão do receptor de NMDA têm sido relatados como bem 34. Usámos o hipocampo direito, a fim de ser compatível com os nossos estudos anteriores LTP. 23,32 No entanto, qualquer um dos hipocampos pode ser usado contanto que a consistência é mantida.
Como em qualquer protocolo, é muito crucial para realizar o isolamento e corte de procedimentos rapidamente, mas tomando cuidado para que o tecido não é esticado, danificado, seja seco ou hipóxica. As variações do pH, da temperatura e da composição iónica das soluções podem ter um efeito profundo sobre a viabilidade das fatias e os resultados. Assim tais variações devem ser evitados. Tem sido observado que a libertação de glutamato dependente do receptor de cálcio que ocorre durante as etapas de preparação pode afectar irreversivelmente a síntese de proteína no tecido nervoso 35,36, 37. Usando máquinas de corte de tecido manuais pode ajudar a minimizar este, permitindo que o processo esteja concluído muito rapidamente em comparação com VIbraslicers. No entanto, muitos laboratórios também utilizam efetivamente vibraslicers com as precauções necessárias para preservar a viabilidade fatia. Outro fator importante a considerar é o longo período de incubação antes do início dos experimentos. Isto foi anotado para ser realmente crucial para alcançar a estabilidade em níveis estadual e ativação da quinase metabólicas em fatias após a perturbação causada durante a preparação 23. Essa estabilidade é necessária para a consistência em gravações a longo prazo. Nós re-enfatizar nesta observação e sugerir as horas de incubação longo de cerca de 3 horas.
Uma variedade de parâmetros de estimulação são conhecidos por induzir LTP, mas os mecanismos moleculares induzidos em cada caso pode não ser o mesmo (para revisão ver 38). Este pode influenciar a durabilidade e outras características da LTP, que, por sua vez, pode afectar os resultados de experiências de marcação e de captura sinápticos. Por isso, é importante validar os paradigmas de estimulação e característicasda LTP evocados sob as condições do laboratório que realiza e manter a consistência.
Nós geralmente não consideram experiências com grandes rajadas de fibra pré-sinápticos e com fEPSPs máximos inferiores a 0,5 mV e as experiências que envolvem mudanças substanciais no vôlei de fibra durante as gravações também são rejeitadas. Além disso, durante a realização de duas ou três vias vias experiências, é importante para assegurar a independência via. Esta pode ser levada a cabo com um protocolo de facilitação de pulso emparelhado-28.
Uma desvantagem dos sistemas de registro de interface é a formação de gotículas de condensação sobre os eletrodos durante as horas de gravações longas, devido às diferenças de temperatura e umidade entre a câmara e os arredores. Estas gotículas devem ser cuidadosamente transferidas ao longo do tempo. Caso contrário, as gotículas podem escorrer para as fatias e causar perturbação ou mesmo perda de sinais. Costumamos fazer face a este by habilmente secar as gotículas guiadas sob o microscópio usando um pavio papel de filtro fino, sem tocar os eletrodos. No entanto, a melhor solução seria a utilização de um sistema de aquecimento centralizado, tais como o sistema de ETC desenvolvido por investigadores da Universidade de Edimburgo.
Em uma nota final, uma variedade de metodologias existem nos laboratórios de todo o mundo que são utilizados para a preparação de fatias do hipocampo para diferentes fins experimentais. Cada um dos procedimento oferece algumas vantagens sobre o outro. Uma das necessidades para otimizar cuidadosamente os detalhes minuciosos de o protocolo de acordo com o objectivo da experiência. Esperamos que este artigo ajuda a melhorar alguns aspectos da metodologia para o estudo de processos atrasados associativa como STC e-captura cruz.
Divulgações
O acesso aberto para este artigo vídeo é patrocinado pela Cerebos Pacific Limited.
Agradecimentos
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materiais
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Referências
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados