Method Article
げっ歯類からの急性海馬スライスを用いて、シナプスタグ付け/キャプチャとクロス捕獲調査
要約
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
要約
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
概要
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
プロトコル
すべての動物の手順は、シンガポール国立大学の施設内動物管理使用委員会(IACUC)によって承認されました。
人工脳脊髄液の1.準備(ACSF)
- 、124のNaCl、3.7塩化カリウム(MM)でのMgSO 4・7H 2 O 1.0、2.5のCaCl 2・2H 2 OからなるACSF、1.2 KH 2 PO 4、24.6のNaHCO 3、および10 D-グルコースを準備します。解剖、スライス標本と電気生理学的記録の間の灌流のための両方のために、このACSF 95%O 2および5%CO 2混合物 (カーボゲン)。21を使用した、飽和に泡立てたときにACSFのpHは7.2から7.4の間であることを確認してください。
注:ACSFを測定し、保持するためのクリーンな装置を使用してください。汚れた装置を使用して、濁った溶液又は沈殿物の形成をもたらすことができます。すべての準備のために脱イオン水を使用してください。 - NaHCO 3を除いた2リットルの10倍のACSFの株式を準備とメスフラスコ中のD-グルコース。塩化ナトリウム(144.96グラム)、塩化カリウム(5.52グラム) し 、MgSO 4・7H 2 0(4.92グラム)、塩化カルシウム2・2H 2 O(7.56グラム)、KH 2 PO 4(3.28:次の順序で脱イオン水に試薬を追加2 Lの容積にグラム)とトップアップは、すべての試薬が溶解していることを確認するために、磁気撹拌機を用いて少なくとも30分間連続して攪拌します。 4°Cの中で株式を保存し、2週間以内に使用します。
- 解剖や実験に先立ち、NaHCO 3およびD-グルコースの必要量を加えて一緒にメスフラスコにACSFの株式を希釈します。 1 L溶液は、2.07グラムのNaHCO 3および1.802グラムのD-グルコースを添加した後、1Lに株式の100ミリリットルを希釈。 ACSFは、沈殿物や未溶解粒子を含まない透明な溶液にする必要があります。
- クール200〜300 mlの氷のACSFの、解剖時に使用されます。解剖のために使用ACSFは2-4℃の間であることを確認してください。 electropの残りのACSFを使用しますhysiological実験。バブルすべてACSF溶液を連続的にカルボゲン(5%CO 2、95%O 2)で飽和します。 ACSFを冷却するために待っている間、解剖領域とスライス室を準備します。
インターフェイス商工会議所の調製
注:スライスをインキュベートし、電気生理学的記録( 図2B)の間にそれらを維持するために使用されるインターフェース脳切片室は、2つの区画で構成されています。下部チャンバは、温度制御装置により32℃に維持した水を蒸留し、連続的にカルボゲンを通気含ま。
- 温度コントローラに切り替え、32℃で、それをプリセット。流入管を通して蒸留水を実行して、10〜15分間、上部チャンバーを洗浄します。上室は、ネットを配置する前にクリーンであることを確認してください。下部チャンバー内の水位が蒸留水で満たされた約70%であることを確認してください。
- 置きスライス( 図2C)のための休息面を提供するために、上部チャンバーの純。ソリューションレベルは十分にネットの全領域を湿潤されることを保証するために流出チューブを調整します。上部チャンバー内の加湿カルボゲン雰囲気を維持するためにネット上に蓋を置きます。
- 1ml /分の流量を調整します。スライスのインキュベーション期間および実験を通して、この流量を維持します。新たに調製した1×ACSFをcarbogenating起動し、ACSFに流入チューブを浸します。 ACSFのための20分は、カルボゲンで、それに充填する上部チャンバーのために飽和させることができるようにします。
急性海馬スライスの調製
注:解剖プロトコルは冷たいACSFに動物由来の脳の(1)の取り外しと(2)の単離および海馬のスライスで構成されています。ニューロンは、生存したままで分離し、すぐに冷たいACSFで脳を配置し、全体を完了するために、3-5分以内にスライスを含むプロセス。
- 風邪ACSFに脳の除去
- 図1(a)に示すようにして解剖ツールをレイアウト。解剖プロセスを促進するための使用のために応じてツールを配置します。開始する前に、すべての解剖ツールは準備ができていることを確認します。
- しっかりと固定し、カッティングエッジが均一に整列されていることを確認し、手動組織チョッパー( 図1B)に、酢酸エチル、無水エタノール及び蒸留水で洗浄カミソリの刃を、マウントします。テストブレードがしっかりと固定されていることを保証するために、フィルター紙を細断。その開始位置にスライドバーニアマイクロメータを設定します。
- 誘導室中の二酸化炭素(CO 2)を用いて動物を安楽死させると、包帯はさみやギロチンで首を切ります。アイリスのはさみを使用して、頭蓋骨上の皮膚や被毛を削除します。 brainstem.Makeに目に沿って小さな切開を除去するために、後部を切断してください頭蓋骨の右側と左側に長い切開を電子。
注意!それの損傷を防ぐために、実験のために使用された側にのみ小さな切開を行います。はさみを挿入する場合、適用される力は、脳への損傷を避けるために上向きであることを確認してください。 - 慎重に皮質を明らかにするために頭蓋骨の右側に左から骨鉗子骨と頭蓋骨を削除します。硬膜の薄い層は、見ることができます。慎重に骨鉗子と正面プレートを取り外します。正面プレートと一緒に硬膜の大部分を削除します。
注意!硬膜は脳組織をスライスしないように注意してください。 - 特にへらの平坦な端部と皮質と小脳の間の接合部に、もしあれば、残りの硬膜を削除します。ステップ3.1.5と3.1.6の場合は、それを損傷しないように離れて脳から、上向きすなわち圧力を維持します。へらを使用して、静かに冷たいで満たされたペトリ皿に脳をスクープし、ACSF(2-4°C)をcarbogenated、ナンプラーアルミ冷却ブロック上をced。
- 海馬の単離
- メスを用いて、脳(約1/4)の前方部分を削除するには、小脳、別のカットを削除するには、ストレートカットを行います。正中線に沿って浅いカットを行います。
- 慎重に背側海馬を明らかに正中線から開始し、鎌スケーラーと皮質を除去します。海馬上記の皮質の層を削除します。脳をサポートするために、指や角度のついたピンセットを使用してください。海馬交連に小さなカットを行います。なだらかな動きを使用して、背側海馬から始まる鎌スケーラーで海馬を削除します。
注意!ストレッチや海馬を引き裂く避けるために穏やかなこと。 - 鎌スケーラーで分離された海馬の周りの任意の皮質および結合組織を除去します。
- 海馬組織をスライスし、インターフェースチャンバー上にスライスを転送します
- ACSF-の作品を配置します手動スライサーのスライスステージ上浸したろ紙(グレード1、30ミリメートル)。スクープとろ紙上に海馬組織を配置します。海馬は采に約70 Oの角度でスライスされるように、スライサーの刃との関係で適切な方向で海馬を整列させるためにろ紙を移動します。
- 少し湿った海馬を残して折り畳まれたろ紙(グレード1、85ミリメートル)と海馬組織を囲む余分な溶液を吸い取ります。横方向に海馬スライス開始します。スライスとスライス形態は明らかではない海馬の先端から組織を捨てること。
- 厚さ400μmのスライスに残りの組織をスライス。穏やかなスワイプの動きを用いたソフト剛毛ブラシでブレードから優しく海馬スライスをピックアップし、冷たいcarbogenated ACSFで満たされた小さなビーカーにスライスを配置します。手順を実行し3.3.1-3.3.3、可能な限り迅速に海馬組織が空気に露出しているため。
注意:一般的に海馬の3分の2がスライスされて、明確な形態を有する4~6切片を調製することができます。 - (先端2〜3センチ離れて切断することによって作られた)幅広い先端で清潔なプラスチック製パスツールピペットを用いて、スライス室で静かにネット上にスライスを転送します。慎重に曲がった先端で小さな注射器を使用してネット上のスライスの位置を調整します。電極の位置と記録を容易にするようにスライスを配置します。スライスが十分にACSFに囲まれているが、水没または浮動( 図2C-D)されていないことを確認します。チャンバーをカバーし、2〜3時間のスライスをインキュベートします。
注:健康スライスにおける錐体細胞層は、いくつかの透明性を示すべきです。
4.録音CA3-CA1シナプスの応答
注:フィールドの潜在的な記録のために使用される電気のセットアップは 、図2Aに示されています。ファーラ電気的干渉は、電気の設定を適切に接地した後に制御を超えている場合はその日のケージを強くお勧めします。沈め、インターフェース室の多くの異なる種類が市販されています。しかし、インターフェース室は、その中のスライスを呈する、より堅牢なシナプス応答として好ましいです。
- 電極の位置決め
- 使用する電気機器(刺激剤およびアンプ)の電源を入れます。マウントとマイクロマニピュレーターのプレキシガラスホルダーに刺激と記録電極を固定します。
注:我々は両方の刺激と記録の目的のために5MΩ抵抗の単極、ラッカーでコーティングされた、ステンレス製の電極を使用しています。 - 使用前に、引っ張らガラスキャピラリーの内部でこれらの電極を挿入し、電極先端部( 図2E)のほんの一部を露出するエポキシ接着剤で固定します。これは、そうでない場合は細い電極に強度を与え、しっかりとELEでそれらを確保するのに役立ちますctrodeホルダー。
- 顕微鏡下でガイド付き、フィールドEPSP(のfEPSP)応答を記録するために、シャファー側枝繊維とCA1の先端樹状領域での記録電極を刺激するためにCA1領域の放線層に刺激電極(複数可)を配置します。
注:電極とスライス上記液面へのアプローチは、すぐにスライス(提供、アンプがスピーカに接続されている)の表面を見つけるのに役立ちますサウンドを提供します。 - シナプスタグおよび捕捉の実験では、実験の必要性に応じて、記録電極の両側に位置二、三刺激電極(S1、S2またはS3)は、2つ以上の独立したが、重複入力を刺激します。離れて200ミクロン程度の刺激と記録電極を配置します。
- 必要ならば、集合スパイク( 図3A)を記録するための層の三角骨層内の他の記録電極を見つけ.When両方電極は適切なのfEPSP信号を確実にするために、テスト刺激を与え、取得ソフトウェアを使用して、スライスに触れています。
注:我々はテスト刺激のための二相性、定電流パルス(インパルス持続時間0.1ミリ秒/半波)を使用します。 - 適切なのfEPSP信号が得られると、慎重に深いマニピュレータの微動ノブを使用して、200ミクロン程度の電極を下げます。スライスが回復するために20分を許可します。ペアのパルスの円滑プロトコル27,28と経路独立性をテストします。
- 使用する電気機器(刺激剤およびアンプ)の電源を入れます。マウントとマイクロマニピュレーターのプレキシガラスホルダーに刺激と記録電極を固定します。
- 入出力関係
- 現在の強度の範囲で傾斜値を測定することによって、入力ごとに入出力関係(のfEPSPのスロープ対求心性刺激)を決定します。 100μA〜20μAの間でこれを実行します。そして、最大のfEPSPの傾きの40%を取得するために、各入力のための刺激強度を設定します。実験を通じて、この一定に保ちます。
- 15〜20分後、ベースラインの記録を開始。 Fを監視この期間中に密接にEPSPスロープおよびスロープが設定値から10%以上変動し、新しいベースラインを起動した場合刺激強度をリセットします。録音先に進む前に、少なくとも30分または1時間安定したベースライン。
注:テストまたはベースライン刺激のために、私たちは5分ごとに与えられた0.2 Hzの二相性、定電流パルスの4スイープ(極性あたり0.1ミリ秒)を使用します。これら四つの応答の平均勾配は、その後、1リピートとして考えられています。信号は、差動増幅器によってフィルタリングされ、増幅され、アナログ - デジタル変換器を用いてデジタル化し、カスタムメイドのソフトウェアを使用してオンラインでモニターしました。
- LTP / LTDの誘導刺激プロトコルを使用して
注:タンパク質合成の要件に基づいて、LTPとLTDの両方が早くも分類されていると後期LTP / LTD。その後半メンテナンスのため、後者が必要な翻訳および/ または転写【レビュー4を参照してください ]。電気刺激パラダイムの様々なspecificallことができますyは、LTPとLTDの異なる形式を誘発します。- WTET:100ヘルツ、21二相性定電流パルス(相あたり0.2ミリ秒)。
- STET:1秒(100 Hz)で10分毎に(相あたり幅0.2ミリ秒パルス)のための100パルスの三つのバースト。
- 15分の期間にわたって900バースト。 1バーストは、50ミリ秒(20 Hz)との間間隔で3パルス(0.2ミリ幅)で構成されています。インターバースト間隔は1秒(パルス2700の総数)です。
スライス室と灌流システムの5.洗浄
- 録音が終わった後、さらに生化学的解析のために海馬スライスを収集したり、他の適切に廃棄します。カーボゲンの電源電圧および温度コントローラの電源を切ります。蒸留水にカーボゲンバブラーを洗ってください。
- ブラシと蒸留水で徹底的にネットを清掃してください。高い流量で蒸留水で15〜20分間リグを洗ってください。 3-4日に1回、蒸留水を変更また、下部チャンバの区画と真菌の増殖を避けるために、3%過酸化水素溶液で定期的にチャンバを洗浄。
結果
記載された方法は、LTP / LTDなどのシナプスタグ付けおよび成体ラットの急性海馬スライスからのクロスキャプチャとしての連想相互作用の長期的なフォームを研究するために使用されている。23この技術は、両方のラット(Wistar系)を用いた実験のために有効であることが分かっていますマウスの様々な30,31を株。方法論は、最大8〜12時間の安定したLTP記録のために正常に使用されています。32
早期LTPの;( 図3B、黒丸 S2)、それによって形質転換しそうでなければ減衰形(1入力(S1)の弱い強直誘発によって設定された「タグ」は、「PRPの「別の独立しているが、重複入力の強い強直誘発により誘導されるをキャプチャ長期的な1( 図3B、白丸)にS1で-LTP)(WTETによって誘発される早期LTPの比較については20,33を参照してください )。弱いによって捕獲のPRP強直誘発セットタグは必ずしもイキによって誘発される後期LTPから来る必要はなく、またSLFSによって誘発される後期株式会社によって提供することができます。 LTPとLTDとの間に正の連想このタイプの相互作用は、「クロスタグ付け/キャプチャ」と呼ばれています。 S1でWTET誘発性の早期LTPはS2でSLFSによって誘発される後期株式会社が提供するのPRP( 図3C、黒丸)を捕捉することにより後期LTP( 図3C、白丸)に強化されます。自身のベースラインと比較した場合に統計的に有意な増強またはくぼみは、両方の場合において、S1及びS2に維持された(ウィルコクソン検定、P <0.05)。
が発生するタグ-PRPの相互作用のために、2つのイベント(弱前強い/強い・ビフォア・弱)の時間的順序は、二つのイベント間の時間ウィンドウは30〜60の範囲内にある限り、重要ではありません分。それはでは、第3の独立しているが、重複シナプスを含めることが賢明だろう入れて、レコーディングの安定性を監視するために、ベースラインコントロールとして使用します。 LTP / LTDの早期及び後期のフォームを誘導するために使用される電気刺激プロトコルは、STCの実験で使用する前に、一貫性と信頼性のための単一入力の実験で検証する必要があります。また、これらの実験の成功は、スライスの品質に大きく依存しているため、プロトコルに記載スライス標本の方法論の重要性を強調したいと思います。
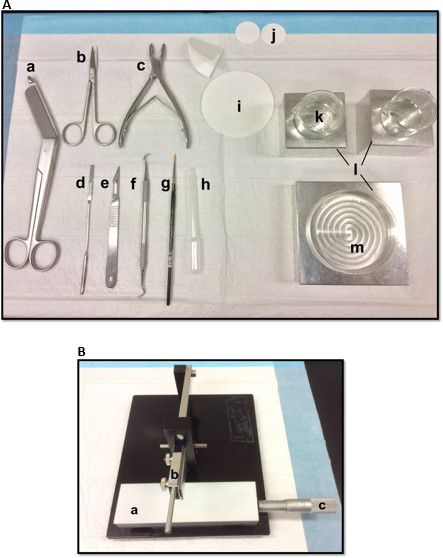
海馬の解剖に使用される図1(A)ツール:(a)は、包帯はさみ(b)のアイリスはさみ(C)骨骨鉗子(d)の薄いヘラ、ソフト(E)スカルペル番号11(F)鎌状スケーラー(G)シャーレやビーカーに合わせて-bristleペイントブラシ(H)プラスチックパスツールピペット(I)ろ紙(85ミリメートル)(J)ろ紙(30ミリメートル)(k)のガラスビーカー(L)アルミ冷却ブロック(m)をペトリ皿。(B)手動組織チョッパー。 (a)は、プラットフォーム(b)は、ブレードホルダー(C)バーニアマイクロメートル、解像度10ミクロンで腕を切断。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2電気生理学セットアップ(A)刺激剤からなるフィールドポテンシャルの記録のための(b)は、差動増幅器(c)は、アナログ-デジタル変換器(D)オシロスコープ(E)取得ソフトウェア(F)を有するコンピュータVibration-耐性テーブルトップ(G)> 4倍の倍率(H)インターフェイス脳スライスチャンバー(I)ACSFとカーボゲン供給のための潅流システム(J)温度コントローラ(k)は、照明源(L)電極ホルダーとマニピュレータと顕微鏡。 (B)インタフェース脳スライスガラスキャピラリーに封入されたインターフェースチャンバー内のチャンバー。(C)&(D)海馬スライス。(E)ステンレス鋼電極 。 この図の拡大版をご覧になるにはこちらをクリックしてください。
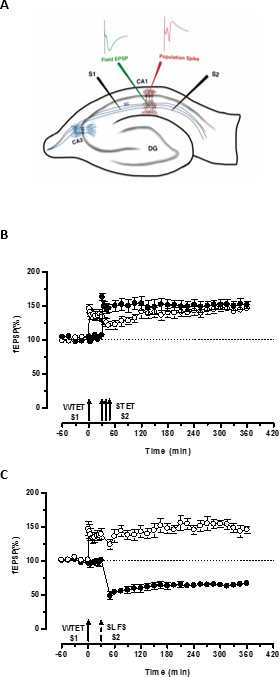
図3(A)フィールド電位記録用横断海馬スライスと電極位置の略図:この表現では、二つの刺激電極(S1及びS2)を刺激するためにCA1領域の放線状層中に配置された2つの独立したが、重複CA1錐体ニューロンへのシナプス入力。 2つの細胞外記録電極、頂端樹状コンパートメントからレコードフィールドEPSP(興奮シナプス後電位)に1と錐体細胞から体細胞集団のスパイクを記録するために別の体は、それぞれ放線層と層の三角骨に配置されています。 CA1-アンモン角領域1、CA3-アンモン角領域3、DG-歯状回、SC-シャファー側枝繊維、S1-刺激電極1、S2刺激電極2(B)弱いSTCを研究するための強力なパラダイムの前に:弱い強直誘発(WTET)は後期LTPを誘導するために30分でS2(黒丸)の強力な強直誘発(STET)に続く早期LTPを誘導するためのS1(白丸)に適用されます。 S1で初期LTPはタグ付けを示す後期LTPに強化され、クロスタグを研究するための強力なパラダイムの前に(N = 6)(C)弱相互作用をキャプチャします:早期LTPが続くS1(白丸)にWTETによって誘導されます30分後にSLFSを使用してS2の後半-LTDの誘導(黒丸)によります。 S1では、初期LTPは、クロスタグとキャプチャを示す6時間持続する後期LTPに変換された(n = 6)。シングル矢印は早期LTPを誘導するために適用される弱い強直誘発を表します。矢印のトリプレットを表します後期LTPを誘導するための強力な強直誘発。破線矢印はSLFSは後期LTDを誘導するための代表的なシナプスの入力に印加された時点を表します。エラーバーはSEMを示す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
急性海馬スライスは、LTPや、STC、クロスキャプチャなどの他の機能的可塑性のプロセスの研究のための優れたモデル系です。それは、海馬の回路の層構造のネットワークの多くを保存し、正確な電極位置を可能にし、血液脳関門なし、と並んで迅速な神経薬理学的操作のためのオープンプラットフォームを提供しています。
この記事では、若い成体ラットから実行可能な急性海馬スライスの調製のための方法論を説明し、STCとクロスタグ付けを調査するためにそれらを使用。これまでの研究は、性別や動物の年齢は電気生理学的研究で使用するために考慮すべき重要な因子であることを強調している。完全に表現成人受容体の機能(5-7週齢のWistar系雄性ラット)で27,28したがって、若い成体動物が使用されている。23非対称性左右の海馬との間の接続にげっ歯類29で指摘されており、NMDA受容体の発現に大きな違いがよく34として報告されています。私たちは以前のLTPの研究と一致するために、右海馬を使用している。23,32しかしながら、海馬のいずれかがあれば、整合性が維持されているとして使用することができます。
任意のプロトコルのように、それは、単離および組織が、伸び損傷し、乾燥または低酸素レンダリングされませんすぐに手続きをスライスするが世話を行うことが非常に重要です。 pH、温度および溶液のイオン組成の変化はスライスし、結果の実行可能性に大きな影響を持つことができます。したがって、このような変動は、避けるべきです。これは、製造工程中に発生するグルタミン酸受容体依存性カルシウム放出の不可逆的神経組織35,36、37でタンパク質合成に影響を与えることができることが観察されました。マニュアル組織スライサーを使用すると、VIと比較して非常に迅速に完了するためのプロセスを可能にすることにより、これを最小化するのを助けることができますbraslicers。しかし、多くの研究室にも効果的にスライスの生存率を維持するために必要な予防措置をvibraslicersを使用しています。考慮すべきもう一つの重要な要因は、実験を開始する前に、長い潜伏期間です。これは準備23時に発生する擾乱後のスライスにおける代謝状態およびキナーゼ活性化レベルの安定性を達成するために本当に重要であることが指摘されています。このような安定性は、長期的な録音の一貫性のために必要です。私たちは、この観察に再強調し、約3時間の長いインキュベーション時間を示唆しています。
刺激パラメータの様々なLTPを誘導することが知られているが、それぞれの場合に誘発される分子機構は(総説については38を参照)と同じでなくてもよいです。これは、順番に、シナプスタグおよび捕捉の実験の結果に影響を与えることができ、耐久性およびLTPの他の特性に影響を与えることができます。したがって、それは、刺激パラダイムと特性を検証することが重要です行う実験室の条件の下で誘発LTPのと一貫性を維持します。
我々は一般的に非常に大きなシナプス前繊維ボレーであり、最大0.5 mVの未満fEPSPsと録音も拒否されている間に繊維ボレーの大幅な変更を伴う実験で実験を考慮していません。さらに、二経路または三経路実験を実行しながら、その経路の独立性を確保することが重要です。これは、対のパルスの円滑プロトコル28を用いて行うことができます。
インターフェイス記録システムの一つの欠点は、チャンバーと周囲との温度と湿度の違いによる長時間録画時間中に電極上に凝縮液滴の形成です。これらの液滴は、慎重に時間から時間にブロットする必要があります。そうしないと液滴はスライス上に滴下し、乱れや信号のさえ喪失を引き起こす可能性があります。我々は通常、このBに取り組みますyが巧み電極に触れることなく、細い濾紙芯を用いて顕微鏡下で導かれた液滴をブロッティング。しかし、最善の解決策は、エジンバラ大学の研究者によって開発されたETCシステムとして、集中型の加熱システムを使用することです。
結びのノートでは、様々な方法論は、異なる実験の目的のために海馬スライスの調製のために使用され、世界中の研究室に存在します。手順のそれぞれは、他の上にいくつかの利点を提供しています。一つ注意深く実験の目的に適合するように、プロトコルの微細な詳細を最適化する必要があります。この記事は、STCやクロスキャプチャなど後期連想プロセスを研究するための方法論のいくつかの側面を改善するのに役立つことを願っています。
開示事項
このビデオの記事のためのオープンアクセスがCerebosパシフィック・リミテッドが主催しています。
謝辞
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
資料
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
参考文献
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved