Method Article
Investigación de sináptica Tagging / Captura y Cruz de captura utilizando aguda hipocampo rebanadas de Roedores
En este artículo
Resumen
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Resumen
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introducción
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocolo
Todos los animales procedimientos fueron aprobados por el Cuidado y Uso de Animales Comité Institucional (IACUC) de la Universidad Nacional de Singapur.
1. Preparación de líquido cefalorraquídeo artificial (ACSF)
- Preparar la ACSF que consiste en (en mM) 124 NaCl, 3,7 KCl, 1,0 MgSO 4 .7H 2 O, 2.5 CaCl 2 • 2H 2 O, 1.2 KH 2 PO 4, 24,6 NaHCO 3, y 10 D-glucosa. Asegúrese de que el pH de la ACSF está entre 7.2 hasta 7.4 cuando burbujeado a la saturación con 95% O 2 y 5% de mezcla de CO 2 (carbógeno). 21 Utilice esta ACSF tanto para la disección, rebanada preparación y para la perfusión durante las grabaciones electrofisiológicas.
NOTA: Utilice aparato limpia para la medición y la celebración de la ACSF. El uso de aparatos impuro puede conducir a soluciones turbias o formación de precipitados. Use agua desionizada durante todos los preparativos. - Preparar un 2 L 10x ACSF Stock excluyendo NaHCO3 y D-glucosa en un matraz volumétrico. Añadir los reactivos a agua desionizada en el orden siguiente: NaCl (144.96g), KCl (5,52 g), MgSO 4 .7H 2 0 (4,92 g), CaCl 2 • 2H 2 0 (7,56 g), KH 2 PO 4 (3,28 g) y la parte superior hasta un volumen de 2 L. Revuelva continuamente durante al menos 30 minutos utilizando un agitador magnético para asegurar que todos los reactivos se disuelven. Guarde el archivo en 4 o C y utilizar dentro de 2 semanas.
- Antes de la disección y los experimentos, se diluye el stock de ACSF en un matraz aforado junto con la adición de cantidades requeridas de NaHCO 3 y D-glucosa. Para una solución 1 L, diluir 100 ml de la acción a 1 L después de añadir 2,07 g de NaHCO3 y 1,802 g de D-glucosa. La ACSF debe ser una solución clara libre de cualquier precipitado o partículas sin disolver.
- Enfriar alrededor de 200-300 ml de ACSF en hielo, para ser utilizado durante la disección. Asegúrese de que la ACSF utilizada para la disección es de entre 2-4 ° C. Utilice la ACSF restante para electropexperimentos hysiological. Burbuja todas las soluciones ACSF a la saturación con carbógeno (5% de CO 2, 95% O 2) de forma continua. A la espera de la ACSF se enfríe, preparar el área de disección y la cámara de corte.
2. Preparación de la Cámara de interfaz
NOTA: Una cámara de corte interfaz cerebro, que se utiliza para la incubación de los cortes y el mantenimiento de ellos durante registros electrofisiológicos (Figura 2B), se compone de dos compartimentos. La cámara inferior contiene agua mantenida a 32 ° C destila por un controlador de temperatura y se burbujeó continuamente con carbógeno.
- Encienda el controlador de temperatura y preestablecido que a 32 ° C. Lave la cámara superior de 10 a 15 minutos mediante la ejecución de agua destilada a través de la tubería de entrada. Asegúrese de que la cámara superior está limpio antes de colocar la red. Compruebe que el nivel de agua en la cámara inferior es de aproximadamente 70% lleno de agua destilada.
- Coloca elneta en la cámara superior para proporcionar una superficie de descanso para las rebanadas (Figura 2C). Ajuste el tubo de flujo de salida para asegurar que el nivel de la solución está suficientemente mojando toda el área de la red. Coloque la tapa encima de la red para mantener un ambiente humidificado carbógeno dentro de la cámara superior.
- Ajustar la velocidad de flujo de 1 ml / min. Mantener esta velocidad de flujo a lo largo del período de incubación rebanada y el experimento. Comience carbogenating la ACSF 1x recién preparada y sumerja el tubo de entrada a la ACSF. Permita 20 minutos para el ACSF a saturarse con carbógeno y de la cámara superior para ser llenado con él.
3. Preparación de rodajas de hipocampo agudas
NOTA: El protocolo de disección consiste en (1) La eliminación del cerebro del animal en ACSF frío y (2) Aislamiento y corte en rodajas del hipocampo. A fin de que las neuronas que permanecen viables, aíslan y colocan cerebro en ACSF frío rápidamente y completar el conjuntoproceso que incluye cortar dentro de 3-5 min.
- La extracción del cerebro en ACSF fría
- Coloque las herramientas de disección de la manera mostrada en la Figura 1A. Organizar las herramientas de acuerdo con el orden de uso para facilitar el proceso de disección. Antes de empezar, asegúrese de que todas las herramientas de disección están listos.
- Montar una hoja de afeitar, limpiado con acetato de etilo, etanol absoluto y agua destilada, en el helicóptero de tejido manual (Figura 1B), asegure firmemente y asegúrese de que el borde de corte está alineada de manera uniforme. Prueba de cortar un trozo de papel de filtro para asegurar que la hoja está firmemente asegurado. Ajuste el deslizamiento Vernier micrómetro a su posición inicial.
- La eutanasia del animal utilizando dióxido de carbono (CO 2) en una cámara de inducción y decapitar con tijeras de vendaje o guillotina. Usando una tijera Iris, quitar la piel y de la piel por encima del cráneo. Haga un corte a través de la parte posterior para eliminar el brainstem.Make una pequeña incisión a lo largo ªe lado derecho del cráneo y una incisión más larga a la izquierda.
¡CUIDADO! Haga solamente una pequeña incisión en el lado que se utiliza para los experimentos para evitar dañarlo. Al insertar las tijeras, asegúrese de que la fuerza aplicada es hacia arriba para evitar daños en el cerebro. - Retirar con cuidado el cráneo con un hueso rongeur comenzando desde la izquierda hacia el lado derecho del cráneo para revelar la corteza. Una fina capa de duramadre también puede ser visto. Retire con cuidado las placas frontales con la gubia. Eliminar la mayor parte de la duramadre, junto con las placas frontales.
¡CUIDADO! Tenga cuidado de que la duramadre no cortar a través del tejido cerebral. - Retire la duramadre restante, en su caso, específicamente en la unión entre la corteza y el cerebelo con el extremo plano de una espátula. Para los pasos 3.1.5 y 3.1.6, es decir, mantener la presión hacia arriba, lejos del cerebro para evitar dañarlo. El uso de la espátula, cuchara suavemente el cerebro en una placa de Petri llena de frío y ACSF carbogenated (2-4 ° C), placed en un bloque de refrigeración de aluminio.
- Aislamiento del hipocampo
- El uso de un bisturí, hacer un corte recto para extirpar el cerebelo y otro corte para quitar la parte anterior del cerebro (aproximadamente un cuarto). Hacer un corte superficial a lo largo de la línea media.
- Retire cuidadosamente la corteza con una hoz, a partir de la línea media para revelar el hipocampo dorsal. Retire la capa de la corteza anterior del hipocampo. Utilice los dedos o pinzas en ángulo para apoyar el cerebro. Hacer un pequeño corte en la comisura del hipocampo. Retire con cuidado el hipocampo con la hoz partir de hipocampo dorsal utilizando movimientos ondulantes.
¡CUIDADO! Sea amable para evitar el estiramiento y desgarro del hipocampo. - Retire el córtex y los tejidos conectivos en todo el hipocampo aislada con la hoz.
- Cortando el tejido del hipocampo y la transferencia de las rebanadas sobre la cámara de interfaz
- Coloque un pedazo de ACSF-papel de filtro empapado (Grado 1, 30 mm) en la etapa de corte de la máquina de cortar manual. Cucharada y colocar el tejido del hipocampo en el papel de filtro. Mueva el papel de filtro para alinear el hipocampo en una orientación adecuada en relación con la hoja de la máquina de cortar de manera que el hipocampo se corta en un ángulo de alrededor de 70 o a la fimbria.
- Seque el exceso de solución que rodea el tejido del hipocampo con un papel de filtro plegado (Grado 1, 85 mm), dejando el hipocampo ligeramente húmedo. Comience cortando el hipocampo transversalmente. Slice y desechar el tejido desde el extremo del hipocampo, donde la morfología rebanada no está claro.
- Cortar el tejido restante en rodajas micras de espesor 400. Recoge rodajas de hipocampo suavemente de la hoja con un cepillo con cerdas suaves usando movimientos birlar suaves y coloque las rodajas en un pequeño vaso lleno de ACSF carbogenated frío. Realice los pasos 3.3.1-3.3.3 lo más rápidamente posible ya que el tejido del hipocampo se expone al aire.
NOTA: En general, las dos terceras partes del hipocampo se corta, y 4-6 rebanadas con morfología clara se pueden preparar. - Transfiera las rebanadas suavemente en la red en la cámara de corte con una pipeta Pasteur de plástico limpio con una punta ancha (hecho cortando 2-3 cm de la punta). Ajuste cuidadosamente la posición de los cortes en la red utilizando una pequeña jeringa con una punta doblada. Coloque las rodajas de una manera que facilite la localización del electrodo y la grabación. Compruebe que las rodajas están suficientemente rodeados por ACSF pero no están sumergidas o flotantes (Figura 2C-D). Cubra la cámara e incubar las rodajas de 2/3 h.
NOTA: La capa de células piramidales en los cortes sanos debe mostrar cierta transparencia.
4. Grabación de respuestas CA3-CA1 sinápticas
NOTA: La electrofisiología configuración utilizada para el campo de potencial de grabación se muestra en la Figura 2A. Un Faradías jaula se recomienda si la interferencia eléctrica está fuera del control después de la adecuada conexión a tierra de los ajustes eléctricos. Muchos tipos diferentes de cámaras sumergidas y de interfaz están disponibles comercialmente. Sin embargo, las cámaras de la interfaz se prefieren como rebanadas exhiben respuestas sinápticas más robustas en ellos.
- Posicionamiento de electrodos
- Encienda el aparato eléctrico (estimuladores y amplificadores) que se utilizarán. Montar y asegurar los electrodos de estimulación y registro de los titulares de plexiglás de los micromanipuladores.
NOTA: Utilizamos monopolar, laca recubiertos, electrodos de acero inoxidable de resistencia 5 mO tanto para fines de estimulación y registro. - Antes de usar, inserte estos electrodos dentro de los capilares de vidrio tirados y asegurar con pegamento epoxi exponer sólo una pequeña porción de la punta del electrodo (Figura 2E). Esto da fuerza a los electrodos de lo contrario esbeltas y ayuda a asegurar con firmeza en el eletitulares ctrode.
- Guiada bajo el microscopio, coloque el electrodo (s) estimulante en el estrato radiado de la región CA1 para estimular las fibras colaterales de Schaffer y el electrodo de registro en la región dendrítica apical de CA1 para grabar (fEPSP) las respuestas de campo-EPSP.
NOTA: Acercamiento de la superficie del líquido por encima de la rebanada con los electrodos da un sonido que ayuda a localizar rápidamente la superficie de la rebanada (proporcionado, el amplificador está conectado a un altavoz). - En marcado y captura experimentos sinápticas, de acuerdo con la necesidad del experimento, dos posiciones o tres electrodos de estimulación (S1, S2 o S3) a cada lado del electrodo de registro para estimular dos o más entradas independientes pero superpuestos. Coloque los estimulantes y grabación de electrodos a unos 200 m de distancia.
- Si es necesario, localizar otro electrodo de registro en la capa de estrato piramidal para la grabación de pico de población (Figura 3A) .Cuando tanto elelectrodos han tocado el corte, utilizando el software de adquisición, dará una estimulación de prueba para asegurar una señal fEPSP adecuada.
NOTA: Nosotros usamos, impulsos bifásicos de corriente constante (duración del impulso de 0,1 ms / de onda media) para la estimulación de prueba. - Una vez que se obtiene una señal fEPSP adecuada, cuidadosamente baje los electrodos unos 200 m de profundidad utilizando mandos de movimiento fino de los manipuladores. Permitir 20 min para las rodajas se recuperen. Pon a prueba la independencia vía con una facilitación del protocolo de dos pulsos 27,28.
- Encienda el aparato eléctrico (estimuladores y amplificadores) que se utilizarán. Montar y asegurar los electrodos de estimulación y registro de los titulares de plexiglás de los micromanipuladores.
- Relación insumo-producto
- Determinar la relación de entrada-salida (estimulación aferente vs pendiente fEPSP) para cada entrada mediante la medición del valor de la pendiente en un rango de intensidades de corriente. Realice este entre 20 mu de 100 mu. A continuación, establezca la intensidad de estimulación para cada entrada para obtener 40% de la pendiente máxima fEPSP. Mantener esta constante durante todo el experimento.
- Después de 15-20 minutos, comenzará a grabar la línea de base. Supervisar el fEPSP pendiente de cerca durante este período y restablecer la intensidad del estímulo si la pendiente fluctúa más del 10% del valor de ajuste y comenzar una nueva línea de base. Registro al menos 30 minutos o 1 hora inicial estable antes de continuar.
NOTA: Para la prueba o la estimulación basal, utilizamos cuatro barridos de 0,2 Hz bifásicos pulsos de corriente, constantes (0,1 mseg por polaridad) dados cada 5 minutos. Una inclinación de estas cuatro respuestas se considera entonces como una repetición. Las señales son filtradas y amplificadas por un amplificador diferencial, digitalizado utilizando un convertidor de analógico a digital y monitoreado en línea con el software hecho a medida.
- La inducción de LTP / LTD usando los protocolos de estimulación
NOTA: Tanto LTP y LTD han sido clasificados como temprano y tarde-LTP / LTD basado en los requisitos de la síntesis de proteínas; la traducción que requiere este último y / o transcripción de su difunto mantenimiento [de revisión ver 4]. Una variedad de paradigmas de estimulación eléctrica puede specifically inducen las diferentes formas de LTP y LTD.- WTET: 100 Hz, 21 pulsos bifásicos de corriente constante (0,2 mseg por fase).
- STET: Tres explosiones de 100 pulsos de un segundo (100 Hz) cada 10 minutos (Pulse ancho de 0,2 ms por fase).
- 900 ráfagas más de una duración 15 min. 1 explosión consta de 3 pulsos (0,2 ms de ancho) con un intervalo entre impulsos de 50 ms (20 Hz). El intervalo entre la explosión es de 1 seg (número total de pulsos 2.700).
5. Limpieza de la cámara de corte y sistema de perfusión
- Después de la grabación ha terminado, recoja las rodajas de hipocampo para su posterior análisis bioquímico o de lo deseche de manera apropiada. Cierre el suministro de carbógeno y controlador de temperatura. Lave el pelele carbógeno en agua destilada.
- Limpie la red a fondo con un cepillo y agua destilada. Lavar el equipo de perforación durante 15-20 min con agua destilada a una velocidad de flujo superior. Una vez en 3-4 días, cambiar el agua destilada en elcompartimento inferior de la cámara y también limpia la cámara regularmente con solución de peróxido de hidrógeno al 3% para evitar el crecimiento de hongos.
Resultados
La metodología descrita se ha utilizado para estudiar las formas de larga duración de LTP / LTD y sus interacciones asociativas tales como etiquetado sináptica y transversal de captura de cortes de hipocampo agudos de ratas adultas. 23 Esta técnica ha demostrado ser eficaz para los experimentos con ratas (Wistar) y una variedad de cepas de ratón 30,31. La metodología se ha utilizado con éxito para las grabaciones de LTP estables de hasta a 8-12 hr. 32
La 'etiqueta' establecido por el tetanization débil de una entrada (S1) captura la inducida por la fuerte tetanization de otra entrada independiente, sino que se superponen "PPR" (S2; Figura 3B, círculos rellenos) transformando la forma en descomposición de otra manera de la LTP (principios -LTP) en S1 en una de larga duración de un (Figura 3B, círculos abiertos) (Para la comparación de las primeras LTP inducida por WTET ver 20,33). Los PRP capturados por los débilesetiqueta de conjunto tetanization no necesariamente provienen de la inducida STET-tarde-LTP, pero también puede ser proporcionada por el inducido SLFS tarde-LTD. Este tipo de interacción asociativa positiva entre LTP y LTD se conoce como 'cross-tagging / captura ". La temprana-LTP inducida WTET en S1 se reforzó a finales del LTP (Figura 3C, círculos abiertos) mediante la captura de las PPR proporcionados por el inducido SLFS tarde-LTD en S2 (Figura 3C, círculos llenos). Estadísticamente potenciación o depresión significativa se mantuvo en S1 y S2 en ambos casos en comparación con su propia línea de base (prueba de Wilcoxon, p <0,05).
Para que se produzca la interacción-tag PRP, el orden temporal de los dos eventos (débil-fuerte antes de /-fuerte-débil antes) no es crucial siempre y cuando la ventana de tiempo entre los dos eventos se mantiene dentro del intervalo de 30-60 minutos. Sería conveniente incluir un tercero, independiente, pero la superposición sináptica enpuesto y lo utilizan como un control de la línea de base para monitorear la estabilidad de las grabaciones. Los protocolos de estimulación eléctrica utilizados para inducir formas temprana y tardía de LTP / LTD deben ser validados en experimentos de una sola entrada para la consistencia y fiabilidad antes de utilizarlos en experimentos STC. También nos gustaría hacer hincapié en la importancia de la metodología rebanada preparación se describe en el protocolo ya que el éxito de estos experimentos se basa en gran medida de la calidad de las lonchas.
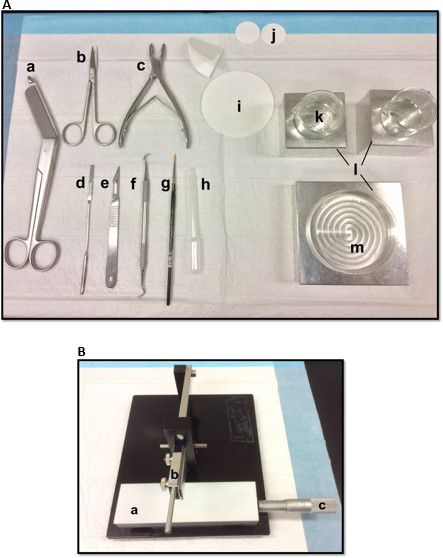
Figura 1. Herramientas (A) utilizados en la disección del hipocampo: (a) Vendaje Tijeras (b) Iris tijeras (c) gubia ósea (d) una espátula fina, (e) el número de bisturí 11 (f) hoz (g) Soft pincel -bristle (h) de plástico pipeta Pasteur (i) de papel de filtro (85 mm) (j) de papel de filtro (30 mm) (k) vasos de vidrio (l) bloques de refrigeración de aluminio para adaptarse placa de Petri y cubiletesplato (m) Petri. (B) cortador de tejidos manual. (a) Plataforma (b) corte el brazo con portacuchillas (c) Vernier micrómetro, la resolución de 10 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Electrofisiología configuración para la grabación de potencial del campo que consisten de estimuladores (A) (b) un amplificador diferencial (c) un convertidor analógico a digital (d) del osciloscopio (e) ordenador con software de adquisición (f) de vibraciones sobremesa resistentes (g) microscopio con> 4x magnificación (h) de la interfaz de cámara cerebro-slice (i) un sistema de perfusión para el regulador de temperatura ACSF y carbógeno alimentación (j) (k) una fuente de iluminación (l) manipuladores con los titulares de los electrodos. (B) Interfaz cerebro-slicecámara. (C) y (D) rodajas de hipocampo en la cámara de interfaz. electrodos de acero (E) de acero sellado en un capilar de vidrio. Haga clic aquí para ver una versión más grande de esta figura.
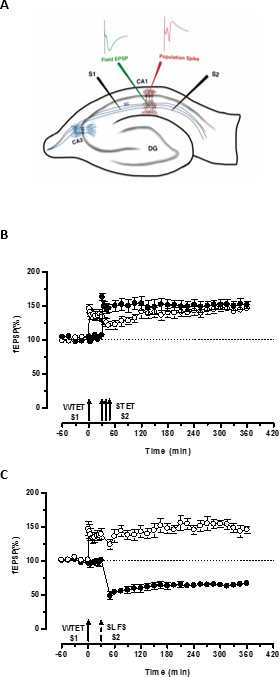
Figura 3. (A) Representación esquemática de una rebanada y el electrodo ubicación del hipocampo transversal para la grabación-potencial de campo: En esta representación, dos electrodos de estimulación (S1 y S2) se colocan en el stratum radiatum de la región CA1 para estimular dos independientes pero solapamiento entradas sinápticas neuronas piramidales CA1 Onto. Dos electrodos de registro extracelular, uno para grabar campo EPSP (potencial excitatorio postsináptico) del compartimiento dendrítico apical y otra para grabar somática pico de población de la célula piramidalcuerpos, se encuentran en el estrato radiatum y estrato piramidal respectivamente. CA1- cornu ammonis región 1, CA3- cornu ammonis región 3, giro dentado DG-fibras colaterales SC- Schaffer, S1-estimulante electrodo 1, electrodo S2 estimulante 2. (B) Débil antes fuerte paradigma para estudiar STC: tetanization Débil (WTET) se aplica a S1 (círculos abiertos) para la inducción de LTP temprana seguida de tetanization fuerte (STET) de S2 (círculos rellenos) en 30 min para inducir la tarde-LTP. La temprana-LTP en S1 se reforzó a finales del LTP mostrando etiquetado y capturar la interacción (n = 6) (C) Débil antes fuerte paradigma para estudiar cruz-etiquetado:. Temprano-LTP es inducida por WTET en S1 (círculos abiertos), seguido por la inducción de la tarde-LTD en S2 (círculos rellenos) utilizando SLFS después de 30 minutos. En S1, a principios-LTP se transforma en tarde-LTP duración de 6 horas mostrando cruz-etiquetado y captura (n = 6). Flecha individual representa tetanization débil aplicada para la inducción temprana-LTP. Triplete de flechas representafuerte tetanization para inducir tarde-LTP. La flecha discontinua representa el punto de tiempo en el que SLFS se aplica a la entrada sináptica representante para inducir la tarde-LTD. Las barras de error indican SEM. Por favor haga clic aquí para ver una versión más grande de esta figura.
Discusión
Corte de hipocampo aguda es un excelente sistema modelo para el estudio de LTP y otros procesos de plasticidad funcionales tales como STC y transversal de captura. Se conserva gran parte de la red estructural laminar de los circuitos del hipocampo, permite localizaciones de los electrodos precisos y ofrece al lado, una plataforma abierta para la rápida manipulación neurofarmacológico sin una barrera sangre-cerebro.
En este artículo se describe la metodología para la preparación de cortes de hipocampo agudas viables de ratas adultas jóvenes y utilizarlos para investigar STC y cross-tagging. Investigaciones anteriores han hecho hincapié en que el género y la edad de los animales son factores importantes a considerar para su uso en estudios de electrofisiología. Se utilizan 27,28 animales adultos tanto jóvenes con las funciones de los receptores adultos plenamente expresadas (ratas Wistar machos de entre 5-7 semanas). 23 Asimetrías en las conexiones entre el hipocampo izquierdo y derecho se han observado en los roedores y 29principales diferencias en la expresión del receptor de NMDA han sido reportados como bien 34. Hemos utilizado el hipocampo derecho con el fin de ser coherente con nuestros estudios anteriores LTP. 23,32 Sin embargo, ninguno de los hipocampos se puede utilizar siempre y cuando se mantenga la coherencia.
Como en cualquier protocolo, es muy importante para llevar a cabo el aislamiento y cortar procedimientos rápidamente, pero teniendo cuidado de que el tejido no se estira, dañado, rindió seco o hipóxica. Las variaciones en el pH, la temperatura y la composición iónica de las soluciones pueden tener un efecto profundo sobre la viabilidad de las rebanadas y los resultados. Por lo tanto tales variaciones deben ser evitados. Se ha observado que la liberación de calcio dependiente del receptor de glutamato que ocurren durante las etapas de preparación puede afectar irreversiblemente la síntesis de proteínas en el tejido nervioso 35,36, 37. El uso de máquinas de cortar tejidos manuales puede ayudar a minimizar este al permitir que el proceso se complete muy rápidamente en comparación con vibraslicers. Sin embargo, muchos laboratorios también utilizan efectivamente vibraslicers con las precauciones necesarias para preservar la viabilidad de la rebanada. Otro factor importante a considerar es el largo período de incubación antes de comenzar los experimentos. Esto se ha observado que es realmente crucial para lograr la estabilidad en los niveles estatales y activación quinasa metabólicos en las rebanadas después de la perturbación causada durante la preparación 23. Dicha estabilidad es necesaria para mantener la coherencia en las grabaciones de larga duración. Nos re-enfatizar en esta observación y sugerimos las largas horas de incubación de alrededor de 3 horas.
Una variedad de parámetros de estimulación son conocidos para inducir LTP, pero los mecanismos moleculares provocados en cada caso puede no ser el mismo (para revisión ver 38). Esto puede influir en la durabilidad y otras características de la LTP, que, a su vez, pueden afectar los resultados de marcado y captura experimentos sinápticas. Por lo tanto es importante validar los paradigmas y las características de estimulacióndel suscitó LTP en las condiciones del laboratorio que realice y mantener la consistencia.
Por lo general, no consideramos experimentos con grandes salvas de fibras presinápticas y con fEPSPs máximas de menos de 0,5 mV y los experimentos que implican cambios sustanciales en la volea de fibra durante las grabaciones también se rechazan. Además, aunque la realización de la vía de dos o tres experimentos de la vía, es importante para garantizar la independencia vía. Esto puede llevarse a cabo con un protocolo de facilitación dos pulsos 28.
Una desventaja de los sistemas de grabación de interfaz es la formación de gotas de condensación en los electrodos durante las horas de grabación largos debido a las diferencias de temperatura y humedad entre la cámara y los alrededores. Estas gotitas deben ser cuidadosamente borrado de vez en cuando. De lo contrario, las gotitas pueden gotear sobre las rebanadas y causar perturbación o incluso la pérdida de señales. Por lo general, abordamos este by secante hábilmente las gotitas guiadas bajo el microscopio utilizando una delgada mecha de papel de filtro, sin tocar los electrodos. Sin embargo, la mejor solución sería utilizar un sistema de calefacción centralizada, tal como el sistema ETC desarrollado por la Universidad de Edimburgo investigadores.
En una nota final, existe una variedad de metodologías en los laboratorios de todo el mundo que se utilizan para la preparación de cortes de hipocampo para diferentes propósitos experimentales. Cada uno de los procedimiento ofrece algunas ventajas sobre el otro. Uno tiene que optimizar cuidadosamente los detalles minuciosos de el protocolo para adaptarse a la finalidad del experimento. Esperamos que este artículo le ayuda en la mejora de algunos aspectos de la metodología para el estudio de los procesos asociativos tardías como STC y transversal de captura.
Divulgaciones
El acceso abierto para este artículo de vídeo es patrocinado por Cerebos Pacific Limited.
Agradecimientos
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materiales
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Referencias
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados