Method Article
Kemirgenler gelen akut Hipokampal Dilimleri kullanarak Synaptic Etiketleme / yakalama ve Çapraz yakalama İncelenmesi
Bu Makalede
Özet
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Özet
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Giriş
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protokol
Bütün hayvan prosedürleri Singapur Ulusal Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
Yapay Beyin Omurilik Sıvısı 1. Hazırlama (ACSF)
- , 124 NaCl, 3.7 KCl (mM olarak) MgSO 4 .7H 2 O 1,0, 2,5 CaCl2 .2H 2 O'dan oluşan ACSF, 1,2 KH 2 PO 4, 24.6 NaHCO 3 ve 10 D-glikoz hazırlayın. Elektrofizyolojik kayıtlar sırasında% 95 O 2 ve% 5 CO 2 karışımı (karbojen). Her iki diseksiyonu, dilim hazırlanması için 21 kullanın, bu ACSF ve perfüzyon ile doygunluk kabarmış zaman ACSF pH 7.2-7.4 arasında olduğundan emin olun.
NOT: ölçme ve ACSF tutmak için temiz cihazı kullanın. Kirli cihaz kullanılarak parçalı çözeltiler ya da çökeltiler oluşumuna neden olabilir. Tüm hazırlıkları için deiyonize su kullanın. - NaHCO 3 hariç 2 L 10x ACSF stok hazırlayın ve volümetrik bir şişede, D-Glukoz. Aşağıdaki sırayla deiyonize suya reaktif ekleyin: NaCl (144.96g), KCl (5.52g), MgSO 4 .7H 2 0 (4.92g), CaCl2 .2H 2 0 (7.56 g), KH 2 PO 4 (3.28 2 L'lik bir hacme kadar g) ve üst kadar olan tüm reaktifler çözündürülür sağlamak için, bir manyetik karıştırıcı kullanılarak, en az 30 dakika süreyle sürekli olarak karıştırılır. 4 o C stok saklayın ve 2 hafta içinde kullanın.
- Diseksiyon ve deneyleri öncesinde NaHCO 3 ve D-glikozun gerekli miktarlarının ilave edilmesi ile birlikte, bir hacimli şişe içinde ACSF stokları seyreltin. 1 L çözelti için 2.07 g NaHCO 3 ve 1,802 g D-glikoz eklemeden sonra, 1 L stoklar 100 ml seyreltilir. ACSF bir çökelti ve çözünmemiş partiküllerin serbest berrak bir çözelti olması gerekir.
- Serin yaklaşık 200-300 ml buz üzerinde ACSF, diseksiyon sırasında kullanılacak. Diseksiyon için kullanılan ACSF 2-4 ° C arasında olduğundan emin olun. Electrop kalan ACSF kullanınhysiological deneyler. Kabarcık tüm solüsyonlar sürekli olarak ACSF karbojen (% 5 CO2,% 95 O 2) doyurma. ACSF soğumasını beklerken, diseksiyon alanı ve dilim odasını hazırlar.
Arayüz Odası 2. Hazırlık
NOT: Bir arabirim beyin dilim odası, (Şekil 2B) dilimleri kuluçkaya ve elektrofizyolojik kayıtlar sırasında onları korumak için kullanılan, iki bölmeden oluşmaktadır. Alt bölme, bir sıcaklık kontrol cihazı tarafından 32 ° C 'de muhafaza damıtılmış su sürekli karbojen kabarcıkları içerir.
- Sıcaklık kontrolörü açın ve 32 ° C'de bunu önceden. Akış boru boyunca damıtık su geçirilerek 10 ila 15 dakika için, üst bölme yıkayın. Üst kamara net yerleştirmeden önce temiz olduğundan emin olun. Alt bölmesi içindeki su seviyesi, distile su ile doldurulmuş 70% olduğu edin.
- YeriÜst bölme net dilimleri için bir dinlenme yüzeyi (Şekil 2C) elde edildi. Çözelti düzeyi yeterince net tüm alanı ıslatma emin olmak için çıkış hortumunu ayarlayın. Üst bölme içinde nemlendirilmiş karbojen atmosferini korumak için filenin üzerinde kapağı yerleştirin.
- 1 ml / dakika akış hızı ayarlanır. Dilim kuluçka dönemi ve deney boyunca bu akış hızını sürdürmek. Taze hazırlanmış 1x ACSF carbogenating başlayın ve ACSF içine giriş hortumunu batırmayın. ACSF bununla doldurulması için karbojen ve üst bölmesi için doymuş için 20 dakika bekleyin.
Akut Hipokampal Dilimleri 3. Hazırlık
NOT: Diseksiyon protokolü soğuk ACSF ve (2) İzolasyon ve hipokampus dilimleme içine hayvana beyin (1) Temizleme oluşur. Nöronlar, canlı kalır izole etmek ve hızlı bir şekilde soğuk ACSF beyin koyun ve bütün tamamlamak için sırayla3-5 dakika içinde dilimleme dahil süreci.
- Soğuk ACSF içine beynin çıkarılması
- Şekil 1A gösterilen şekilde diseksiyon araçlarını yatıyordu. Diseksiyon sürecini kolaylaştırmak için kullanım sırasına göre araçları düzenleyin. Başlamadan önce, tüm diseksiyon araçları hazır olun.
- , Etil asetat, etanol ve distile mutlak su ile temizlenmelidir bir jileti, monte manuel doku kıyıcı (Şekil 1B) üzerine, sıkıca sabitlemek ve kesme kenarı eşit hizada olduğundan emin olun. Filtre bir parça kağıt doğrama test bıçağı sıkıca güvenli olduğundan emin olmak için. Başlangıç pozisyonuna kayar Vernier mikrometre ayarlayın.
- Indüksiyon odasında hayvan kullanılarak karbondioksit (CO 2) Euthanize ve bandaj makas veya Giyotin ile başını kesmek. Bir İris makas kullanarak, kafatası üzerinde cilt ve kürk çıkarın. Brainstem.Make th boyunca küçük bir kesi kaldırmak için arka aracılığıyla bir kesim yapmakKafatasının sağ tarafını ve sol tarafta daha uzun bir kesi e.
DİKKAT! Hasar görmesini önlemek için deneyler için kullanılan yanına sadece küçük bir kesi yapmak. Makas takarken, uygulanan kuvvet beyne zarar görmesini önlemek için yukarı doğru olduğundan emin olun. - Dikkatle korteksi ortaya çıkarmak için kafatasının sağ tarafına soldan başlayarak rongeur bir kemik kafatası çıkarın. Dura ince bir tabaka, aynı zamanda görülebilir. Dikkatle rongeur ile frontal plakaları çıkarın. Frontal plakalar ile birlikte dura en çıkartın.
DİKKAT! Dura beyin dokusu aracılığıyla dilim olmadığı dikkatli olun. - Özellikle bir spatula düz ucuyla korteks ve serebellumda arasındaki eklem, eğer varsa kalan dura çıkarın. Adımlar 3.1.5 ve 3.1.6 için bu zarar vermemek için beyin uzak, yukarı doğru, yani basıncı korumak. Spatula kullanarak, yavaşça soğuk carbogenated ACSF (2-4 ° C) ile doldurulmuş bir petri çanağı, pla halinde beyin kepçebir alüminyum soğutma bloğuna CED.
- Hipokampüsün izolasyonu
- Bir neşter kullanılarak, düz bir kesim beyin (yaklaşık dörtte biri) ön kısmını kaldırmak için serebellum ve başka kesim kaldırmak için yapmak. Orta hat boyunca sığ bir kesim olun.
- Dikkatle dorsal hipokampus ortaya çıkarmak için orta hat başlayarak, bir orak Ölçekleyicili korteks kaldırmak. Hipokamp Yukarıdaki korteksin tabakayı çıkarın. Beyin desteklemek için parmaklarınızı veya açılı forseps kullanın. Hipokampal komissür küçük bir kesim olun. Yavaşça haddeleme hareketlerini kullanarak dorsal hipokampusun itibaren orak Ölçekleyicili hipokampus çıkarın.
DİKKAT! Germe ve hipokampus yırtılmasını önlemek için nazik olun. - Orak Ölçekleyicili izole hipokampus etrafında herhangi bir korteks ve bağ dokuları çıkarın.
- Hipokampal doku dilimleme ve arayüz odasının üzerine dilim aktarılması
- ACSF- bir parça koyunmanuel dilimleme makinesi dilimleme aşamasında ıslatılmış filtre kağıdı (Grade 1, 30 mm). Kepçe ve filtre kağıdı üzerine hipokampal doku yerleştirin. Hipokamp yaklaşık 70 o fimbriya arasında bir açıyla kesilmiştir, böylece kesici bıçak ile ilgili olarak uygun bir oryantasyonda hipokampus hizalamak için filtre kağıdı getirin.
- Katlanmış filtre kağıdı ile hipokampal doku (Grade 1, 85 mm) hafif ıslak hipokampus bırakarak çevreleyen aşırı çözüm kurulayın. Enine hipokampus dilimleme başlayın. Dilim morfolojisi net olmadığı durumlarda Dilim hipokampus aşırı ucundan doku atmak ve.
- 400 mikron kalınlığında dilimler halinde kalan doku dilimleyin. Nazik swiping hareketlerini kullanarak yumuşak kıllı bir fırça ile bıçak hafifçe hipokampal dilim Pick up ve soğuk carbogenated ACSF dolu küçük bir behere dilimleri yerleştirin. Adımları gerçekleştirin 3.3.1-3.3.3 mümkün olduğunca çabuk hipokampal doku havaya maruz beri.
NOT: Genellikle hipokampus üçte ikisinin dilimlenmiş ve net morfolojisi ile 4-6 dilim hazırlanabilir. - Yavaşça (ucu 2-3 cm uzağa keserek yapılan) geniş uçlu temiz bir plastik Pasteur pipeti kullanarak dilim odasında net üzerine dilimleri aktarın. Dikkatle bükülmüş ucu ile küçük bir şırınga kullanarak net dilim konumunu ayarlamak. Elektrot konumu ve kayıt kolaylaştıran bir şekilde dilimleri yerleştirin. Dilim yeterince ACSF çevrili ama batık ya da (Şekil 2C-D) yüzer olmadığını kontrol ediniz. Odasına örtün ve 2-3 saat süreyle dilimleri kuluçkaya yatmaktadır.
NOT: Sağlıklı dilimler halinde piramidal hücre tabakası, bazı şeffaflık göstermesi gerekir.
CA3-CA1 Synaptic Cevaplarının 4. Kayıt
NOT: Alan potansiyel kayıt için kullanılan elektrofizyoloji set-up Şekil 2A gösterilmiştir. Bir Faraelektriksel girişim elektrik ayarları düzgün topraklama sonra kontrolü dışında ise günlük kafes şiddetle tavsiye edilir. Daldırılmış ve arayüz odaları çok farklı tipte ticari olarak temin edilebilir. Ancak, arabirim odaları onları dilim sergi daha sağlam sinaptik yanıtları olarak tercih edilmektedir.
- Elektrotların Konumlandırma
- Elektrikli cihazlar açın (uyarıcıları ve amplifikatörler) kullanılacak. Dağı ve mikromanipülatörler pleksiglas tutuculara uyarıcı ve kayıt elektrotları sabitleyin.
NOT: monopolar, hem uyarıcı ve kayıt amaçlı 5 M? Direnci lake kaplı paslanmaz çelik elektrotlar kullanın. - Kullanmadan önce, çekti cam kılcal damarların içinde bu elektrotlar eklemek ve epoksi tutkal elektrot ucu (Şekil 2E) yalnızca küçük bir kısmını açığa sabitleyin. Bu başka türlü ince elektrotlar kuvvet verir ve Elektronik endüstri sıkıca onları korumak için yardımcı olurctrode sahipleri.
- Mikroskop altında Güdümlü, alan EPSP (fEPSP) yanıtları kaydetmek için CA1 apikal dendritik bölgesinde Schaffer teminat lifleri ve kayıt elektrot uyarmak için CA1 bölgenin stratum radiatum uyarıcı elektrot (lar) yerleştirin.
NOT: elektrotlar ile dilim üzerinde sıvı yüzey yaklaşırken hızla dilim (sağlanan amplifikatör bir hoparlöre bağlanır) yüzeyini bulmak için yardımcı olan bir ses verir. - Sinaptik etiketleme ve yakalama deneylerinde, deney ihtiyaca göre, kayıt elektrot her iki tarafında pozisyonu, iki veya üç uyarıcı elektrotlar (S1, S2 veya S3), iki ya da daha çok bağımsız, fakat üst üste giriş uyarmak için. Ayrı 200 mikron ilgili uyarıcı ve kayıt elektrotları yerleştirin.
- Gerekirse, popülasyon artışı (Şekil 3A) kayıt için startum pyramidale tabakasında bir kayıt elektrot bulmak tutulduktan ikielektrotlar elde etme yazılımı kullanarak, dilim dokundu, düzgün bir fEPSP sinyalini sağlamak için bir test uyarımı verin.
NOT: Test uyarılması için bifazik, sabit akım darbelerini (darbe süresi 0,1 ms / yarım dalga) kullanın. - Uygun bir fEPSP sinyali elde edildikten sonra, dikkatlice derin manipülatör şık hareketlerden düğmeleri kullanarak 200 mikron hakkında elektrotlar indirin. Dilim kurtarmak için 20 dakika bekleyin. Eşleştirilmiş darbe kolaylaştırma protokolü 27,28 ile yolu bağımsızlığını sınayın.
- Elektrikli cihazlar açın (uyarıcıları ve amplifikatörler) kullanılacak. Dağı ve mikromanipülatörler pleksiglas tutuculara uyarıcı ve kayıt elektrotları sabitleyin.
- Girdi-çıktı ilişkisi
- Geçerli şiddetlerinin aralığında eğim değerini ölçerek her giriş için giriş-çıkış ilişkisini (fEPSP yamaç vs afferent stimülasyon) belirleyin. 100 uA 20 uA arasındaki bu gerçekleştirin. Sonra maksimum fEPSP yamaç% 40 elde etmek için her giriş için stimülasyon yoğunluğu ayarlayın. Deney boyunca bu sabit tutun.
- 15-20 dakika sonra, taban çizgisini kaydetmeye başlamak. F MonitörEPSP bu dönemde yakından eğim ve eğim ayar değerinden% 10'dan fazla dalgalanma olursa uyaran yoğunluğunu sıfırlamak ve yeni bir temel başlatın. Devam etmeden önce Tutanak, en az 30 dakika ya da 1 saat stabil bazal.
NOT: Eğer test ya da bazal stimülasyon için, her 5 dakikada bir verilen 0.2 Hz bifazik, sabit akım darbelerinin dört temizleyicileri (kutupluluk başına 0,1 msn) kullanın. Bu dört yanıtın bir ortalama eğim sonra bir tekrar olarak kabul edilir. Sinyallerini bir analog-dijital dönüştürücü kullanarak dijitalize ve ısmarlama yazılım ile online olarak izlenmektedir bir diferansiyel amplifikatör tarafından filtre edilmiş ve amplifiye edilir.
- LTP / LTD İndüksiyon uyarılması protokollerini kullanarak
NOT: LTP ve LTD Hem erken sınıflandırılmış edilmiş ve protein sentezi gereklerine dayalı geç LTP / LTD; onun geç bakım için ikincisi gerektiren çeviri ve / veya transkripsiyon [incelenmek üzere 4 görmek]. Elektriksel stimülasyon paradigmalar çeşitli specificall edebilirsinizy LTP ve LTD farklı şekillerde neden.- WTET: 100 Hz, 21 bifazik sabit akım darbeleri (faz başına 0.2 milisaniye).
- STET: bir saniyede (100 Hz) her 10 dakikada (faz başına genişliği 0.2 msn'den Darbe) 100 darbeleri Üç patlamaları.
- 15 dk süresi boyunca 900 patlamaları. 1 çoğuşma 50 ms (20 Hz) bir ara dalga zaman aralığı ile 3 darbe (0,2 msn genişlik) oluşur. Arası patlama aralığı 1 sn (bakliyat 2700 sayısı) 'dir.
Dilim Odası ve Perfüzyon Sistemi 5. Temizlik
- Kayıt bittikten sonra, daha ileri biyokimyasal analiz için hipokampal dilim toplamak veya başka uygun atın. Karbojen arz ve sıcaklık kontrolörü kapatın. Damıtılmış su içinde karbojen bubbler yıkayın.
- Bir fırça ve distile su ile iyice net temizleyin. Daha yüksek bir akış oranında damıtılmış su ile 15-20 dakika boyunca teçhizat yıkayın. 3-4 günde bir, damıtılmış su değiştirmekAlt bölmenin bölmesi ve% 3 hidrojen peroksit çözeltisi ile oda düzenli da temiz mantar gelişimini önlemek için.
Sonuçlar
Açıklanan metodoloji (Wistar). Bu tür yetişkin farelerin akut hipokampal dilim sinaptik etiketleme ve çapraz yakalama olarak LTP / LTD ve ilişkisel etkileşimlerin uzun süreli formları incelemek için kullanılır olmuştur 23 Bu teknik, hem fareler ile deneyler için etkili olduğu kanıtlanmıştır ve fare çeşitli 30,31 suşları. Metodoloji kadar 8-12 saat istikrarlı LTP kayıtları için başarıyla kullanılmaktadır. 32
Erken LTP (Şekil 3B, dolu daireler S2) ve böylece dönüşüm aksi çürüyen formu (tek giriş (S1) zayıf tetanization tarafından belirlenen 'etiketi' PRPS 'Başka bağımsız ancak örtüşen girdi güçlü tetanization tarafından uyarılan yakalar uzun süreli bir bir (Şekil 3B, açık daireler) içine S1 -LTP) (WTET ile indüklenen erken LTP karşılaştırmak için) 20,33 bkz. Zayıf tarafından yakalanan PRPstetanization grubu etiketi mutlaka STET neden olduğu geç-LTP gelen gerek yoktur, ancak, aynı zamanda ÖİDÖ neden olduğu geç-LTD tarafından sağlanabilir. LTP ve LTD arasındaki olumlu etkileşimin birleştirici Bu tür 'cross-etiketleme / yakalama "olarak adlandırılır. S1 WTET kaynaklı erken LTP S2 ÖİDÖ kaynaklı geç LTD tarafından sağlanan PRPS (Şekil 3C, dolu daireler) yakalayarak geç LTP (Şekil 3C, açık daireler) ile takviye olur. Kendi baz ile karşılaştırıldığında istatistiksel olarak anlamlı kuvvetlenmesi ve depresyon her iki durumda da S1 ve S2 muhafaza edildi (Wilcoxon testi, p <0.05).
Etiket PRP etkileşim oluşması için (zayıf-öncesi güçlü / strong-öncesi zayıf) iki olay arasındaki zaman penceresi 30-60 aralığında kaldığı sürece, iki olayın zamansal sırası sürece çok önemli değil dakika. Bu bir üçüncü bağımsız ama örtüşen sinaptik eklemek akıllıca olacaktırkoymak ve kayıtların istikrarı izlemek için bir temel kontrolü olarak kullanabilirsiniz. LTP / LTD Erken ve geç formları ikna etmek için kullanılan elektriksel stimülasyon protokolleri STC deneylerde kullanmadan önce tutarlılık ve güvenilirlik için tek giriş deneylerinde doğrulanması gerekir. Biz de bu deneylerin başarı dilimleri kalitesine dayanır çünkü protokol açıklanan dilim hazırlık metodolojisi önemini vurgulamak isterim.
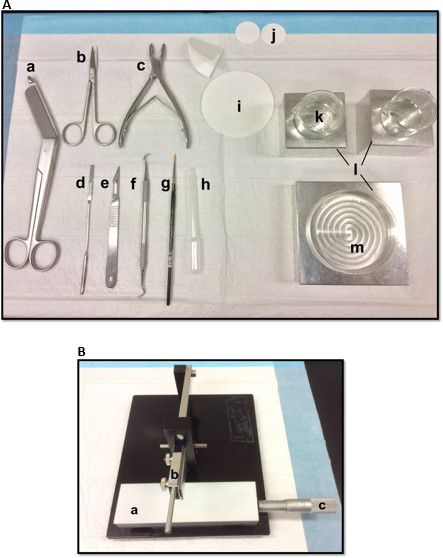
Hipokampus diseksiyonu kullanılan Şekil 1. (A) Araçlar: (a) Bandaj makasları (b) İris makaslar (c) Kemik rongeur (d) İnce spatula, Yumuşak (e) Neşter sayısı 11 (f) Orak ölçekleyici (g) -bristle boya fırçası (h) Plastik Pasteur pipeti (i) filtre kağıdı (85mm) (j) filtre kağıdı (30mm) (k) petri ve beher sığdırmak için Cam bardak (l) Alüminyum soğutma blokları(m) Petri kabı. (B) Manuel doku kıyıcı. (a) Platform (b) bıçak tutucu (c) Sürmeli mikrometre, çözünürlük 10 mikron ile kol kesme. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2. Elektrofizyoloji kurulumu (A) aşağıdakilerden oluşan uyarıcıları alan potansiyeli kayıtlarında (b), bir diferansiyel yükselteç (c) bir analog-dijital dönüştürücü (d) Osiloskop (e) toplama yazılımı (f) bilgisayar titreşim dayanıklı masa üstü elektrot tutucular> 4x büyütme (h) arayüzü beyin dilim odası (i) ACSF ve karbojen kaynağı (j) sıcaklık kontrolörü (k) için bir perfüzyon sistemi bir aydınlatma kaynağı (l) manipulatör (g) mikroskop. (B) Arayüz beyin dilimodacık. (C) (D) arayüz odasında hipokampal dilimler cam kılcal imzalandı. (E) Paslanmaz çelik elektrot. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
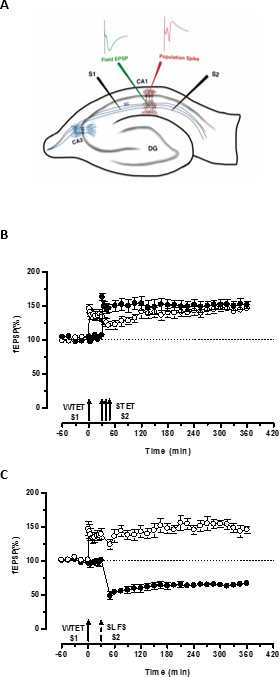
Şekil 3. (A) alanı potansiyeli kayıt için bir enine hipokampal kesit ve elektrot konumu şematik gösterimi: Bu gösterimde, iki uyarıcı elektrotlar (S1 ve S2) uyarmak için CA1 bölgesinde in stratum radiatumunun merkezi içinde yerleştirilmiş iki bağımsız fakat birbiriyle örtüşen CA1 piramidal nöronlar üzerine sinaptik girdiler. İki hücre dışı kayıt elektrotları, tek apikal dendritik bölmeden alan EPSP (eksitatör post-sinaptik potansiyel) kaydetmek ve başka piramidal hücreden somatik nüfus başak kaydetmek içinorganları sırasıyla stratum radiatum ve stratum pyramidale yer almaktadır. CA1- cornu ammonis bölgesi 1, CA3- cornu ammonis bölge 3, DG- dentat girus, SC- Schaffer teminat lifleri, S1- uyarıcı elektrot 1, S2-uyarıcı elektrot 2. (B) Zayıf STC incelemek için güçlü paradigma öncesi: Zayıf tetanization (WTET) geç-LTP indüklemek için 30 dk S2 güçlü tetanization (STET) (doldurulmuş daireler), ardından erken LTP indüklemek için (içi boş daireler) S1 uygulanır. S1 erken-LTP etiketleme gösteren geç LTP takviyeli ve çapraz etiketleme incelemek için güçlü paradigma öncesi (n = 6) (C) Zayıf etkileşim yakalama alır. Erken LTP takip S1 (açık daireler) içinde WTET tarafından uyarılan 30 dakika sonra ÖİDÖ kullanılarak S2 geç LTD indüksiyonu (içi dolu daireler). S1, erken LTP çapraz-tagging ve yakalama gösteren 6 saat süren geç LTP dönüştürülür (n = 6). Tek ok erken LTP indüklemek için uygulanan zayıf tetanization temsil eder. Okların Üçüz temsilGeç-LTP indüklemek için güçlü bir tetanization. Kırık ok ÖİDÖ geç LTD indüklemek için temsili sinaptik girişine tatbik edildiği zaman noktasını temsil eder. Hata çubukları SEM gösteriyor. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Akut hipokampal dilim LTP ve STC ve çapraz yakalama gibi diğer fonksiyonel plastisite süreçlerinin çalışma için mükemmel bir model sistemidir. Bu hipokampal devrelerin laminer yapısal ağının çok hassas elektrot konumları izin verir ve bir kan-beyin bariyeri olmadan, yanında hızlı nörofarmakolojik manipülasyon için açık bir platform sunuyor korur.
Bu makalede, genç yetişkin sıçanlardan uygulanabilir akut hipokampal dilim hazırlanması için bir metodoloji tarif eder ve STC ve çapraz etiketleme araştırmak için kullanılması. Önceki araştırmalar hayvanların cinsiyet ve yaş elektrofizyoloji çalışmalarında kullanılmak üzere düşünülmesi gereken önemli faktörlerdir vurguladı. Tam olarak ifade yetişkin reseptör fonksiyonları (5-7 hafta arası erkek Wistar sıçan) ile 27,28 nedenle genç erişkin hayvanların kullanılmaktadır. 23 asimetriler Sağ ve sol hipokampus arasındaki bağlantılarda kemirgenler 29 not edilmiş veNMDA reseptör ifadesinde önemli farklılıklar oyuk 34 olarak rapor edilmiştir. Biz, ancak. Önceki LTP çalışmalar ile uyumlu olması için 23,32 doğru hipokampus kullanmış hipokampi biri sürece kıvamlılık muhafaza edilir olarak kullanılabilir.
Herhangi bir protokolde olduğu gibi, tecrit ve doku, gergin hasarlı, kuru veya hipoksik hale değil hızlı prosedürleri dilimleme ama özen gerçekleştirmek için çok önemlidir. PH, sıcaklık ve çözeltilerinin iyonik bileşim içinde varyasyonlar dilimleri ve sonuçların canlılığı üzerinde derin bir etkiye sahip olabilir. Bu nedenle bu tür varyasyonlar kaçınılmalıdır. Bu hazırlık adımları sırasında oluşan glutamat reseptör-bağımlı kalsiyum salma tersinmez sinir dokusunda 35,36, 37 protein sentezini etkileyebilir gözlenmiştir. Manuel doku dilimleme kullanma vi kıyasla çok hızlı bir şekilde tamamlanması süreci izin vererek bu en aza indirmek için yardımcı olabilirbraslicers. Ancak, birçok laboratuvarlar da etkili bir dilim canlılığını korumak için gerekli önlemler ile vibraslicers kullanın. Dikkate diğer önemli faktör deneyler başlamadan önce uzun kuluçka dönemi olduğunu. Bu rahatsızlık hazırlama 23. sırasında neden sonra dilimler metabolik devlet ve kinaz aktivasyon düzeylerinde istikrar sağlamak için gerçekten çok önemli olduğu not edilmiştir. Bu stabilite, uzun süreli kayıtlar tutarlılık için gereklidir. Bu gözlem yeniden vurgulamak ve yaklaşık 3 saat uzun inkübasyon saatleri öneririz.
Stimülasyon parametreleri çeşitli LTP sebep olduğu bilinen, ancak her durumda ortaya moleküler mekanizmalar (inceleme için 38 bakınız) aynı olmayabilir. Bu dayanıklılık ve sırayla, sinaptik etiketleme ve yakalama deneylerin sonuçlarını etkileyebilir, LTP diğer özelliklerini etkileyebilir. Dolayısıyla stimülasyon paradigmalar ve özelliklerini doğrulamak için önemlidirortaya çıkardı LTP performans laboratuvar koşullarında ve tutarlılığı korumak.
Biz genellikle çok büyük presinaptik lif yaylım ile ve maksimal 0,5 mV daha az fEPSPs ve kayıtlar da reddedilir sırasında lif voleybolu önemli değişiklikleri içeren deneyleri deneyler düşünmüyoruz. Bundan başka, iki ya da üç yol yol deneyler ise, bu yolun bağımsızlık sağlamak için önemlidir. Bu eşleştirilmiş darbe kolaylaştırma protokolü 28 ile yapılabilir.
Arabirim kayıt sistemlerinden biri dezavantajı odası ve çevre arasındaki sıcaklık ve nem farklılıklar nedeniyle uzun kayıt saatlerinde elektrotlar üzerinde yoğunlaşma damlacıklarının oluşumu. Bu damlacıklar dikkatli bir şekilde, zaman zaman, lekelenen gerekir. Aksi halde damlacıklar dilimleri üzerine damla ve rahatsızlığı veya sinyallerin hatta kaybına neden olabilir. Biz genellikle bu b mücadeley ustaca elektrotları dokunmadan, bir ince filtre kağıdı fitil kullanılarak mikroskop altında güdümlü damlacıkların blot. Ancak, en iyi çözüm gibi Edinburgh araştırmacılar Üniversitesi tarafından geliştirilen ETC sistemi gibi merkezi bir ısıtma sistemi, kullanmak olacaktır.
Bir sonuç not, metodolojiler çeşitli farklı deneysel amaçlar için hipokampal dilim hazırlanmasında kullanılan dünya çapında laboratuarlarda var. Prosedürün birbirleri üzerinde bazı avantajlar sunmaktadır. Bir dikkatlice deney amacına uygun protokol dakika ayrıntıları optimize etmek gerekiyor. Biz bu makalede bu tür STC ve çapraz yakalama gibi geç-ilişkisel süreçleri incelemek için metodolojinin bazı yönlerini geliştirmeye yardımcı umuyoruz.
Açıklamalar
Bu video makalede Açık erişim Cerebos Pasifik Limited tarafından desteklenmektedir.
Teşekkürler
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Malzemeler
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Referanslar
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır