Method Article
설치류에서 급성 해마 조각을 사용하여 시냅스 태그 / 캡처 및 크로스 캡처 조사
요약
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
초록
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
서문
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
프로토콜
모든 동물의 절차는 싱가포르 국립 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었다.
인공 뇌척수액 유체 1. 준비 (ACSF)
- (124)의 NaCl, 3.7의 KCl (MM)에 황산 .7H 2 O 1.0, 2.5 염화칼슘 2 · 2H 2 O로 구성된 ACSF, 1.2 KH 2 PO 4, 24.6의 NaHCO3, 10 D- 글루코스를 준비합니다. 전기 생리 녹음 중에 95 % O 2 5 % CO 2 혼합물 (carbogen). 모두 해부, 슬라이스 준비를위한 (21) 사용이 ACSF 및 관류 용으로 포화 버블 때 ACSF의 pH가 7.2-7.4 사이에 있는지 확인하십시오.
참고 : 측정하고 ACSF을 들고 깨끗한 장치를 사용합니다. 부정한 장치를 사용하면 흐린 용액 또는 침전물의 형성으로 이어질 수 있습니다. 모든 준비를위한 탈 이온수를 사용합니다. - NaHCO3을 제외한 2 패 10 배의 ACSF 주식을 준비 와 부피 플라스크에 D-포도당. 다음과 같은 순서로 탈 이온수에 시약을 추가 염화나트륨 (144.96g)의 KCl (5.52g), 황산 .7H 2 0 (4.92g), 염화칼슘 2 · 2H 2 0 (7.56 g)을, KH 2 PO 4 (3.28 L. 2의 부피로 g) 및 상부까지 모든 시약이 용해되도록 자석 교반기를 이용하여 적어도 30 분 동안 계속 교반한다. 4 O C의 주식을 보관 2 주 이내에 사용한다.
- 해부 및 실험에 앞서, D의 NaHCO3 및 글루코스 필요한 양의 첨가와 함께 부피 플라스크에 ACSF 스톡을 희석. 1 L의 용액의 경우, 2.07 g의 수 NaHCO3 및 1.802 g D- 글루코스를 첨가 한 후 1 L로 재고 100 mL로 희석한다. ACSF은 침전물 또는 용해되지 않은 입자의 무료 맑은 용액해야한다.
- 쿨 약 200 ~ 300 ml의 얼음에 ACSF의, 해부하는 동안 사용합니다. 해부에 사용되는 ACSF가 2-4 ° C를 사이에 있는지 확인합니다. electrop의 남은 ACSF를 사용하여hysiological 실험. 모든 버블 ACSF 솔루션 연속적 carbogen (5 % CO 2, 95 % O 2)와 포화. ACSF가 식을 때까지 기다리는 동안, 해부 영역과 슬라이스 챔버를 준비합니다.
인터페이스 회의소 2. 준비
참고 : 인터페이스 뇌 슬라이스 챔버 (그림 2B)을 조각 배양 및 전기 생리 녹음하는 동안을 유지하기 위해 사용되는 두 개의 구획으로 구성되어 있습니다. 하부 챔버 온도 제어기에 의해 32 ° C로 유지 증류수 연속적 carbogen 버블 포함.
- 온도 컨트롤러에 전환하고 32 ° C에서 그것을 사전. 유입 관을 통해 증류수를 실행하여 10 분 ~ 15의 상부 챔버를 씻으십시오. 상부 챔버는 그물을 배치하기 전에 깨끗한 지 확인합니다. 하단 챔버에서 그 수위가 증류수로 채워 약 70 %로 확인합니다.
- 장소다락방에서 그물 조각을위한 휴식 표면 (그림 2C)를 제공합니다. 액면이 충분히 네트의 전체 영역을 습윤되도록 유출 관을 조정한다. 상부 챔버 내에서 가습 carbogen 분위기를 유지하기 위해 그물 위에 뚜껑을 놓습니다.
- / 분으로 1 ml의 유량을 조정한다. 슬라이스 잠복기 및 실험을하는 동안,이 유량을 유지한다. 갓 준비 1X의 ACSF을 carbogenating 시작하고 ACSF에 유입 튜브를 담가. ACSF가 그것으로 채워 져야 carbogen와 다락방에 대한 포화 될 때까지 20 분을 허용합니다.
급성 해마 조각 3. 준비
참고 : 해부 프로토콜은 차가운 ACSF과 (2)의 분리 및 해마의 슬라이스로 동물에서 뇌의 (1) 제거로 구성되어 있습니다. 신경 세포가 생존을 유지 분리하고 빨리 감기 ACSF의 뇌를 배치하고 전체를 완료하기 위해서는3 ~ 5 분 이내에 슬라이스를 포함하는 방법.
- 추운 ACSF으로 뇌의 제거
- 도 1a에 도시 된 바와 같이 절개 도구를 배치. 해부 과정을 용이하게하기 위해 사용 순서에 따라 도구를 정렬합니다. 시작하기 전에 모든 해부 도구가 준비되어 있는지 확인합니다.
- , 에틸 아세테이트, 무수 에탄올과 증류수로 세척 면도날을 장착 수동 조직 헬기 (그림 1B)에 단단히 고정하고 최첨단 균등하게 정렬되어 있는지 확인합니다. 필터 종이를 자르고 시험 날이 단단히 고정되어 있는지 확인합니다. 시작 위치에 슬라이딩 버니어 마이크로 미터를 설정합니다.
- 유도 챔버에 동물을 사용하여 이산화탄소 (CO 2)를 안락사 및 붕대 가위 단두대로 참살. 아이리스 가위를 사용하여 두개골 위의 피부와 털을 제거합니다. brainstem.Make에게 차를 따라 작은 절개를 제거하기 위해 후방을 통해 상처를 확인두개골의 오른쪽과 왼쪽에 긴 절개를 전자.
주의! 그것은 손상을 방지하기 위해 실험에 사용되는 측에 단지 작은 절개를합니다. 가위를 삽입 할 때 가해지는 힘이 뇌에 손상을 방지하기 위해 위쪽 있는지 확인하십시오. - 조심스럽게 피질을 나타 내기 위해 두개골의 오른쪽으로 왼쪽에서 시작 rongeur 뼈와 두개골을 제거합니다. 경질의 얇은 층은 또한 알 수있다. 조심스럽게 rongeur와 정면 플레이트를 제거합니다. 전면 판과 함께 경질의 대부분을 제거합니다.
주의! 경질은 뇌 조직을 통해 슬라이스 않도록주의. - 특히 주걱의 평평한 끝 피질과 소뇌 사이의 교차점에있는 경우, 나머지 경질을 제거합니다. 단계 3.1.5과 3.1.6의 경우, 손상을 방지하기 위해 멀리 두뇌에서, 위쪽, 즉 압력을 유지한다. 주걱을 사용하여, 부드럽게 감기와 carbogenated ACSF (2-4 ℃로) 가득 배양 접시, PLA로 뇌 특종알루미늄 냉각 블록에 세드릭.
- 해마의 분리
- 메스를 사용하여 직선 절단 뇌 (약 분기)의 앞쪽 부분을 제거하는 소뇌와 다른 컷을 제거 할 수 있습니다. 중간 선을 따라 얕은 상처를 확인합니다.
- 조심스럽게 지느러미 해마를 나타 내기 위해 중간 선에서 시작, 낫 스케일러와 피질을 제거합니다. 해마 위 피질의 층을 제거합니다. 뇌를 지원하기 위해 손가락이나 각도 집게를 사용합니다. 해마 접합면에 작은 상처를 확인합니다. 완만 한 움직임을 사용하여 지느러미 해마에서 시작 낫 스케일러와 해마를 제거합니다.
주의! 스트레칭과 해마를 찢어지지 않도록 부드럽게합니다. - 낫 스케일러와 격리 된 해마 주변에 피질과 결합 조직을 제거합니다.
- 해마 조직을 조각화 및 인터페이스 챔버에 조각을 전송
- ACSF-의 조각을 놓습니다수동 슬라이서의 슬라이스 무대에 적신 여과지 (1 급, 30mm). 특종 및 여과지에 해마 조직을 배치합니다. 해마는 약 70 O fimbria 중 각도로 분리되도록 슬라이서 블레이드 관련한 적절한 방향에서 해마를 정렬 여과지를 이동.
- 접힌 종이 필터와 해마 조직 (1 급, 85mm) 약간 젖은 해마를 떠나 주변을 초과 솔루션을시킨다. 가로 해마 슬라이스 시작합니다. 슬라이스 형태가 분명하지 않은 슬라이스는 해마의 선단부로부터 조직을 버리고.
- 400 μm의 두께 조각으로 남아있는 조직을 조각입니다. 부드러운 강타의 움직임을 사용하여 부드러운 강모 브러시와 블레이드에서 부드럽게 해마 조각을 들고 차가운 carbogenated ACSF 가득 작은 비커에 조각을 배치합니다. 단계를 수행 3.3.1-3.3.3 가능한 빨리 해마 조직이 공기에 노출되기 때문이다.
참고 : 일반적으로 해마의 3 분의 2는 슬라이스하고, 명확한 형태와 4-6 조각을 제조 할 수있다. - 부드럽게 (팁의 2-3cm를 멀리 절단하여 만든) 다양한 팁과 깨끗한 플라스틱 파스퇴르 피펫을 사용하여 조각 실의 순에 조각을 전송합니다. 조심스럽게 구부러진 끝 작은 주사기를 사용하여 그물에 조각의 위치를 조정합니다. 전극 위치 및 기록을 용이하게하여 슬라이스를 배치. 슬라이스가 충분히 ACSF에 둘러싸여 있지만, 침수 또는 (그림 2C-D)를 떠되지 않도록 확인합니다. 챔버 커버 2 ~ 3 시간 동안 조각을 품어.
주 : 건강한 조각의 피라미드 세포 층 일부 투명성을 보여 주어야한다.
CA3-CA1 시냅틱 응답 4. 기록
주 : 필드 전위 기록을 위해 사용되는 전기 생리학 셋업은도 2a에 도시되어있다. 파라전기 간섭 전기 설정의 적절한 접지 후 통제 할 수없는 경우 일 케이지는 것이 좋습니다. 침수 및 인터페이스 챔버의 많은 다른 종류가 시판되고있다. 그러나, 인터페이스 챔버는 그들에 조각 전시보다 강력한 시냅스 답변으로 바람직하다.
- 전극의 위치
- 전기 장치를 켜십시오 (자극과 앰프)를 사용할 수 있습니다. 마운트 및 미세 조작기의 플렉시 글라스 홀더에 자극과 기록 전극을 고정합니다.
참고 : 우리는 단극, 모두 자극과 기록을 위해 5 MΩ 저항의 옻칠 코팅, 스테인레스 스틸 전극을 사용합니다. - 사용하기 전에 뽑아 유리 모세관 내부 이러한 전극을 삽입하고 에폭시 접착제 전극의 끝 부분 (그림 2E)의 작은 부분을 노출 고정합니다. 이것은 달리 슬림 전극에 힘을주고 전자 업계에 단단히을 확보하는 데 도움이ctrode 홀더.
- 현미경 하에서 유도, 전계 EPSP (fEPSP) 응답을 기록하는 CA1의 꼭대기 수지상 영역 샤퍼 담보 섬유 및 기록 전극을 자극 CA1 영역의 지층 radiatum의 자극 전극 (들)의 위치.
주 : 전극 슬라이스 상기 액체 표면에 접근 신속 슬라이스 (단, 증폭기는 스피커에 연결된다)의 표면을 찾는 데 도움이되는 음을 준다. - 시냅스 태깅 및 캡처 실험에서 실험의 필요성에 따라, 기록 전극의 양쪽에 위치 두세 자극 전극 (S1, S2 또는 S3)는 두 개 이상의 독립적이지만 중복 입력을 자극. 떨어져 200 μm의에 대한 자극 및 기록 전극을 배치합니다.
- 필요한 경우, 인구 스파이크 (그림 3A)를 기록 지층 pyramidale 층에 또 다른 기록 전극의 위치를 .When 모두전극 수집 소프트웨어를 이용하여, 슬라이스를 터치 한, 적절한 fEPSP 신호를 확인하기위한 테스트 자극을 준다.
참고 : 우리는 시험 자극 이상성, 정전류 펄스 (임펄스 지속 시간이 0.1 밀리 초 / 반파)를 사용합니다. - 적절한 fEPSP 신호가 획득되면,주의 깊은 매니퓰레이터의 미세한 움직임 노브를 사용하여 200 μm의 약 전극을 낮 춥니 다. 슬라이스 복구하는 20 분을 허용합니다. 짝 펄스 촉진 프로토콜 27,28와 경로 독립성을 테스트합니다.
- 전기 장치를 켜십시오 (자극과 앰프)를 사용할 수 있습니다. 마운트 및 미세 조작기의 플렉시 글라스 홀더에 자극과 기록 전극을 고정합니다.
- 입력 - 출력 관계
- 전류 강도의 범위에서 경사 값을 측정함으로써 각 입력에 대한 입력 - 출력 관계식 (fEPSP 슬로프 VS 심성 자극)을 결정한다. 100 μA 20 μA 사이에이 작업을 수행합니다. 이어서 최대 fEPSP 경사의 40 %를 획득하기 위해 각 입력 자극 강도를 설정한다. 실험을하는 동안이 일정하게 유지.
- 15-20 분 후에, 기준 기록을 시작. F 모니터EPSP의이 기간 동안 긴밀하게 경사 및 경사가 설정 값에서 10 % 이상 변동하는 경우 자극 강도를 재설정하고 새로운 기준을 시작합니다. 진행하기 전에 기록 적어도 30 분 또는 1 시간 안정 기준.
참고 : 테스트 또는 기준 자극을 위해, 우리는 5 분마다 주어진 0.2 Hz의 이상성, 정전류 펄스의 네 스윕 (극성 당 0.1 밀리 초)를 사용합니다. 이 네 가지 답변의 평균 기울기는 다음 하나의 반복으로 간주됩니다. 신호는 아날로그 - 디지털 변환기를 사용하여 디지털화 주문품 소프트웨어 온라인 모니터링, 차동 증폭기에 의해 필터링 및 증폭된다.
- LTP / LTD 유도 자극 프로토콜을 사용하여
참고 : LTP과 회사 모두 일찍 분류 된 단백질 합성의 요구 사항에 따라 늦은 LTP / LTD; 그 말 유지 보수를 위해 후자의 요구 번역 및 / 또는 전사 [검토를 위해 4 참조]. 전기 자극 패러다임의 다양한 수 specificallY는 LTP 및 LTD의 다른 형태를 유도한다.- WTET : 100 Hz에서 21 이상성 정전류 펄스 (상 당 0.2 밀리 초).
- 이키 : 일초 (100 Hz에서) 매 10 분 (상 당 폭 0.2 밀리 초 펄스) 100 펄스의 세 버스트.
- 15 분의 시간 동안 900 버스트. 1 버스트는 50 밀리 초 (20 Hz에서)의 interpulse 간격으로 3 펄스 (0.2 밀리 폭)으로 구성되어 있습니다. 간 버스트 간격은 1 초 (펄스 2,700의 총 수)입니다.
슬라이스 상공 회의소 및 관류 시스템 5. 청소
- 녹화가 끝난 후, 더 생화학 적 분석을 위해 해마 슬라이스를 수집하거나 다른 적절하게 폐기하십시오. carbogen 공급 장치 및 온도 조절기의 전원을 끄십시오. 증류수에 carbogen 버블을 씻으십시오.
- 브러시와 증류수로 철저하게 그물을 청소합니다. 높은 유속으로 증류수로 15 ~ 20 분 동안 장비를 세척한다. 3-4일에서 일단의 증류수를 변경챔버의 하부 구획 3 % 과산화수소 용액으로 또한 정기적으로 챔버는 깨끗 곰팡이 성장을 방지한다.
결과
설명 방법론 (위 스타). 이러한 성인 쥐의 급성 해마 조각에서 시냅스 태그 및 크로스 캡처 등의 LTP / LTD와 연관 상호 작용의 오래 지속되는 형태를 연구하는 데 사용되었다 (23)이 기술은 모두 쥐 실험에 대한 효과가 입증하고있다 마우스의 다양한 30,31 종자. 방법론은 최대 8 ~ 12 시간의 안정적인 LTP 녹음을 성공적으로 사용되어왔다. (32)
초기 LTP의 (도 3B, 충전 원 S2)하여 변환 그렇지 않으면 부패 형태 (하나의 입력 (S1)의 약한 tetanization 설정 한 '태그' 'PRPS'다른 독립적하지만 중복 입력의 강한 tetanization에 의해 유도를 캡처 오래 지속되는 한 (그림 3B, 열린 원)에 S1에 -LTP) (WTET에 의해 유도 된 초기 LTP의 비교를 위해) 20,33을 참조하십시오. 약에 의해 캡처 PRPStetanization 집합 태그는 반드시 이키 유도 후기 LTP에서 올 필요는없고 또한 SLFS 유도 후기 LTD에 의해 제공 될 수있다. LTP와 회사 사이에 긍정적 인 연관 상호 작용의 유형은 '크로스 태그 / 캡처'라고합니다. (S1)에 WTET에 의한 초기 LTP는 S2에서 SLFS 유도 늦게 회사에서 제공하는 PRPS (그림 3C, 채워진 원)를 캡처하여 늦은 LTP (그림 3C, 열린 원)로 강화됩니다. 자신의 기준과 비교했을 때 통계 학적으로 유의 한 상승 작용 또는 우울증은 두 경우 모두에서 S1과 S2로 유지 하였다 (윌 콕슨 테스트; P <0.05).
태그 PRP 상호 작용이 발생하는 경우 (약한 전에 강한 / 강한-전에 약함)은 두 이벤트 사이의 시간 윈도우는 30-60의 범위 내로 유지되는 한, 두 가지 이벤트의 시간적 순서만큼 중요하지 않다 분. 그것은에서, 세 번째 독립하지만 중복 시냅스를 포함하는 것이 현명 할 것입니다두고 기록의 안정성을 모니터링하는 기준선 대조군으로서 사용. LTP / LTD의 early- 늦게 형성을 유도하는 데 사용되는 전기 자극 프로토콜은 STC 실험에 사용하기 전에 일관성과 신뢰성을 단일 입력 실험에서 검증해야합니다. 우리는 또한이 실험의 성공은 조각의 품질에 크게 의존하기 때문에 프로토콜에 설명 슬라이스 준비 방법론의 중요성을 강조하고 싶습니다.
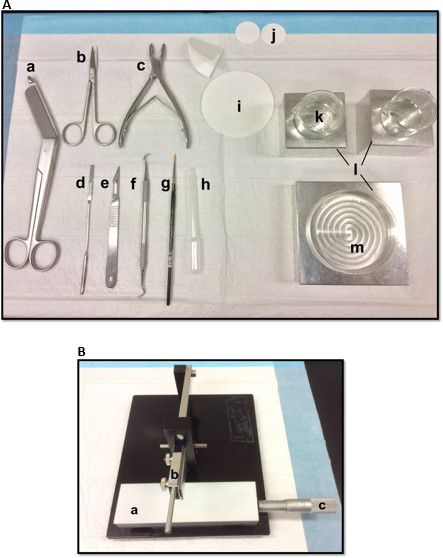
해마 절제술에 사용되는도 1 (A) 도구 (A) 붕대 가위 (b) 아이리스 가위 (c) 뼈 rongeur (d) 얇은 주걱, 소프트 (E) 메스 번호 11 (F) 낫 스케일러 (g) -bristle 페인트 브러시 (H) 플라스틱 파스퇴르 피펫 (I) 종이 필터 (85mm) (J) 종이 필터 (30mm) (K) 배양 접시와 비커에 맞게 유리 비커 (L) 알루미늄 냉각 블록(M) 페트리 접시. (B) 수동 조직 헬기. () 플랫폼 (b)는 블레이드 홀더 (C) 버니어 마이크로 미터, 해상도 10 미크론의 팔을 절단. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2 전기 생리학 셋업 (A)으로 이루어진 자극 필드 전위 기록 용 (b) 차동 증폭기 (c) 아날로그 - 디지털 변환기 (D) 오실로스코프 (E) 수집 소프트웨어 (F)와 컴퓨터 내진 저항하는 탁상 형 전극 홀더와> 4 배 확대 (H) 인터페이스 뇌 슬라이스 챔버 (I) ACSF과 carbogen 공급 (J) 온도 조절기 (K)에 대한 관류 시스템 조명 원 (L) 조종 (G) 현미경. (B) 인터페이스 뇌 슬라이스실. (C) 및 (D) 인터페이스 챔버에서 해마 조각 유리 모세관에 밀봉. (E) 스테인레스 스틸 전극. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
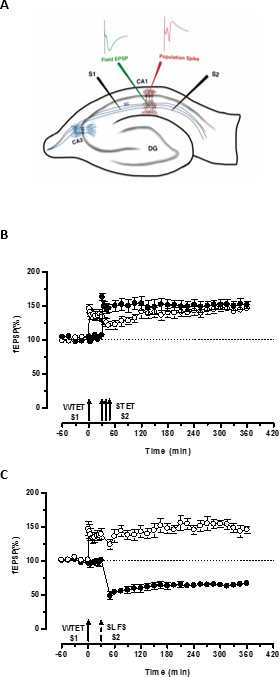
그림 3. (A) 필드 잠재력 녹음 가로 해마 슬라이스와 전극 위치의 도식 표현은이 표현에서, 두 자극 전극 (S1 및 S2)을 자극하는 CA1 지역의 지층 radiatum에 위치하는 두 개의 독립적 인하지만 중복 CA1 피라미드 뉴런 상에 시냅스 입력. 두 세포 외 기록 전극, 하나는 혀끝 수지상 실에서 현장 EPSP (흥분성 시냅스 후 전위)를 기록하고 다른 하나는 피라미드 세포에서 체세포 인구 스파이크를 기록기관은 각각 지층 radiatum 및 지층 pyramidale에 있습니다. CA1- cornu ammonis 지역 1, CA3- cornu ammonis 영역 (3), DG- 치아 이랑, SC-Schaffer의 담보 섬유, S1- 자극 전극 (1), (S2) - 자극 전극 (2) (B) 약한 STC을 연구하는 강력한 패러다임 전에 : 약한 tetanization (WTET)는 늦은 LTP를 유도하기 위해 30 분에서 S2의 강력한 tetanization (이키) (채워진 원) 다음 초기 LTP를 유도 (오픈 원) (S1)에 적용됩니다. (S1)의 초기 LTP는 태그를 보여주는 늦은 LTP에 강화 및 상호 태그를 공부하는 강력한 패러다임 전에 (N = 6) (C) 약한 상호 작용을 캡처 가져옵니다. 조기 LTP는 다음 S1 (개방 원)에 WTET에 의해 유도된다 30 분 후 SLFS를 사용하여 (S2)에서 후반 회사의 유도 (채워진 원)에 의해. (S1)에서, 초기 LTP 크로스 태그 및 캡처를 보여주는 6 시간 지속 늦은 LTP로 변환 (N = 6). 단일 화살표는 초기 LTP 유도에 적용 약한 tetanization을 나타냅니다. 화살표의 삼중 나타냅니다늦은 LTP를 유도하는 강력한 tetanization. 깨진 화살표 SLFS가 늦은 LTD을 유도하는 대표적인 시냅스 입력에인가 된 시점을 나타낸다. 오차 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
급성 해마 슬라이스 LTP 및 STC 크로스 포착과 같은 다른 기능성 소성 과정의 연구에 훌륭한 모델 시스템이다. 그것은 해마 회로의 판상 구조 네트워크의 대부분, 정확한 전극 위치를 허용하고 혈액 - 뇌 장벽없이 함께 빠른 neuropharmacological 조작을위한 개방형 플랫폼을 제공하고 유지합니다.
이 문서에서는 젊은 성인 쥐에서 가능한 급성 해마 조각의 제조 방법을 설명하고 STC 크로스 태그를 조사하기 위해 그들을 사용. 이전 연구는 동물의 성별과 나이는 전기 생리학 연구에 사용하기 위해 고려해야 할 중요한 요소임을 강조했다. 완벽하게 표현 성인 수용체 기능 (5-7주 세 남성의 Wistar 쥐)와 27, 28 따라서 젊은 성인 동물이 사용된다. (23) 비대칭을 좌우 해마 간의 연결에서 설치류 (29)에 기록되어 있고NMDA 수용체 발현의 주요 차이점은도 34과 같이보고되었다. 그러나 우리는. LTP 이전 연구와 일치하도록하기 위해 23,32을 오른쪽 해마를 사용한 해마 중 하나는 한 일관성이 유지되는 한 사용될 수있다.
모든 프로토콜에서, 그것은 고립과 조직이 뻗어 손상, 건조 또는 저산소 렌더링되지 않습니다 신속하게 절차를 얇게하지만 돌보는을 수행하는 것이 매우 중요하다. 산도, 온도, 이온 성 용액의 조성에 변화가 슬라이스와 결과의 생존에 지대한 영향을 미칠 수있다. 그러므로 그러한 변형은 피해야한다. 이는 제조 공정 중에 발생하는 글루타메이트 수용체 - 의존성 칼슘 방출이 비가 역적으로 신경 조직 (35, 36), (37)에서 단백질 합성에 영향을 미칠 수 있음이 관찰되었다. 수동 티슈 슬라이서를 사용하여 VI에 비하여 매우 신속하게 완료 할 수 있도록하여 공정이 최소화 할 수있다braslicers. 그러나 많은 실험실 효과적으로 슬라이스 생존을 유지하기 위해 필요한 예방 조치와 vibraslicers를 사용합니다. 고려해야 할 또 다른 중요한 요소는 실험을 시작하기 전에 긴 잠복 기간이다. 이것은 방해가 준비 23시 발생 후 조각의 대사 상태와 키나아제 활성 수준의 안정성을 달성하기 위해 정말 중요한 것으로 지적되고있다. 이러한 안정성은 장기 녹음에 일관성이 필요하다. 우리는이 관찰을 다시 강조하고 약 3 시간의 긴 배양 시간을 제안한다.
자극 파라미터는 다양한 LTP를 유도하는 것으로 알려져있다, 그러나 각각의 경우에 유발 분자 메커니즘 (검토를 위해 38 참조) 동일하지 않을 수있다. 이것은 내구성, 차례로, 시냅스 태깅 및 캡처 실험의 결과에 영향을 미칠 수 있으며, LTP의 다른 특성에 영향을 미칠 수있다. 그러므로 그것은 자극 패러다임과 특성을 확인하는 것이 중요유발 된 LTP의 수행 실험실의 조건과 일관성을 유지한다.
우리는 일반적으로 매우 큰 시냅스 섬유 발리와 최대 0.5 MV 이하 fEPSPs과 녹음도 거부하는 동안 섬유 발리에서 상당한 변화를 포함하는 실험에 실험을 고려하지 않는다. 또한, 두 개의 경로 또는 3 통로 실험을 수행하는 반면, 경로의 독립성을 보장하는 것이 중요하다. 이것은 한 쌍의 펄스 촉진 프로토콜 (28)을 행할 수있다.
기록 인터페이스 시스템의 일 단점은 챔버와 주위 사이의 온도 및 습도 차이에 의해 긴 시간 동안의 기록 전극 결로 물방울의 형성이다. 이 물방울 신중 수시로 도말해야합니다. 그렇지 않으면 방울 조각에 물방울과 방해 또는 신호도 손실이 발생할 수 있습니다. 우리는 일반적으로이 B 태클Y는 능숙 전극을 건드리지 않고, 슬림 여과지 심지를 사용하여 현미경으로 유도 적을 블 롯팅. 그러나, 최상의 해결책은 에든버러 대학 연구자에 의해 개발 된 ETC 시스템으로 중앙 가열 시스템을 사용하는 것이다.
결론 메모에서 다양한 방법론은 다른 실험 목적 해마 슬라이스의 제조에 사용되는 세계적인 실험실에서 존재한다. 절차의 각 일부 위에 다른 장점을 제공한다. 하나주의 깊게 실험의 목적에 적합하도록 프로토콜의 분 정보를 최적화 할 필요가있다. 우리는이 문서는 STC 크로스 캡처 늦게 연관 프로세스를 공부 방법론의 일부 측면을 개선하는 데 도움이되기를 바랍니다.
공개
이 비디오 기사에 대한 오픈 액세스는 Cerebos 평화로운 제한 후원됩니다.
감사의 말
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
자료
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
참고문헌
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유