Method Article
Indagine di Synaptic Tagging / Cattura e Cross-cattura utilizzando acuta fettine di ippocampo da Roditore
In questo articolo
Riepilogo
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Abstract
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introduzione
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocollo
Tutte le procedure sugli animali sono state approvate dalla cura e l'uso Comitato istituzionale animali (IACUC) dell'Università Nazionale di Singapore.
1. Preparazione di artificiale liquido cerebrospinale (ACSF)
- Preparare la ACSF costituito da (in mM) 124 NaCl, KCl 3,7, 1,0 MgSO4 7H 2 O, 2,5 CaCl 2 .2H 2 O, 1,2 KH 2 PO 4, 24,6 NaHCO3 e 10 D-glucosio. Assicurarsi che il pH della ACSF è compreso tra 7,2-7,4 quando gorgogliare alla saturazione con 95% O 2 e 5% CO 2 miscela (carbogeno). 21 Usare questo ACSF sia per la dissezione, la preparazione fetta e per perfusione durante le registrazioni elettrofisiologiche.
NOTA: Utilizzare un apparecchio pulito per la misurazione e tenendo premuto il ACSF. Usando apparecchi impuro può portare a soluzioni torbide o formazione di precipitati. Usare acqua deionizzata per tutte le preparazioni. - Preparare un 2 L 10x ACSF magazzino escluso NaHCO 3 e D-glucosio in pallone tarato. Aggiungere reagenti all'acqua deionizzata nel seguente ordine: NaCl (144.96g), KCl (5.52g), MgSO4 7H 2 0 (4.92g), CaCl 2 .2H 2 0 (7,56 g), KH 2 PO 4 (3.28 g) e superiore fino al volume di 2 L. mescolare continuamente per almeno 30 minuti con un agitatore magnetico per garantire che tutti i reagenti sono dissolti. Conservare il magazzino in 4 ° C e utilizzare entro 2 settimane.
- Prima della dissezione e gli esperimenti, diluire il ACSF magazzino in un pallone tarato con l'aggiunta di quantità necessaria di NaHCO3 e D-glucosio. Per 1 soluzione L, diluire 100 ml di brodo di 1 L dopo l'aggiunta di 2,07 g NaHCO3 e 1.802 g di D-glucosio. Il ACSF dovrebbe essere una soluzione trasparente, priva di qualsiasi precipitato o di particelle non disciolte.
- Raffreddare circa 200-300 ml di ACSF sul ghiaccio, da utilizzare durante la dissezione. Assicurarsi che il ACSF utilizzata per la dissezione è compresa tra 2-4 ° C. Utilizzare il ACSF rimanente per electropEsperimenti hysiological. Bubble tutte le soluzioni aCSF alla saturazione con CarboGen (5% di CO 2, il 95% O 2) continuamente. In attesa del ACSF si raffreddi, preparare l'area dissezione e la camera di fetta.
2. Preparazione della Camera di interfaccia
NOTA: Una camera fetta cervello interfaccia, utilizzato per l'incubazione le fette e mantenerle durante registrazioni elettrofisiologiche (Figura 2B), si compone di due compartimenti. La camera inferiore contiene acqua mantenuta a 32 ° C distillato da una termocoppia e continuamente gorgogliare con CarboGen.
- Accendere il regolatore di temperatura e preimpostarla a 32 ° C. Lavare la camera alta per 10 a 15 minuti con acqua corrente distillata attraverso il tubo di afflusso. Assicurarsi che la camera superiore è pulito prima di mettere in rete. Controllare che il livello dell'acqua nella camera inferiore è circa il 70% riempita con acqua distillata.
- Posiziona ilnet nella camera superiore per fornire un piano di appoggio per le porzioni (Figura 2C). Regolare il tubo di efflusso per assicurare che il livello della soluzione è sufficientemente bagnare l'intera area della rete. Posizionare il coperchio sopra la rete per mantenere un'atmosfera umidificata carbogeno nella camera superiore.
- Regolare il flusso di 1 ml / min. Mantenere questa portata per tutto il periodo di incubazione fetta e l'esperimento. Avviare carbogenating il ACSF 1x appena preparato e immergere il tubo di afflusso nel ACSF. Lasciare 20 min per il ACSF saturo con CarboGen e per la camera superiore per essere riempito con esso.
3. Preparazione di acuta fettine di ippocampo
NOTA: Il protocollo dissezione è composto da (1) rimozione del cervello dall'animale in ACSF e fredda (2) Isolamento e tranciatura dell'ippocampo. Affinché i neuroni di rimanere vitali, isolano e mettono il cervello in ACSF freddo rapidamente e completare l'interoprocesso affettare in 3-5 minuti compresi.
- La rimozione del cervello in ACSF freddo
- Disporre gli strumenti di dissezione nel modo illustrato nella Figura 1A. Disporre gli strumenti secondo l'ordine di utilizzo per facilitare il processo di dissezione. Prima di iniziare, assicurarsi che tutti gli strumenti di dissezione sono pronti.
- Montare una lama di rasoio, pulito con acetato di etile, etanolo assoluto e acqua distillata, sul chopper tessuto manuale (Figura 1B), fissarlo saldamente e in modo che la punta di diamante è perfettamente allineato. Test di tagliare un pezzo di carta da filtro per assicurarsi che la lama è fissata saldamente. Impostare lo scorrimento Vernier micrometro nella posizione di partenza.
- Eutanasia l'animale con anidride carbonica (CO 2) in una camera di induzione e decapitare con le forbici benda o ghigliottina. Utilizzo di un forbici Iris, togliere la pelle e pelliccia sopra il cranio. Fare un taglio attraverso posteriore per rimuovere il brainstem.Make una piccola incisione lungo thall'e lato destro del cranio e un'incisione più a sinistra.
ATTENZIONE! Effettuare solo una piccola incisione sul lato che viene utilizzato per gli esperimenti per evitare di danneggiarlo. Quando si inseriscono le forbici, assicurarsi che la forza applicata è verso l'alto per evitare danni al cervello. - Rimuovere delicatamente il cranio con un osso rongeur partendo dalla sinistra alla destra del cranio per rivelare la corteccia. Un sottile strato di dura può anche essere visto. Rimuovere con attenzione le piastre frontali con il rongeur. Eliminare la maggior parte dura con le piastre frontali.
ATTENZIONE! Fate attenzione che la dura non tagliare attraverso il tessuto cerebrale. - Rimuovere la dura eventuale residuo, in particolare nella giunzione tra la corteccia e il cervelletto con la parte piatta di una spatola. Per la procedura 3.1.5 e 3.1.6, mantenere la pressione verso l'alto cioè lontano dal cervello per evitare di danneggiarlo. Utilizzando la spatola, scoop delicatamente il cervello in una capsula di Petri piena di freddo e ACSF carbogenated (2-4 ° C), placed su un blocco di raffreddamento in alluminio.
- Isolamento dell'ippocampo
- Usando un bisturi, effettuare un taglio dritto per rimuovere il cervelletto e un altro taglio per rimuovere la parte anteriore del cervello (circa un quarto). Fare un taglio superficiale lungo la linea mediana.
- Rimuovere con attenzione la corteccia con uno scaler falce, partendo dalla linea mediana per rivelare le ippocampo dorsale. Rimuovere lo strato di corteccia sopra dell'ippocampo. Usare le dita o pinze ad angolo per sostenere il cervello. Fare un piccolo taglio al commessura ippocampale. Rimuovere delicatamente l'ippocampo con la modalità falce a partire dalle ippocampo dorsale con movimenti di rotolamento.
ATTENZIONE! Sii gentile per evitare stretching e strappare l'ippocampo. - Rimuovere qualsiasi corteccia e dei tessuti connettivi intorno l'ippocampo isolato con lo scaler falce.
- Tagliando il tessuto dell'ippocampo e trasferire le fette sulla camera di interfaccia
- Posizionare un pezzo di ACSF-carta da filtro imbevuta (Grade 1, 30 mm) sul palco affettare affettatrice manuale. Scoop e posizionare il tessuto dell'ippocampo sulla carta da filtro. Spostare la carta da filtro per allineare l'ippocampo a debita orientamento rispetto alla lama dell'affettatrice modo che l'ippocampo è tagliato ad un angolo di circa 70 o al fimbria.
- Asciugare la soluzione in eccesso che circonda il tessuto dell'ippocampo con un filtro di carta piegato (Grade 1, 85 mm) lasciando l'ippocampo leggermente umida. Affettare l'ippocampo trasversalmente Avvia. Slice e scartare tessuto dalla fine estremo dell'ippocampo dove la morfologia fetta non è chiaro.
- Tagliate il tessuto rimanente in 400 fette micron di spessore. Pick up fettine di ippocampo delicatamente dalla lama con una spazzola con setole morbide con movimenti delicati e strisciando disporre le fette in un piccolo bicchiere pieno di freddo ACSF carbogenated. Eseguire le fasi 3.3.1-3.3.3 più rapidamente possibile poiché il tessuto dell'ippocampo è esposto all'aria.
NOTA: In genere i due terzi dell'ippocampo è affettato, e 4-6 fette con chiaro morfologia possono essere preparati. - Trasferire le fette delicatamente sulla rete nella camera fetta con un pulito di plastica pipetta Pasteur con una punta larga (fatta tagliando via 2-3 cm della punta). Regolare accuratamente la posizione delle fette sulla rete utilizzando una piccola siringa con un estremità ricurva. Posizionare le fette in modo tale da facilitare posizione degli elettrodi e la registrazione. Verificare che le fette sono sufficientemente circondati da ACSF ma non sono immerse o galleggiante (Figura 2C-D). Coprire la camera e incubare le fette per 2-3 ore.
NOTA: lo strato di cellule piramidali nelle fette sani dovrebbe mostrare una certa trasparenza.
4. Registrazione di CA3-CA1 Synaptic Risposte
NOTA: Il elettrofisiologia set-up utilizzato per la registrazione potenziale campo viene mostrato nella Figura 2A. A Faragabbia giorno è fortemente consigliato se l'interferenza elettrica è al di là del controllo dopo la corretta messa a terra delle impostazioni elettrici. Molti diversi tipi di camere sommerse e di interfaccia sono disponibili in commercio. Tuttavia, le camere di interfaccia sono preferiti come fette mostrano risposte sinaptiche più robuste in loro.
- Posizionamento degli elettrodi
- Accendere l'apparecchio elettrico (stimolatori e amplificatori) da utilizzare. Montare e fissare gli elettrodi stimolanti e registrazione nella titolari plexiglass dei micromanipolatori.
NOTA: Usiamo monopolare,, elettrodi in acciaio inox laccato rivestito di resistenza 5 MW sia per scopi di stimolanti e di registrazione. - Prima dell'uso, inserire questi elettrodi all'interno dei capillari di vetro tirato e fissarlo con colla epossidica esporre solo piccola parte della punta dell'elettrodo (Figura 2E). Questo dà forza agli elettrodi altrimenti sottili e aiuta a garantire saldamente nel eletitolari ctrode.
- Guidata al microscopio, posizionare l'elettrodo stimolante (s) in strato radiatum della regione CA1 di stimolare le fibre collaterali Schaffer e l'elettrodo di registrazione nella regione dendritico apicale CA1 per registrare (fEPSP) risposte di campo-EPSP.
NOTA: Avvicinandosi la superficie del liquido sopra la fetta con gli elettrodi dà un suono che consente di individuare rapidamente la superficie della fetta (fornito, l'amplificatore è collegato ad un altoparlante). - In esperimenti di tagging e catturare sinaptiche, secondo la necessità dell'esperimento, posizione due o tre elettrodi stimolatori (S1, S2 o S3) su entrambi i lati dell'elettrodo di registrazione per stimolare due o più indipendenti ma sovrapposti ingressi. Posizionare le stimolanti e registrazione elettrodi circa 200 micron a parte.
- Se necessario, individuare un altro elettrodo di registrazione nello strato corneo pyramidale per la registrazione spike popolazione (Figura 3A) .Quando sia laelettrodi hanno toccato la fetta, utilizzando il software di acquisizione, dare una stimolazione di prova per garantire un adeguato segnale di fEPSP.
NOTA: Usiamo bifasico, impulsi di corrente costante (durata impulso 0,1 msec / semi-onda) per la stimolazione di prova. - Una volta ottenuto un vero e proprio segnale di fEPSP, abbassare con attenzione gli elettrodi circa 200 micron profondo utilizzando micrometrica movimento dei manipolatori. Lasciare 20 minuti per le fette di recuperare. Testare l'indipendenza percorso con un protocollo di facilitazione paired-pulse 27,28.
- Accendere l'apparecchio elettrico (stimolatori e amplificatori) da utilizzare. Montare e fissare gli elettrodi stimolanti e registrazione nella titolari plexiglass dei micromanipolatori.
- Relazione ingresso-uscita
- Determinare la relazione ingresso-uscita (stimolazione afferente vs fEPSP slope) per ciascun ingresso misurando il valore di pendenza in una gamma di intensità di corrente. Eseguire questo tra 20 μA a 100 mA. Quindi impostare l'intensità di stimolazione per ciascun ingresso per ottenere il 40% della massima pendenza fEPSP. Conservare il costante durante l'esperimento.
- Dopo 15-20 minuti, iniziare a registrare la linea di base. Monitorare il fEPSP versante strettamente in questo periodo e ripristinare la intensità dello stimolo se la pendenza oscilla oltre il 10% rispetto al valore impostato e avviare una nuova linea di base. Record almeno 30 minuti o 1 ora linea di base stabile prima di procedere.
NOTA: Per la prova o la stimolazione basale, usiamo quattro spazza di 0,2 Hz bifasico, costanti impulsi di corrente (0,1 msec per polarità) dati ogni 5 minuti. Una pendenza media di questi quattro risposte viene quindi considerata come una ripetizione. I segnali sono filtrati e amplificati da un amplificatore differenziale, digitalizzato mediante un convertitore analogico-digitale e monitorati online con software su misura.
- Induzione di LTP / LTD utilizzando protocolli di stimolazione
NOTA: Sia la LTP e LTD sono stati classificati come inizio e fine-LTP / LTD in base ai requisiti della sintesi proteica; quest'ultimo di traduzione che richiede e / o di trascrizione per la sua manutenzione in ritardo [per la revisione vedere 4]. Una varietà di paradigmi di stimolazione elettrica può specifically indurre le diverse forme di LTP e LTD.- WTET: 100 Hz, 21 bifasico impulsi di corrente costante (0,2 msec per fase).
- STET: Tre sequenze di 100 impulsi per un secondo (100 Hz) ogni 10 min (Pulse Width 0,2 msec per fase).
- 900 burst oltre una durata di 15 min. 1 scoppio si compone di 3 impulsi (0,2 larghezza msec) con un intervallo dell'impulso di 50 msec (20 Hz). L'intervallo tra l'esplosione è di 1 sec (numero totale di impulsi 2.700).
5. Pulizia di Slice Camera e sistema di perfusione
- Dopo la registrazione è finita, raccogliere i fettine di ippocampo per ulteriori analisi biochimiche oppure eliminare in modo appropriato. Chiudere il rubinetto CarboGen e regolatore di temperatura. Lavare il gorgogliatore CarboGen in acqua distillata.
- Pulire accuratamente la rete con una spazzola e acqua distillata. Lavare l'impianto per 15-20 minuti con acqua distillata a una portata maggiore. Una volta in 3-4 giorni, cambiare l'acqua distillata nelvano inferiore della camera e anche pulito la camera regolarmente con il 3% di perossido di idrogeno soluzione per evitare la crescita fungina.
Risultati
La metodologia descritta è stata utilizzata per studiare forme di lunga durata di LTP / LTD e le sue interazioni associativi, come il tagging sinaptica e cross-cattura da fettine di ippocampo acuti di ratti adulti. 23 Questa tecnica si è dimostrata efficace per esperimenti con entrambi i ratti (Wistar) e una varietà di topo ceppi 30,31. La metodologia è stata utilizzata con successo per le registrazioni stabili LTP fino a 8-12 ore. 32
Il 'tag' fissato dalla tetanizzazione debole un ingresso (S1) cattura l'indotto dalla forte tetanizzazione di un altro ingresso indipendente, ma si sovrappongono 'PRP "(S2, figura 3B, cerchi pieni) trasformando così la forma altrimenti in decomposizione di LTP (precoce -LTP) in S1 in una lunga durata di un (figura 3B, cerchi aperti) (Per il confronto di early-LTP indotta da WTET vedi 20,33). I PRP catturati dai debolitag set tetanizzazione non deve necessariamente venire dalla STET-indotta tardo-LTP, ma può anche essere fornita dal RIFOS indotta tardo-LTD. Questo tipo di interazione associativa positiva tra LTP e LTD è indicato come 'cross-codifica / capture'. Il WTET indotta precoce LTP in S1 viene rinforzato al tardo-LTP (Figura 3C, cerchi aperti) per catturare le PRP forniti dalla RIFOS indotta tardo-LTD in S2 (Figura 3C, cerchi pieni). Statisticamente significativo potenziamento o depressione è stato mantenuto in S1 e S2 in entrambi i casi rispetto al proprio basale (test di Wilcoxon, p <0,05).
Per l'interazione tag-PRP si verifichi, l'ordine temporale dei due eventi (debole-prima-strong / strong-prima-debole) non è cruciale finché la finestra di tempo tra i due eventi rimane entro la gamma di 30-60 minuti. Sarebbe saggio per includere una terza, indipendente, ma si sovrappongono sinaptica inmettere e usarlo come controllo basale per monitorare la stabilità di registrazioni. I protocolli di stimolazione elettrica utilizzati per indurre forme inizio e fine di LTP / LTD devono essere convalidati in esperimenti a singolo ingresso per la coerenza e l'affidabilità prima di utilizzarli in esperimenti STC. Vorremmo anche sottolineare l'importanza della metodologia di preparazione fetta descritta nel protocollo dopo il successo di questi esperimenti si basa molto sulla qualità delle fette.
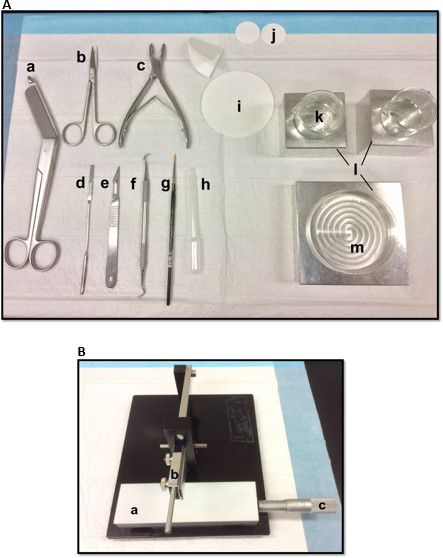
Figura 1. (A) Strumenti utilizzati per la dissezione dell'ippocampo: (a) Bandage Scissors (b) Iris forbici (c) Bone rongeur (d) spatola sottile, (e) il numero Scalpel 11 (f), scaler Sickle (g) Morbido pennello -bristle (h) di plastica pipetta Pasteur (i) carta da filtro (85 millimetri) (j), carta da filtro (30mm) (k), bicchieri di vetro (l) i blocchi di raffreddamento in alluminio per adattarsi capsula di Petri e bicchieripiatto (m) Petri. (B) chopper tessuto manuale. (a) Platform (b) Braccio con lama-porta (c) Vernier micrometro, risoluzione a 10 micron di taglio. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2. elettrofisiologia set-up per le registrazioni sul campo potenziale costituito da: (A) stimolatori (b) un amplificatore differenziale (c) un convertitore analogico-digitale (d) Oscilloscopio (e) computer con software di acquisizione (f) vibrazioni resistente da tavolo (g) Microscopio con> ingrandimento 4x (h) Interfaccia camera cervello-slice (i) un sistema di perfusione per ACSF e CarboGen fornitura (j) regolatore di temperatura (k) una fonte di illuminazione (l) manipolatori con i titolari degli elettrodi. (B) Interfaccia cervello-slicecamera. (C) e (D) fettine di ippocampo nella camera di interfaccia. elettrodo in acciaio (E) in acciaio sigillato in un capillare di vetro. Cliccate qui per vedere una versione più grande di questa figura.
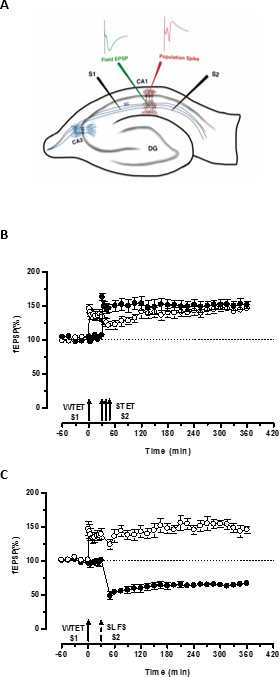
Figura 3. (A) Rappresentazione schematica di una fetta ed elettrodo posizione trasversale hippocampal per la registrazione campo potenziale: In questa rappresentazione, due elettrodi stimolanti (S1 e S2) sono posizionati nella radiatum strato della regione CA1 di stimolare due indipendenti ma sovrapposizione ingressi sinaptici sui neuroni CA1 piramidali. Due elettrodi di registrazione extracellulari, uno per registrare campo EPSP (potenziale eccitatorio post-sinaptico) dal vano dendritiche apicale e un altro per registrare somatica popolazione picco dalla cellula piramidalei corpi, si trovano nella radiatum strato e strato pyramidale rispettivamente. CA1- cornu Ammonis regione 1, CA3- cornu Ammonis regione 3, dentate DG- giro, fibre collaterali Silvia Cattori Schaffer, S1- stimolante elettrodi 1, elettrodo S2-stimolante 2. (B) debole prima forte paradigma per lo studio STC: tetanization debole (WTET) viene applicata a S1 (cerchi aperti) per indurre precoce LTP seguito da una forte tetanizzazione (STET) di S2 (cerchi pieni) a 30 min per indurre tardo-LTP. I primi-LTP in S1 viene rinforzato a tarda LTP mostrando tagging e catturare l'interazione (n = 6) (C) debole prima forte paradigma per lo studio cross-codifica:. Early-LTP è indotta da WTET in S1 (cerchi aperti) seguito per l'induzione di tardo-LTD a S2 (cerchi pieni) con RIFOS dopo 30 minuti. Nella S1, il precoce LTP è trasformato in tarda LTP durata 6 ore mostrando cross-tagging e cattura (n = 6). Freccia singola rappresenta tetanizzazione debole domanda per indurre precoce LTP. Tripletta di frecce rappresentaforte tetanizzazione per indurre tardo-LTP. La freccia tratteggiata rappresenta il punto di tempo in cui è stato RIFOS applicata all'ingresso sinaptica rappresentante per indurre ritardo-LTD. Le barre di errore indicano SEM. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Acuta fetta dell'ippocampo è un ottimo sistema modello per lo studio di LTP e altri processi di plasticità funzionali quali STC e cross-cattura. Conserva gran parte della rete strutturale laminare dei circuiti ippocampali, consente precise posizioni degli elettrodi e offre a fianco, una piattaforma aperta per una rapida manipolazione neurofarmacologico senza barriera emato-encefalica.
Questo articolo descrive la metodologia per la preparazione di vitali fettine di ippocampo acute da giovani ratti adulti e li utilizzano per indagare STC e cross-tagging. Precedenti ricerche hanno sottolineato che il genere e l'età degli animali sono fattori importanti da considerare per l'utilizzo in studi di elettrofisiologia. Sono usati 27,28 Pertanto giovani animali adulti con funzioni recettoriali adulti pienamente espressi (ratti maschi Wistar di età compresa tra 5-7 settimane). 23 Asimmetrie nei collegamenti tra i ippocampo sinistro e destro sono stati osservati nei roditori e 29grandi differenze di espressione del recettore NMDA sono stati segnalati come pure 34. Abbiamo usato l'ippocampo destro, per essere coerenti con i nostri studi precedenti LTP. 23,32 Tuttavia, una delle due ippocampi possiamo essere usato fino a quando la consistenza è mantenuta.
Come in qualsiasi protocollo, è molto importante per eseguire l'isolamento e affettare procedure rapidamente, ma facendo attenzione che il tessuto non viene allungato, danneggiato, resa secca o ipossica. Le variazioni di pH, temperatura e composizione ionica delle soluzioni possono avere profondi effetti sulla vitalità delle fette e dei risultati. Quindi tali variazioni dovrebbero essere evitati. È stato osservato che il glutammato di rilascio del calcio dipendente dal recettore si verificano durante le fasi di preparazione può influire irreversibilmente la sintesi proteica nel tessuto nervoso 35,36, 37. Utilizzando affettatrici manuali tessuto può aiutare a minimizzare questo permettendo il processo sia completato molto rapidamente rispetto a vibraslicers. Tuttavia, molti laboratori anche un uso efficace delle vibraslicers con le precauzioni necessarie per preservare la vitalità fetta. Un altro fattore importante da considerare è il lungo periodo di incubazione prima di iniziare gli esperimenti. Questo è stato notato per essere davvero cruciale per raggiungere la stabilità in statali e attivazione chinasi livelli metabolici le fette dopo il disturbo causato durante la preparazione 23. Tale stabilità è necessaria per coerenza registrazioni a lungo termine. Abbiamo sottolineare nuovamente su questa osservazione e suggeriamo le lunghe ore di incubazione di circa 3 ore.
Una varietà di parametri di stimolazione sono noti per indurre LTP, ma i meccanismi molecolari indotte in ogni caso, non può essere lo stesso (per una rassegna vedi 38). Ciò può influenzare la durata e altre caratteristiche della LTP, che, a loro volta, possono influenzare i risultati di codifica e la cattura esperimenti sinaptici. Quindi è importante per convalidare i paradigmi di stimolazione e le caratteristichedel elicitati LTP nelle condizioni di laboratorio eseguire e mantenere la coerenza.
In genere non consideriamo gli esperimenti con grandi raffiche fibra presinaptici e con fEPSPs massimi inferiori a 0,5 mV e gli esperimenti che comportano cambiamenti sostanziali nella fibra volley durante le registrazioni vengono respinte. Inoltre, durante l'esecuzione di due o tre pathway pathway esperimenti, è importante garantire l'indipendenza pathway. Questo può essere effettuato con un protocollo di facilitazione paired-pulse 28.
Uno svantaggio dei sistemi di registrazione di interfaccia è la formazione di gocce di condensa sugli elettrodi durante le ore di registrazione lunghi a causa delle differenze di temperatura e umidità tra la camera e l'ambiente circostante. Queste goccioline devono essere attentamente cancellato di volta in volta. In caso contrario, le goccioline può gocciolare sul fette e causare disturbi o addirittura la perdita dei segnali. Noi di solito affrontiamo questo by abilmente blotting goccioline guidate al microscopio utilizzando una sottile carta da filtro stoppino, senza toccare gli elettrodi. Tuttavia, la soluzione migliore sarebbe quella di utilizzare un sistema di riscaldamento centralizzato, come il sistema ETC sviluppato da ricercatori dell'Università di Edimburgo.
In una nota conclusiva, una varietà di metodologie esistenti nei laboratori nel mondo che sono utilizzati per la preparazione di fettine ippocampali per diversi scopi sperimentali. Ciascuna della procedura offre alcuni vantaggi rispetto all'altro. Uno ha bisogno di ottimizzare attentamente i minimi dettagli del protocollo per soddisfare lo scopo dell'esperimento. Speriamo che questo articolo aiuta a migliorare alcuni aspetti della metodologia per lo studio dei processi tardo-associativo, come STC e cross-cattura.
Divulgazioni
L'accesso aperto per questo articolo il video è sponsorizzato da Cerebos Pacific Limited.
Riconoscimenti
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
Materiali
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Riferimenti
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon