Method Article
Enquête de Synaptic étiquetage / capture et de la Croix-capture à l'aide aiguë coupes d'hippocampe des rongeurs
Dans cet article
Résumé
This video article describes experimental procedures to study long-term plasticity and its associative processes such as synaptic tagging, capture and cross-tagging in the CA1 pyramidal neurons using acute hippocampal slices from rodents.
Résumé
Synaptic tagging and capture (STC) and cross-tagging are two important mechanisms at cellular level that explain how synapse-specificity and associativity is achieved in neurons within a specific time frame. These long-term plasticity-related processes are the leading candidate models to study the basis of memory formation and persistence at the cellular level. Both STC and cross-tagging involve two serial processes: (1) setting of the synaptic tag as triggered by a specific pattern of stimulation, and (2) synaptic capture, whereby the synaptic tag interacts with newly synthesized plasticity-related proteins (PRPs). Much of the understanding about the concepts of STC and cross-tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the laboratories are still unable to study these processes. Experimental conditions for the preparation of hippocampal slices and the recording of stable late-LTP/LTD are extremely important to study synaptic tagging/cross-tagging. This video article describes the experimental procedures to study long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Introduction
The encoding and storage of information in the brain still remains the most significant and keenly pursued challenge in neuroscience. Over the years, long-term potentiation (LTP) and long-term depression (LTD) have emerged as the leading cellular correlates of memory1,2. These activity dependent changes, which exhibit input specificity and associativity, result in the stabilization of memory traces in the neuronal networks 1,3,4. The maintenance of the two forms of synaptic plasticity requires the synthesis of plasticity-related products (PRPs)5-10. Synapse specificity that involves the interaction of newly synthesized protein only with specific activated synapses expressing LTP or LTD, is critical to memory. This specificity is explained by the concept of ‘Synaptic Tagging and Capture’ (STC), where the PRPs interact with recently active, ‘tagged’ synapses11,12. The STC process offers a framework for associative properties of memories at the cellular level. It provides us with a conceptual basis of how short-term forms of plasticity are transformed into long-lasting forms of plasticity in an associative and time-dependent manner13.
During the process of STC, a strong tetanization in one input that leads to protein synthesis dependent late-LTP, results in the reinforcement of a protein synthesis independent early-LTP induced in another independent input on to the same population of neurons into a persistent one13. The setting of a local synaptic tag by a transient neural activity and the synthesis of the diffusible PRPs by the strong neural activity are the two key events during STC13,14. The capture of the PRPs by the recently potentiated ‘tagged’ synapses is fundamental to the maintenance of long-term potentiation. Many studies have been done to confirm the existence of STC phenomenon15-17 and identify the candidate ‘tags’18 and ‘PRPs’19. Calcium/calmodulin-dependent protein kinase II (CaMKII) and extracellular signal-regulated kinase1/2 (ERK1/2); CaMKIV, Protein Kinase M (PKM) and brain-derived neurotrophic factor (BDNF) are some of the candidate molecules for ‘tag’ and ‘PRP’ respectively19-21. The synaptic tagging model has further been expanded to include the positive associative interactions between LTP and LTD - the “synaptic cross-tagging”22. In synaptic cross-tagging, a late LTP/ LTD in one synaptic input transforms the opposite protein synthesis-independent early-LTD/LTP in an independent input into its long-lasting form or vice versa22.
The hippocampal slice preparation is the most widely used model in the studies of long-term synaptic plasticity23,24. Much of the understanding about the concepts of synaptic tagging and cross- tagging arises from the studies done in CA1 region of the hippocampus and because of the technical complexity many of the labs are still unable to study these processes. Experimental conditions for the preparation of rat hippocampal slices and the recording of stable late-LTP/LTD for extended hours are extremely important to study synaptic tagging/cross-tagging23,25,26. This article describes the detailed experimental procedures for studying long-term plasticity processes such as STC and cross-tagging in the CA1 pyramidal neurons using stable, long-term field-potential recordings from acute hippocampal slices of rats.
Protocole
Toutes les procédures d'animaux ont été approuvés par le Comité institutionnel de protection des animaux et l'utilisation (IACUC) de l'Université nationale de Singapour.
1. Préparation de céphalo-rachidien artificiel Fluid (ACSF)
- Préparer le ACSF constitué de (en mM) 124 NaCl, 3,7 KCl, 1,0 MgSO 4, 7H 2 O, 2,5 CaCl 2, 2H 2 O, 1,2 KH 2 PO 4, 24,6 NaHCO 3, et 10 D-glucose. Vérifiez que le pH de l'ACSF est comprise entre 7,2 à 7,4 lorsque barboter jusqu'à saturation avec 95% O 2 et 5% de CO 2 du mélange (carbogène). 21 L'utilisation de cette ACSF à la fois pour la dissection, la préparation de la tranche et pour perfusion pendant les enregistrements électrophysiologiques.
REMARQUE: Utiliser un appareil propre pour mesurer et maintenir le ACSF. En utilisant un appareil impur peut conduire à des solutions ou la formation de précipités nuageux. Utilisez de l'eau déminéralisée pour tous les préparatifs. - Préparer un 2 L 10x ACSF Stock exclusion NaHCO 3 D-glucose et dans une fiole jaugée. Ajouter des réactifs à l'eau désionisée dans l'ordre suivant: NaCl (144.96g), KCl (5.52g), MgSO 4, 7H 2 0 (4,92 g), du CaCl 2, 2H 2 0 (7,56 g), du KH 2 PO 4 (3,28 g) et le haut jusqu'à un volume de 2 L. Remuer continuellement pendant au moins 30 minutes en utilisant un agitateur magnétique pour assurer que tous les réactifs sont dissous. Rangez le stock dans 4 o C et utiliser dans les 2 semaines.
- Avant la dissection et les expériences, diluer le bouillon ACSF dans une fiole jaugée avec l'addition de quantités requises de NaHCO 3 et D-glucose. Pour 1 L solution, diluer 100 ml de stock de 1 L après avoir ajouté 2,07 g de NaHCO 3 et 1.802 g de D-glucose. L'ACSF devrait être une solution libre de tout précipité ou des particules non dissoutes.
- Refroidir environ 200-300 ml de l'ACSF sur la glace, pour être utilisé lors de la dissection. Assurez-vous que l'ACSF utilisé pour la dissection est comprise entre 2-4 ° C. Utilisez l'ACSF restant pour electrophysiological expériences. Bubble toutes les solutions de l'ACSF à saturation avec du carbogène (5% de CO2, 95% de O 2) en continu. En attendant l'ACSF refroidir, préparer la zone de dissection et la chambre de tranche.
2. Préparation de la Chambre Interface
REMARQUE: Une chambre à règle interface cerveau, utilisé pour l'incubation des tranches et leur maintien pendant les enregistrements électrophysiologiques (figure 2B), est composée de deux compartiments. La chambre inférieure contient de l'eau distillée maintenue à 32 ° C par un régulateur de température et fait barboter en continu avec du carbogène.
- Mettez le régulateur de température et de prérégler à 32 ° C. Lavez la chambre supérieure de 10 à 15 min en exécutant l'eau distillée à travers la tubulure d'admission. Assurez-vous que la chambre supérieure est propre avant de placer le filet. Vérifiez que le niveau d'eau dans la chambre inférieure est d'environ 70% rempli d'eau distillée.
- Placer lenet dans la chambre supérieure pour fournir une surface de repos pour les tranches (figure 2C). Ajuster le tube d'écoulement afin d'assurer que le niveau de la solution est suffisamment mouille toute la surface du filet. Placer le couvercle au-dessus du filet de maintenir une atmosphère humidifiée carbogène intérieur de la chambre supérieure.
- Réglez le taux à 1 ml / min de débit. Maintenir ce débit pendant toute la période tranche d'incubation et l'expérience. Commencez carbogenating l'ACSF 1x fraîchement préparé et plonger le tube d'entrée dans l'ACSF. Laisser 20 min pour le ACSF à être saturé avec du carbogène et la chambre supérieure pour être rempli avec elle.
3. Préparation des aigus hippocampe tranches
NOTE: Le protocole de dissection se compose de (1) Elimination du cerveau de l'animal dans l'ACSF et froid (2) Isolement et le tranchage de l'hippocampe. Pour neurones de rester viables, isoler et placer le cerveau froid ACSF rapidement et complètent l'ensembleprocessus, y compris le tranchage dans 3-5 min.
- Retrait du cerveau dans ACSF froid
- Disposer les outils de dissection de la manière représentée sur la figure 1A. Disposer les outils en fonction de l'ordre d'utilisation pour faciliter le processus de dissection. Avant de commencer, assurez-vous tous les outils de dissection sont prêts.
- Monter une lame de rasoir, nettoyé avec de l'acétate d'éthyle, de l'éthanol absolu et d'eau distillée, sur le tissue chopper manuel (figure 1B), fixez-le fermement et veiller à ce que le bord de coupe est uniformément aligné. Essai découper un morceau de papier filtre pour faire en sorte que la lame est solidement fixé. Réglez le coulissement Vernier micromètre à sa position de départ.
- Euthanasier l'animal à l'aide de dioxyde de carbone (CO 2) dans une chambre d'induction et décapiter avec des ciseaux à pansements ou Guillotine. Utilisation d'un ciseau Iris, enlever la peau et de la fourrure au-dessus du crâne. Faire une coupe à travers la partie postérieure de retirer le brainstem.Make une petite incision le long èmee côté droit du crâne et une incision plus sur la gauche.
ATTENTION! Faire seulement une petite incision sur le côté qui est utilisé pour les expériences d'éviter de l'endommager. Lors de l'insertion des ciseaux, assurez-vous que la force appliquée est vers le haut pour éviter d'endommager le cerveau. - Retirez délicatement le crâne avec un os rongeur à partir de la gauche sur le côté droit du crâne pour révéler le cortex. Une fine couche de dure-mère peut aussi être vu. Retirez délicatement les plaques frontales avec le rongeur. Enlever la plupart de la dure avec les plaques frontales.
ATTENTION! Veillez à ce que la dure-mère ne tranche pas à travers les tissus du cerveau. - Retirer la dure-mère restant, le cas échéant, en particulier dans la jonction entre le cortex et le cervelet avec l'extrémité plate d'une spatule. Pour les étapes 3.1.5 et 3.1.6, maintenir la pression vers le haut-à-dire, loin du cerveau pour éviter de l'endommager. Aide de la spatule, délicatement ramasser le cerveau dans une boîte de Pétri remplie de froid et ACSF carbogenated (2-4 ° C), placed sur un bloc de refroidissement de l'aluminium.
- Isolement de l'hippocampe
- Avec un scalpel, faire une coupe droite pour supprimer le cervelet et une autre coupe pour enlever la partie antérieure du cerveau (environ un quart). Faites une entaille peu profonde le long de la ligne médiane.
- Retirez délicatement le cortex avec un scaler faucille, à partir de la ligne médiane de révéler l'hippocampe dorsal. Retirer la couche de cortex dessus de l'hippocampe. Utilisez les doigts ou des pinces inclinées pour soutenir le cerveau. Faites une petite coupure à la commissure hippocampique. Retirez délicatement l'hippocampe avec le scaler faucille à partir de l'hippocampe dorsal en utilisant des mouvements de roulement.
ATTENTION! Soyez doux pour éviter d'étirement et de déchirer l'hippocampe. - Retirez tout le cortex et les tissus conjonctifs autour de l'hippocampe isolé avec le scaler faucille.
- Découper le tissu hippocampique et le transfert des tranches sur la chambre d'interface
- Placez un morceau de ACSF-papier filtre imbibé (grade 1, 30 mm) sur la scène de tranchage de la trancheuse manuel. Scoop et placer le tissu hippocampique sur le papier filtre. Déplacer le papier filtre afin d'aligner l'hippocampe lors d'une orientation correcte par rapport à la lame de la trancheuse de manière que l'hippocampe est découpé en formant un angle d'environ 70 o à la fimbria.
- Éponger l'excès de solution entourant le tissu hippocampique avec un papier filtre plissé (grade 1, 85 mm) en laissant l'hippocampe légèrement humide. Commencez trancher l'hippocampe transversalement. Slice et jeter les tissus de l'extrémité de l'hippocampe où la morphologie de la tranche est pas clair.
- Couper le tissu restant dans 400 tranches um d'épaisseur. Pick-up tranches d'hippocampe doucement de la lame avec une brosse à poils souples en utilisant les mouvements de glisser en douceur et placer les tranches dans un petit gobelet rempli d'ACSF carbogenated froid. Effectuer les étapes 3.3.1-3.3.3 aussi rapidement que possible, car le tissu hippocampique est exposé à l'air.
NOTE: En général les deux tiers de l'hippocampe est tranché, et 4-6 tranches avec une morphologie clair peuvent être préparés. - Transférer les tranches doucement sur le net dans la chambre de tranche en utilisant une pipette en plastique propres de Pasteur avec une pointe large (fait en coupant 2-3 cm de la pointe). Ajustez soigneusement la position des tranches sur le net en utilisant une petite seringue avec une pointe recourbée. Placer les tranches d'une manière qui facilite la localisation de l'électrode et l'enregistrement. Assurez-vous que les tranches sont suffisamment entourés par ACSF mais ne sont pas submergés ou flottant (Figure 2C-D). Couvrir la chambre et incuber les tranches pendant 2-3 heures.
NOTE: La couche de cellules pyramidales dans les tranches sains devrait montrer une certaine transparence.
4. Enregistrement de réponses CA3-CA1 synaptiques
NOTE: L'électrophysiologie set-up utilisé pour le champ enregistrement potentiel est illustré à la figure 2A. A Faracage de jour est fortement recommandée si l'interférence électrique est hors du contrôle après la terre correcte des paramètres électriques. De nombreux types de chambres submergées et d'interface sont disponibles dans le commerce. Cependant, les chambres de l'interface sont préférés comme tranches présentent plus robustes réponses synaptiques en eux.
- Positionnement d'électrodes
- Allumez l'appareil électrique (stimulateurs et amplificateurs) qui seront utilisés. Montez et assurez les stimulants et d'enregistrement des électrodes dans les porteurs de micromanipulateurs de plexiglas.
NOTE: Nous utilisons monopolaire, électrodes en acier inoxydable laquées de résistance 5 MQ pour les deux fins de stimulation et d'enregistrement. - Avant l'utilisation, insérer ces électrodes à l'intérieur des capillaires de verre tiré et la fixer avec de la colle époxy exposer seulement petite partie de la pointe de l'électrode (figure 2E). Cela donne de la force aux électrodes contraire minces et permet de les fixer solidement dans le ELEdétenteurs ctrode.
- Guidée sous le microscope, placer l'électrode (s) de stimulant dans le stratum radiatum de la région CA1 de stimuler les fibres collatérales de Schaffer et l'électrode d'enregistrement dans la région dendritique apicale de CA1 à enregistrer (fEPSP) les réponses de terrain-EPSP.
NOTE: En approchant de la surface du liquide au-dessus de la tranche avec les électrodes donne un son qui permet de localiser rapidement la surface de la tranche (fourni, l'amplificateur est connectée à un haut-parleur). - Dans des expériences de marquage et de capture synaptiques, selon les besoins de l'expérience, la position deux ou trois électrodes de stimulation (S1, S2 ou S3) de chaque côté de l'électrode d'enregistrement afin de stimuler deux ou plusieurs entrées indépendantes mais qui se chevauchent. Placer les électrodes stimulantes et d'enregistrement d'environ 200 um à part.
- Si nécessaire, recherchez une autre électrode d'enregistrement dans la couche cornée de pyramidale pour l'enregistrement pic de population (figure 3A) .Lorsque la fois leélectrodes ont touché la tranche, en utilisant le logiciel d'acquisition, donner une stimulation de test pour assurer un bon signal fEPSP.
NOTE: Nous utilisons biphasique, impulsions de courant constant (durée d'impulsion 0,1 ms / demi-ondes) pour la stimulation de test. - Une fois un signal approprié fEPSP est obtenue, baissez doucement les électrodes environ 200 um de profondeur en utilisant les boutons de mouvement fin des manipulateurs. Autoriser 20 min pour les tranches de récupérer. Testez l'indépendance de la voie avec un double choc protocole de facilitation 27,28.
- Allumez l'appareil électrique (stimulateurs et amplificateurs) qui seront utilisés. Montez et assurez les stimulants et d'enregistrement des électrodes dans les porteurs de micromanipulateurs de plexiglas.
- Relation d'entrée-sortie
- Déterminer la relation d'entrée-sortie (vs stimulation afférente fEPSP pente) pour chaque entrée, en mesurant la valeur de pente à une gamme d'intensités de courant. Effectuez cette entre 20 uA à 100 uA. Ensuite, réglez l'intensité de stimulation pour chaque entrée pour obtenir 40% de la pente maximale fEPSP. Maintenir cette constante tout au long de l'expérience.
- Après 15-20 minutes, commencer à enregistrer la ligne de base. Surveiller la fEPSP pente de près pendant cette période et réinitialiser l'intensité du stimulus si la pente varie de plus de 10% de la valeur de consigne et de commencer une nouvelle ligne de base. Enregistrez au moins 30 minutes ou 1 heure de référence stable avant de poursuivre.
REMARQUE: Pour le test ou la stimulation de base, nous utilisons quatre balayages de 0,2 Hz biphasique, impulsions de courant constant (0,1 ms par polarité) donnés toutes les 5 min. Une pente moyenne de ces quatre réponses est alors considérée comme une répétition. Les signaux sont amplifiés et filtrés par un amplificateur différentiel, numérisé au moyen d'un convertisseur analogique-numérique et un suivi en ligne avec le logiciel fait sur mesure.
- L'induction de LTP / LTD en utilisant des protocoles de stimulation
REMARQUE: Les deux LTP et LTD ont été classés comme début et fin-LTP / LTD basée sur les exigences de la synthèse des protéines; cette dernière nécessitant une traduction et / ou la transcription de son entretien fin [pour revue, voir 4]. Une variété de paradigmes de stimulation électrique peut specifically amener les différentes formes de LTP et LTD.- WTET: 100 Hz, 21 impulsions de courant biphasique constants (0,2 ms par phase).
- STET: Trois éclats de 100 impulsions pour une seconde (100 Hz) toutes les 10 min (Pulse Width 0,2 ms par phase).
- 900 salves sur une durée de 15 min. 1 rafale se compose de 3 impulsions (0,2 ms de largeur) avec un intervalle entre de 50 ms (20 Hz). L'intervalle de rafale est entre 1 sec (nombre total d'impulsions 2700).
5. Nettoyage Slice Chambre et système de perfusion
- Après l'enregistrement est terminé, recueillir les tranches d'hippocampe pour plus d'analyse biochimique ou encore jeter de manière appropriée. Coupez l'alimentation de carbogène et régulateur de température. Laver le barboteur carbogène dans l'eau distillée.
- Nettoyez le filet soigneusement avec une brosse et de l'eau distillée. Laver la plate-forme pendant 15-20 min avec de l'eau distillée à un débit plus élevé. Une fois dans les 3-4 jours, changer l'eau distillée dans lecompartiment inférieur de la chambre et la chambre propre également régulièrement avec une solution de peroxyde d'hydrogène à 3% pour éviter la croissance fongique.
Résultats
La méthodologie décrite a été utilisée pour étudier les formes durables de LTP / LTD et ses interactions associatives telles que le marquage synaptique et cross-capture à partir des tranches d'hippocampe aigus de rats adultes. 23 Cette technique a prouvé son efficacité pour des expériences avec des rats (Wistar) et une variété de souches de souris 30,31. La méthodologie a été utilisée avec succès pour les enregistrements de LTP stables jusqu'à 12.08 h. 32
Le «tag» fixé par le faible tétanisation d'une entrée (S1) capte l'induite par la forte tétanisation d'un autre indépendant, mais se chevauchent entrée «PRP» (S2; figure 3B, cercles pleins) ainsi transformer le contraire en décomposition sous forme de LTP (début -LTP) en S1 en une longue durée (figure 3B, cercles ouverts) (A titre de comparaison de la petite-LTP induite par WTET voir 20,33). Les PRP capturés par les faiblesjeu de tétanisation tag ne doit pas nécessairement venir des induite STET-fin-LTP, mais peut aussi être fournie par l'ESPA induite tardive LTD. Ce type d'interaction associative positive entre LTP et LTD est dénommé «cross-tagging / capture '. Le début LTP WTET-induite dans S1 se renforce à la fin-LTP (figure 3C, cercles ouverts) en capturant les PRP fournis par l'ESPA induite tardive LTD en S2 (figure 3C, cercles pleins). Statistiquement potentialisation ou une dépression importante a été maintenu dans S1 et S2 dans les deux cas par rapport à sa propre ligne de base (test de Wilcoxon; P <0,05).
Pour l'interaction de l'étiquette-PRP de se produire, l'ordre temporel des deux événements (faible-avant-forte / strong-avant-faible) est pas crucial tant que la fenêtre de temps entre les deux événements reste dans la fourchette de 30-60 minutes. Il serait sage d'inclure un troisième, indépendante mais qui se chevauchent synaptique dansmettre et l'utiliser comme un contrôle de base pour surveiller la stabilité des enregistrements. Les protocoles de stimulation électrique utilisés pour induire formes précoce et tardive de LTP / LTD doivent être validés dans des expériences à une seule entrée pour la cohérence et la fiabilité avant de les utiliser dans des expériences STC. Nous tenons également à souligner l'importance de la méthodologie de préparation de tranches décrite dans le protocole depuis le succès de ces expériences dépend fortement de la qualité des tranches.
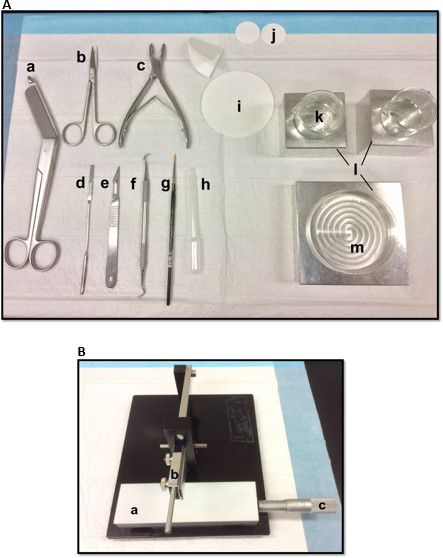
Figure 1. (a) des outils utilisés dans la dissection de l'hippocampe: (a) Bandage Ciseaux (b) Iris ciseaux (c) os rongeur (d) de la spatule mince, (e) Numéro de Scalpel 11 (f) scaler Sickle (g) souple pinceau -bristle (h) de pipette en plastique Pasteur (i) un papier filtre (85mm) (j) de papier filtre (30mm) (k) de gobelets en verre (l) blocs de refroidissement en aluminium pour adapter boîte de Pétri et béchersplat (m) Petri. (B) de tissue chopper Manuel. (a) la plate-forme (b) coupe le bras avec porte-lame (c) Vernier micromètre, la résolution de 10 microns. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. électrophysiologie mise en place pour les enregistrements de champ potentiel constitué par (a) des stimulateurs (b) un amplificateur différentiel (c) un convertisseur analogique-numérique (d) Oscilloscope (e) ordinateur avec un logiciel d'acquisition (f) aux vibrations de table résistante (g) de microscope avec> un grossissement de 4x (h) Interface chambre cerveau tranche (i) un système de perfusion pour l'ACSF et carbogène alimentation (j) contrôleur de température (k) une source d'éclairage (L) manipulateurs avec des porte-électrodes. (B) Interface cerveau-slicechambre. (C) et (D) des tranches d'hippocampe dans la chambre de l'interface. d'électrodes en acier (E) inoxydable scellé dans un capillaire de verre. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
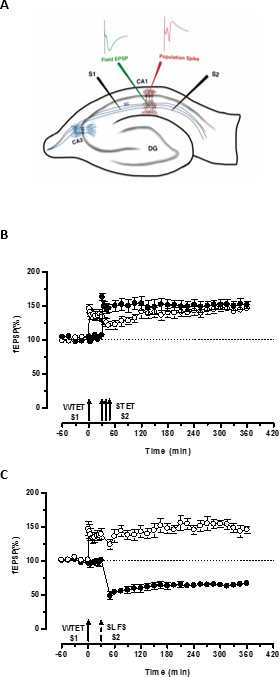
Figure 3. (A) Représentation schématique d'une tranche et l'électrode emplacement hippocampique transversal pour l'enregistrement du champ potentiel: Dans cette représentation, les deux électrodes de stimulation (S1 et S2) sont positionnés dans le stratum radiatum de la région CA1 de stimuler deux indépendants mais se chevauchant entrées synaptiques sur les neurones pyramidaux CA1. Deux électrodes d'enregistrement extracellulaires, d'enregistrer un champ EPSP (potentiel excitateur post-synaptique) du compartiment dendritique apicale et un autre pour Somatic pic de population de la cellule pyramidalecorps, sont situés dans le stratum radiatum et strate pyramidale respectivement. CA1- corne d'Ammon région 1, CA3- corne d'Ammon région 3, dentées DG gyrus, fibres collatérales SC- Schaffer, S1-électrode de stimulation 1, l'électrode de stimulation S2 2. (B) avant Faible forte paradigme pour étudier STC: tétanisation Faible (WTET) est appliquée au S1 (cercles ouverts) pour induire début LTP suivie par une forte tétanisation (STET) de S2 (cercles pleins) à 30 min pour induire la fin de LTP. Le début de LTP dans S1 se renforce à la fin-LTP montrant marquage et de capturer l'interaction (n = 6) (C) faible devant forte paradigme pour étudier croix-tagging:. Early-LTP est induite par WTET dans S1 (cercles ouverts) suivie par l'induction de la fin-LTD dans S2 (cercles pleins) en utilisant ESPA après 30 min. En S1, le début LTP est transformée à la fin-LTP durée 6 h montrant croix-tagging et de capture (n = 6). Seule flèche représente tétanisation faibles appliquée pour induire début LTP. Triplet de flèches représentetétanisation forte pour induire la fin de LTP. La flèche en pointillés représente le point où ESPA a été appliqué à l'entrée synaptique représentant pour induire fin LTD-temps. Les barres d'erreur représentent la SEM. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Tranche de l'hippocampe aiguë est un excellent modèle pour l'étude de la LTP et d'autres processus de plasticité fonctionnels tels que STC et de contre-capture. Elle conserve une grande partie du réseau structurel laminaire des circuits de l'hippocampe, permet emplacements des électrodes précis et offre à côté, une plate-forme ouverte pour la manipulation neuropharmacologique rapide sans barrière hémato-encéphalique.
Cet article décrit la méthodologie pour la préparation des tranches d'hippocampe aigus viables à partir de jeunes rats adultes et de les utiliser pour enquêter STC et croix-tagging. Une recherche antérieure a souligné que le sexe et l'âge des animaux sont des facteurs importants à considérer pour une utilisation dans les études d'électrophysiologie. 27,28 conséquent animaux adultes, jeunes avec des fonctions de récepteurs adultes pleinement exprimées (rats Wistar mâles âgés de 5-7 semaines) sont utilisés. 23 asymétries dans les connexions entre l'hippocampe gauche et droite ont été notés chez les rongeurs 29 etde grandes différences dans l'expression des récepteurs NMDA ont été rapportés ainsi 34. Nous avons utilisé l'hippocampe droit afin d'être compatible avec nos études précédentes LTP. 23,32 Cependant, que ce soit des hippocampes peut être utilisé aussi longtemps que la cohérence est maintenue.
Comme dans tout protocole, il est très important d'effectuer l'isolement et trancher rapidement les procédures mais en prenant soin que le tissu est pas étiré, endommagé, rendu sec ou hypoxique. Les variations de pH, la température et la composition ionique des solutions peuvent avoir effet profond sur la viabilité des tranches et les résultats. D'où de telles variations doivent être évités. Il a été observé que la libération de glutamate de calcium dépendant du récepteur se produisant au cours des étapes de préparation de façon irréversible peut affecter la synthèse des protéines dans les tissus nerveux 35,36, 37. Utilisation de trancheuses manuelles de tissu peut aider à minimiser ce en permettant au processus soit terminé très rapidement par rapport à vibraslicers. Cependant, de nombreux laboratoires utilisent aussi efficacement vibraslicers avec les précautions nécessaires pour préserver la viabilité tranche. Un autre facteur important à considérer est la longue période d'incubation avant de commencer les expériences. Cela a été noté pour être vraiment crucial pour parvenir à la stabilité des taux métaboliques de l'Etat et d'activation de la kinase dans les tranches après la perturbation provoquée lors de la préparation 23. Une telle stabilité est nécessaire pour la cohérence des enregistrements de longue durée. Nous soulignons de nouveau sur cette observation et suggérons les heures d'environ 3 heures d'incubation longues.
Une variété de paramètres de stimulation sont connus pour induire la LTP, mais les mécanismes moléculaires induits dans chaque cas peut ne pas être le même (pour revue, voir 38). Cela peut influer sur la durabilité et d'autres caractéristiques de la LTP, qui, à leur tour, peuvent affecter les résultats des expériences de marquage et de capture synaptiques. Par conséquent, il est important de valider les paradigmes de stimulation et caractéristiquesde la LTP obtenue dans des conditions de laboratoire performant et maintenir la cohérence.
En général, nous ne considérons pas les expériences avec de très grandes volées de fibres présynaptiques et fEPSPs maximale inférieure à 0,5 mV et les expériences impliquant des changements substantiels dans la reprise de volée de fibre pendant les enregistrements sont également rejetées. En outre, tout en réalisant des expériences de deux ou trois voie-voie, il est important de veiller à l'indépendance de la voie. Ceci peut être réalisé avec une double choc protocole de facilitation 28.
Un inconvénient des systèmes d'enregistrement de l'interface est la formation de gouttelettes de condensation sur les électrodes pendant les heures d'enregistrements de longue durée en raison des différences de température et d'humidité entre la chambre et les environs. Ces gouttelettes doivent être soigneusement effacé de temps à autre. Sinon, les gouttelettes peuvent couler sur les tranches et provoquer des perturbations ou même la perte de signaux. Nous abordons habituellement ce by buvard habilement les gouttelettes guidées sous le microscope en utilisant un mince papier filtre mèche, sans toucher les électrodes. Cependant, la meilleure solution serait d'utiliser un système de chauffage centralisé, tels que le système de télépéage mis au point par des chercheurs de l'Université d'Edimbourg.
Sur une note finale, une variété de méthodologies existent dans les laboratoires du monde entier qui sont utilisés pour la préparation des tranches d'hippocampe pour différentes fins expérimentales. Chaque procédure de l'offre certains avantages sur l'autre. Il faut optimiser attentivement les moindres détails du protocole pour répondre à l'objectif de l'expérience. Nous espérons que cet article contribue à améliorer certains aspects de la méthodologie pour étudier les processus fin associatif tels que STC et de contre-capture.
Déclarations de divulgation
Le libre accès pour cet article vidéo est parrainé par Cerebos Pacifique Limitée.
Remerciements
This video article is sponsored by Cerebos Pacific Limited. This work is supported by National Medical Research Council Collaborative Research Grant (NMRC-CBRG-0041/2013) and Ministry of Education Academic Research Funding (MOE AcRF- Tier 1 - T1-2012 Oct -02).
matériels
| Name | Company | Catalog Number | Comments |
| I. Dissection Tools | |||
| 1. Bandage scissors | KLS Martin, Germany | 21-195-23-07 | |
| B-Braun/Aesculap, Germany | LX553R | ||
| 2. Iris scissors | B-Braun/Aesculap, Germany | BC140R, | |
| BC100R | |||
| 3. Bone rongeur | World Precision Instruments (WPI), Germany | 14089-G | |
| 4. Scalpel | World Precision Instruments (WPI), Germany; | 500236-G | |
| B-Braun/Aesculap, Germany | |||
| BB73 | |||
| 5. Scalpel blade#11 | B-Braun/Aesculap, Germany | BB511 | |
| 6. Sickle scaler | KLS Martin, Germany | 38-685-00 | |
| 7. Angled forceps | B-Braun/Aesculap, Germany | BD321R | |
| 8. Anesthetizing/Induction chamber | MIP Anesthesia Technologies (Now, Patterson Scientific), Oregon | AS-01-0530-LG | |
| II. ACSF component chemicals | |||
| 1. Sodium chloride (NaCl) | Sigma-Aldrich | S5886 | |
| 2. Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| 3. Magnesium sulphate heptahydrate (MgSO4.7H20) | Sigma-Aldrich | M1880 | |
| 4. Calcium chloride dihydrate (CaCl2.2H2O) | Sigma-Aldrich | C3881 | |
| 5. Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P9791 | |
| 6. Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | |
| 7. D-Glucose anhydrous (C6H12O6) | Sigma-Aldrich | G7021 | |
| III. Electrophysiology Instruments | |||
| 1. Microscope | Olympus, Japan | Model SZ61 | |
| 2. Temperature Controller | Scientific Systems Design Inc. Canada | PTC03 | |
| 3. Differential AC Amplifier | AM Systems, USA | Model 1700 | |
| 4. Isolated Pulse Stimulator | AM Systems, USA | Model 2100 | |
| 5. Oscilloscope | Rhode & Schwarz | HM0722 | |
| 6. Digital-Analog Converter | Cambridge Electronic Design Ltd. Cambridge, UK | CED-Power 1401-3 | |
| 7. Interface Brain Slice Chamber | Scientific Systems Design Inc. Canada | BSC01 | |
| 8. Tubing Pump | Ismatec, Idex Health & Science, Germany | REGLO-Analog | |
| 9. Carbogen Flowmeter | Cole-Parmer | 03220-44 | |
| 10. Fiber Light Illuminator | Dolan-Jenner Industries | Fiber Lite MI-150 | |
| 11. Micromanipulators | Marzhauser Wetzlar, Germany | 00-42-101-0000 (MM-33) | |
| 00-42-102-0000 (MM-32) |
Références
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Siegelbaum, S. A., Kandel, E. R. Learning-related synaptic plasticity: LTP and LTD.. Current Opinion in Neurobiology. 1, 113-120 (1991).
- Martin, S. J., Grimwood, P. D., Morris, R. G. Synaptic plasticity and memory: an evaluation of the hypothesis. Annual review of neuroscience. 23, 649-711 (2000).
- Malenka, R. C., Bear, M. F. LTP and LTD: An Embarrassment of Riches. Neuron. 44, 5-21 (2004).
- Krug, M., Lossner, B., Ott, T. Anisomycin blocks the late phase of long-term potentiation in the dentate gyrus of freely moving rats. Brain research bulletin. 13, 39-42 (1984).
- Frey, U., Krug, M., Reymann, K. G., Matthies, H. Anisomycin blocks an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research. 452, 57-65 (1988).
- Otani, S., Marshall, C. J., Tate, W. P., Goddard, G. V., Abraham, W. C. Maintenance of long-term potentiation in rat dentate gyrus requires protein synthesis but not messenger RNA synthesis immediately post-tetanization. Neuroscience. 28, 519-526 (1989).
- Frey, U., Frey, S., Schollmeier, F., Krug, M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. The Journal of physiology. 490 (3), 703-711 (1996).
- Nguyen, P. V., Kandel, E. R. A macromolecular synthesis-dependent late phase of long-term potentiation requiring cAMP in the medial perforant pathway of rat hippocampal slices). The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 3189-3198 (1996).
- Manahan-Vaughan, D., Kulla, A., Frey, J. U. Requirement of translation but not transcription for the maintenance of long-term depression in the CA1 region of freely moving rats. The Journal of neuroscience : the official journal of the Society for Neuroscience. 20, 8572-8576 (2000).
- Frey, U., Morris, R. G. M. Synaptic tagging and long-term potentiation. Nature. 385, 533-536 (1997).
- Frey, U., Morris, R. G. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology. 37, 545-552 (1998).
- Redondo, R. L., Morris, R. G. Making memories last: the synaptic tagging and capture hypothesis. Nature reviews. Neuroscience. 12, 17-30 (2011).
- Martin, K. C., Kosik, K. S. Synaptic tagging -- who's it?. Nature reviews. Neuroscience. 3, 813-820 (2002).
- Frey, U., Morris, R. G. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences. 21, 181-188 (1998).
- Martin, K. C. Synaptic tagging during synapse-specific long-term facilitation of Aplysia sensory-motor neurons. Neurobiology of learning and memory. 78, 489-497 (2002).
- Shires, K. L., Da Silva, B. M., Hawthorne, J. P., Morris, R. G., Martin, S. J. Synaptic tagging and capture in the living rat. Nature communications. 3, (2012).
- Ramachandran, B., Frey, J. U. Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience. 29, 12167-12173 (2009).
- Sajikumar, S., Navakkode, S., Frey, J. U. Identification of compartment- and process-specific molecules required for 'synaptic tagging' during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience. 27, 5068-5080 (2007).
- Sajikumar, S., Navakkode, S., Sacktor, T. C., Frey, J. U. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 5750-5756 (2005).
- Redondo, R. L., et al. Synaptic Tagging and Capture: Differential Role of Distinct Calcium/Calmodulin Kinases in Protein Synthesis-Dependent Long-Term Potentiation. The Journal of Neuroscience. 30, 4981-4989 (2010).
- Sajikumar, S., Frey, J. U. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiology of learning and memory. 82, 12-25 (2004).
- Sajikumar, S., Navakkode, S., Frey, J. U. Protein synthesis-dependent long-term functional plasticity: methods and techniques. Current Opinion in Neurobiology. 15, 607-613 (2005).
- Villers, A., Ris, L. Improved preparation and preservation of hippocampal mouse slices for a very stable and reproducible recording of long-term potentiation. Journal of visualized experiments : JoVE. , (2013).
- Pohle, W., Reymann, K., Jork, R., Malisch, R. The influence of experimental conditions on the morphological preservation of hippocampal slices in vitro. Biomedica biochimica acta. 45, 1145-1152 (1985).
- Reymann, K. G., et al. The duration of long-term potentiation in the CA1 region of the hippocampal slice preparation. Brain research bulletin. 15, 249-255 (1985).
- Sajikumar, S., Korte, M. Different compartments of apical CA1 dendrites have different plasticity thresholds for expressing synaptic tagging and capture. Learning & Memory. 18, 327-331 (2011).
- Li, Q., et al. Making Synapses Strong: Metaplasticity Prolongs Associativity of Long-Term Memory by Switching Synaptic Tag Mechanisms. Cerebral Cortex. 24, 353-363 (2014).
- Sajikumar, S., Frey, J. U. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neuroscience Letters. 338, 147-150 (2003).
- Ishikawa, Y., Tamura, H., Shiosaka, S. Diversity of neuropsin (KLK8)-dependent synaptic associativity in the hippocampal pyramidal neuron. The Journal of physiology. 589, 3559-3573 (2011).
- Ishikawa, Y., Horii, Y., Tamura, H., Shiosaka, S. Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience. 28, 843-849 (2008).
- Sajikumar, S., Morris, R. G. M., Korte, M. Competition between recently potentiated synaptic inputs reveals a winner-take-all phase of synaptic tagging and capture. Proceedings of the National Academy of Sciences. 111, 12217-12221 (2014).
- Navakkode, S., Sajikumar, S., Frey, J. U. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 7740-7744 (2004).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nature. 14, 1413-1415 (2011).
- Frey, U., Huang, Y. Y., Kandel, E. R. Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664 (1993).
- Erdogdu, G., Uto, A., Hossmann, K. -. A. The effect of global ischemia and recirculation of rat brain on protein synthesis in vitro. Metab Brain Dis. 8, 199-206 (1993).
- Djuricic, B., Berger, R., Paschen, W. Protein synthesis and energy metabolism in hippocampal slices during extended (24 hours) recovery following different periods of ischemia. Metab Brain Dis. 9, 377-389 (1994).
- Park, P., et al. NMDA receptor-dependent long-term potentiation comprises a family of temporally overlapping forms of synaptic plasticity that are induced by different patterns of stimulation. Philosophical Transactions of the Royal Society B: Biological Sciences. 369, 20130131 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon