A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الحوفي-النهج تحت الشبكية حقن الفيروسية المتجهات للعلاج الجيني في الفئران الشبكية الظهارة الصبغية
In This Article
Summary
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Abstract
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introduction
في طب العيون، برزت العلاج الجيني باعتباره طريقة العلاج في retinopathies الموروثة أحادية المنشأ. هناك retinopathies المرتبطة الموروثة الجينات في شبكية العين الظهارة الصبغية (RPE) بما في ذلك يبر amurosis الخلقية 1،2، التهاب الشبكية الصباغي 3، وتنكس المشيمية 4. مجال أبحاث العلاج الجيني تتوسع في كل من الدراسات قبل السريرية والتجارب السريرية باستخدام ناقلات فيروسية مثل فيروس الغدة -associated (AAV)، الفيروسة البطيئة (LV) واتش (الإعلان) 5. النواقل الفيروسية المختلفة لها مع الأجسام مختلفة في شبكية العين. لالعلاج الجيني آمنة وفعالة، ناقلات فيروسية ينبغي اختيار بعناية وفقا لالخلايا المستهدفة والجينات المستهدفة.
مسار توصيل الجينات مهم أيضا لتوصيل الجينات فعالة لاستهداف الخلايا، وبالتالي، فإنه ينبغي اختيار بعناية أيضا. وsubret الأساليب الأكثر شيوعا اثنين للتسليم العين من ناقلات فيروسيةحقن إينال وحقن intravitreal 6. هذا الأخير، حقن intravitreal، وقد استخدم على نطاق واسع لتسليم المخدرات لعلاج اتساع الأوعية الدموية المشيمية في الرطب الضمور البقعي المرتبط بالعمر (AMD)، وذمة البقعة الصفراء في اعتلال الشبكية السكري 7. يوفر الطريق Intravitreal تعرض ناقلات فيروسية لشبكية العين الزجاجية والداخلية، ولكن انتشار ناقلات لشبكية العين الخارجي محدودة. من ناحية أخرى، والطريق تحت الشبكية يوفر النقل المباشر للناقلات فيروسية إلى الفضاء المحتمل بين شبكية العين وRPE، الأمر الذي أدى إلى فقاعة محلية. ولذلك، يعتبر الحقن تحت الشبكية حاليا طريقا أكثر كفاءة لاستهداف خلايا مستقبلة للضوء وRPE. من حيث النهج الجراحية، بارس يتم اختيار مسطح كمنطقة آمنة للحقن intravitreal لتجنب الضرر شبكية العين في المرضى من البشر. ببساطة عن طريق تعديل هذا النهج على الفئران، فإننا لا يمكن حقن ناقلات فيروسية subretinally أو intravireally عبر نهج الحوفي.
في هذا الفيديوالمادة، علينا أن نظهر وسيلة سهلة ومريحة للحقن تحت الشبكية من ناقلات فيروسية في الفئران RPE. بعد ثقب واحد في الخلفية لحوف مع 30 G 1/2 إبرة، يتم إدخال إبرة حادة G 33 ميكروليتر تجهيز الحقنة في الفضاء تحت الشبكية عبر موقع ثقب الحوفي. يتم حقن 2 حجم ميكرولتر إلى الفضاء المحتمل بين شبكية العين وRPE إحداث الفقاعات تحت الشبكية - ناقلات فيروسية 1.5. ويمكن تنفيذ هذا الإجراء في إطار رؤية مباشرة باستخدام الميكروسكوب الجراحي. والممارسة المتكررة يضمن النتائج القابلة للتكرار حتى من دون رؤية مباشرة لتشكيل فقاعة. وهذا سوف يساعد الباحثين على إجراء تجارب دقيقة وللوقت لتوصيل الجينات في الفئران تحت الشبكية RPE.
Protocol
أجريت جميع التجارب على الحيوانات وفقا للجمعية للبحوث في بيان الرؤية وطب العيون لاستخدام الحيوانات في العيون والبحوث الرؤية، والمبادئ التوجيهية واللوائح التي وضعتها لجنة رعاية جامعة المؤسسي الحيوان واستخدام سيول الوطنية وسيول الوطنية لجنة السلامة الأحيائية مستشفى الجامعة.
1. إعداد حقن كيت والفيروسية المتجهات
- تحضير حقنة ميكروليتر مجهزة إبرة 33 G حادة تعقيمها باستخدام غاز أكسيد الإيثيلين. تمييع ناقلات فيروسية في برنامج تلفزيوني لعيار كاف في أنبوب الجزئي (أي 1 × 10 6 TU / ميكرولتر). تدفق الحقنة عدة مرات مع ناقلات فيروسية لإزالة أي الفضاء الميت في المحقنة.
2. حقن تحت الشبكية الفيروسية المتجهات
- تخدير الفئران البالغة (أي 6-8 أسابيع من العمر) مع حقن داخل الصفاق من خليط من tiletamiشمال شرق وzolazepam (1: 1، 2.25 ملغ / كغ من وزن الجسم)، وهيدروكلوريد زيلازين (0.7 ملغم / كغم من وزن الجسم) أو نظام التخدير مناسب بديل.
- تمدد التلاميذ مع قطرة العين من فينيليفرين 0.5٪ و 0.5٪ تروبيكاميد.
- تحضير حقنة ميكروليتر عن طريق تحميل مع 1،5-2 ميكرولتر من ناقلات فيروسية.
- فتح الجفن وتبرز العين للكشف عن خط الاستواء للحقن مريحة والتركيز على تحت المجهر التشغيل. الحفاظ على موقف العين يبرز حتى الانتهاء من الحقن، أو النزوح من الإبرة يمكن أن تحدث أثناء الحقن. عقد مقلة العين بقوة، ضع أصابع خارج حافة المدارية.
- تطبيق قطرة من محلول اللزجة العيون إلى سطح القرنية.
- وضع غطاء الشريحة جولة صغيرة على الجزء العلوي من القرنية لتصور شبكية العين.
- ثقب ثقب صغير في مؤخرة طفيفة في حوف باستخدام العقيمة 30 G 1/2 إبرة لحقن تحت الشبكية آخر. جعل ثقب أقل شأنا FOص العين اليمنى، ومتفوقة للعين اليسرى للراحة.
ملاحظة: إذا تم إجراء ثقب في الزمانية أو الأنف، فإنه من الصعب أن تكون مشمولة الجفن بعد الحقن. وينبغي بذل ثقب الأولي قليلا الخلفي لحوف لتجنب الأوعية الحوفي التي تمتد على طول حوف، ويمكن التعرف عليه بسهولة. كن حذرا لتجنب ضرب العدسة مع إبرة في حين جعل ثقب الأولي. لا تضاف شطبة كامل من الإبرة إلى تجنب عدسة ثقب. - وضع إبرة 33 G حادة من ميكروليتر حقنة من خلال ثقب ما قبل ثقب والاقتراب من الإبرة في الفضاء تحت الشبكية حتى هذه النقطة عندما يشعر مقاومة خفيفة.
ملاحظة: بالنسبة للحقن تحت الشبكية، وأفضل زاوية اقتراب الإبرة حوالي 45 درجة ضد طائرة القزحية، وينبغي دفع إبرة حادة من الخلف نحو منطقة بالحليمة. وأشار مربع منقط مسار الإبرة اقترح عبر تجويف الجسم الزجاجي للinjectio تحت الشبكيةن في الشكل 1.
ملاحظة: لن يكون هناك أي مقاومة عندما رأى ثقب (أو تمرير) طبقات الشبكية كما أنها لينة جدا. وبالتالي، فإن الشعور الأول للمقاومة خفيفة يشير إلى أن الإبرة وقد لمست بالفعل طبقة RPE ويجب أن يتوقف إدخال الإبرة. يجب الحرص على عدم اختراق الأنسجة صلبوية مع الضغط المفرط أنه يجب أن توضع الإبرة في الفضاء تحت الشبكية المحتملين. إذا كانت إبرة يثقب الأنسجة صلبوية بالقوة المفرطة، فإنه يدخل في المساحات المدارية المقلة دون مقاومة. (هذه الخطوة الحاسمة)
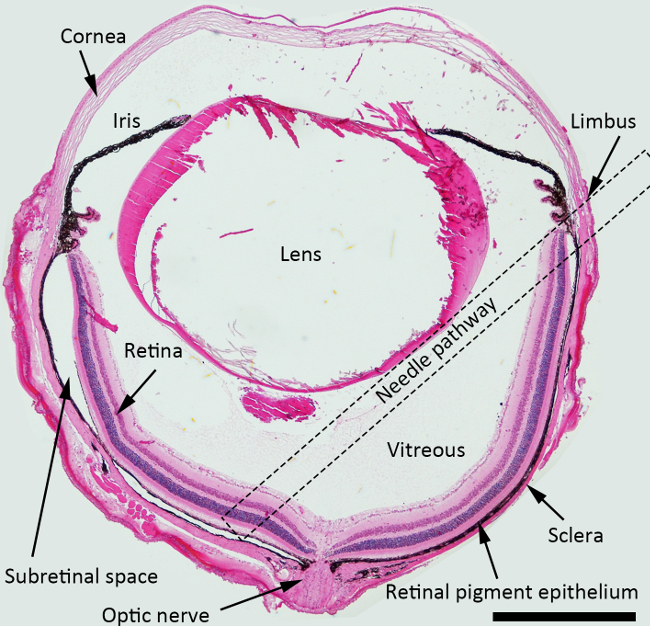
الشكل 1. الرسم التخطيطي للحقن تحت الشبكية. H & E الملون المقطع العرضي للعين الماوس تصور هياكل مع مسار إبرة لحقن تحت الشبكية ملحوظ (مربع منقط). التكبير: 40X، مقياس شريط: 500 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- حقن النواقل الفيروسية (أي 1 × 10 6 TU / ميكرولتر) بلطف في الفضاء تحت الشبكية دون الزلزال لتجنب تلف الأنسجة غير المرغوب فيها وسحب الإبرة بلطف. عقد مقلة العين بقوة خلال الحقن كما هو موضح في 2.4.
- نلاحظ تشكيل فقاعة تحت الشبكية بعد الحقن تحت المجهر التشغيل للتأكد من عدم وجود نزيف في شبكية العين.
ويبين الشكل 2. تحت الشبكية Belb تشكيل الشبكية دون نزف. عرض المجهري للbelb تحت الشبكية بعد الحقن تحت الشبكية تحت المجهر التشغيل تشكيل فقاعة ناجحة دون نزيف في شبكية العين.م / ملفات / ftp_upload / 53030 / 53030fig2large.jpg "الهدف =" _ فارغة "> اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
- بلطف إغلاق الجفن لتغطية موقع الحقن لمنع تسرب الذاتي. عودة الفئران إلى قفص المنزل والحفاظ على قيد الحياة حتى التقييم.
ملاحظة: بعد التعود الباحثون إلى الإجراءات ويتمكنوا من الحصول على نتائج قابلة للتكرار مع إجراءات سريعة من خلال تخطي هذه الخطوات (2.5 و 6 و 10)
3. تقييم فعالية من الجينات التسليم في الشبكية الظهارة الصبغية
- التضحية الفئران في غرفة CO 2. استأصل العينين باستخدام المقص.
- إصلاح العيون في حل بارافورمالدهيد 4٪ عند 4 درجة مئوية لمدة لا تقل 1 ساعة إلى عدة أيام.
- الاستيلاء على القرنية مع ملقط غرامة وثقب القرنية مع مقص الصغرى. إزالة القرنية بعد استخدام المقص على طول حوف. إزالة العدسة مع ملقط.
- تقليم الجسم الهدبي مع مicro مقص السماح انفصال الشبكية. سحب بلطف شبكية العين كلها من / المشيمية / مجمع الصلبة RPE. قطع RPE / المشيمية / مجمع الصلبة شعاعيا من المحيط إلى المركز بالقرب من العصب البصري عدة مرات لجعل 4-8 أوراق لتركيب مسطحة.
- الوجه RPE / المشيمية / مجمع الصلبة لجعل الجانب RPE أسفل، وتقليم كل ما تبقى من الأنسجة في الجانب الصلبة بما في ذلك العضلات والملتحمة والعصب البصري. هذه الخطوة مهمة لجعل RPE / المشيمية / مجمع الصلبة شقة لأن أي نوع من الأنسجة المتبقية يجعل متفاوتة التعقيد.
- احتضان المجمع مع الأجسام المضادة الأولية والثانوية لأغراضك بحثية محددة (اختياري، راجع المراجع لأساليب مفصلة). شقة-جبل RPE / المشيمية / مجمعات صلبوية على شريحة زجاجية واستيعاب PBS مع الاسفنجة الماصة.
- إضافة 30 ميكرولتر من محلول تركيب ووضع الشريحة الغطاء. مراقبة العينة لفعالية تسليم ناقلات تحت المجهر فلوريسئين. الحفاظ على العينات فيالثلاجة لمزيد من المراقبة.
النتائج
لتقييم فعالية حقن تحت الشبكية على الفيروسية تنبيغ الجينات بموجب هذا البروتوكول، استخدمنا المتاحة تجاريا ناقلات LV مع CMV المروج التعبير عن كل GFP وطلب تقديم العروض للمؤشر. ومنزوعة النواة العينين بعد الفترة الزمنية المناسبة وفقا للغرض البحث. للحصول على نتائج التمثيلية،...
Discussion
في هذه المقالة الفيديو، وصفنا تقنية الحقن تحت الشبكية النهج الحوفي في التفاصيل مع نتائج ممثلة من RPE / المشيمية / الصلبة شقة جبل. هذا هو أسلوب سهلة ومريحة للحقن تحت الشبكية من ناقلات فيروسية في RPE. التصور المباشر لتشكيل فقاعة خلال الحقن هو خطوة هامة لتسليم دقيقة للمبتدئ?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد هذه الدراسة من قبل سيول القومي للبحوث منحة جامعة (800-20140542)، وبرنامج الرواد بحوث جبهة الخلاص الوطني / MEST (2012-0009544)، وبرنامج بيو الإشارة تحليل التكنولوجيا والابتكار من جبهة الخلاص الوطني / MEST (2009-0090895)، ومنح جبهة الخلاص الوطني / MEST (2015M3A9E6028949).
Materials
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
References
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved