Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Limbal Inyección-Enfoque Subretinal de vectores virales para terapia génica en ratones epitelio pigmentario de la retina
En este artículo
Resumen
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Resumen
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introducción
En oftalmología, terapia génica ha emergido como la modalidad de tratamiento de retinopatías hereditarias monogénicas. Hay retinopatías hereditarias asociadas con genes en el epitelio pigmentario de la retina (EPR) incluyendo Leber amurosis congénita 1,2, la retinitis pigmentosa 3 y 4 coroideremia. El campo de la investigación de la terapia génica se está expandiendo en ambos estudios preclínicos y ensayos clínicos utilizando vectores virales como el virus adeno -Associated (AAV), lentivirus (LV) y adenovirus (Ad) 5. Diferentes vectores virales tienen diferente tropismo en la retina. Para una terapia génica seguros y eficaces, vectores virales deben ser seleccionados cuidadosamente de acuerdo con las células diana y los genes diana.
La ruta de administración de genes también es importante para la administración de genes eficaz a las células diana, por lo tanto, debe elegirse cuidadosamente, también. Los dos métodos más comunes para la entrega intraocular de vectores virales se subretinal inyección y la inyección intravítrea 6. Este último, inyección intravítrea, ha sido ampliamente utilizado para la administración de fármacos para el tratamiento de la neovascularización coroidea en la degeneración húmeda macular relacionada con la edad (AMD) y edema macular en la retinopatía diabética 7. Ruta intravítrea proporciona una exposición de vectores virales a retina vítreo e interior, pero la difusión de los vectores de retina externa es limitado. Por otra parte, la ruta subretinal proporciona la entrega directa de vectores virales para el espacio potencial entre la retina y RPE, induciendo una ampolla localizada. Por lo tanto, la inyección subretiniana se considera actualmente una ruta más eficiente para atacar a las células fotorreceptoras y RPE. En términos de abordaje quirúrgico, pars plana es elegido como un lugar seguro para la inyección intravítrea de evitar daños a la retina en pacientes humanos. Simplemente modificando este enfoque a los ratones, podríamos inyectar vectores virales subretinally o intravireally través enfoque del limbo.
En este videoartículo, demostramos un método fácil y conveniente de la inyección subretiniana de vectores virales en ratones RPE. Después de la punción única en posterior a limbo con un medio de aguja 30 G, 33 una aguja roma G microlitro equipado jeringa se inserta en el espacio subretiniano a través del sitio de la punción limbal. Los vectores virales de 1,5-2 l de volumen se inyectan al espacio potencial entre la retina y el RPE inducir ampollas subretinianas. Este procedimiento se puede realizar bajo visualización directa usando microscopio quirúrgico. La práctica repetida garantiza resultados reproducibles incluso sin la visualización directa de la formación de la ampolla. Esto ayudará a los investigadores a realizar experimentos precisos y de ahorro de tiempo para la entrega de genes en ratones subretiniano RPE.
Protocolo
Todos los experimentos con animales se realizaron de acuerdo con la Asociación para la Investigación en Visión y Oftalmología para el Uso de Animales en Oftálmica y Vision Research, y las directrices y normas establecidas por el Comité Nacional de Seúl Cuidado de Animales institucional y el empleo de la Universidad Nacional de Seúl y Universidad Comité de Bioseguridad del hospital.
1. Preparación Kit de inyección y virales Vectores
- Prepare la jeringa microlitro equipado con una aguja roma 33 G esterilizada utilizando gas de óxido de etileno. Diluir los vectores virales en PBS durante la titulación adecuada en el tubo micro (es decir, 1 x 10 6 TU / l). Enjuague la jeringa varias veces con vectores virales para eliminar cualquier espacio muerto en la jeringa.
2. La inyección subretiniana de vectores virales
- Anestesiar los ratones adultos (es decir, 6 - 8 semanas de edad) con una inyección intraperitoneal de la mezcla de tiletaminane y zolazepam (1: 1, 2,25 mg / kg de peso corporal) y clorhidrato de xilazina (0,7 mg / kg de peso corporal) o un régimen de anestesia adecuada alternativa.
- Dilatar los alumnos con un colirio de fenilefrina al 0,5% y tropicamida 0,5%.
- Prepare la jeringa microlitro cargando con 1,5-2 l de vectores virales.
- Abra el párpado y el ojo sobresalga para exponer el ecuador para inyección conveniente y centrarse en bajo el microscopio operativo. Mantener la posición del ojo sobresalía hasta terminar la inyección, o el desplazamiento de la aguja puede ocurrir durante la inyección. Para mantener el globo ocular con firmeza, coloque los dedos fuera del reborde orbitario.
- Aplicar una gota de solución oftálmica viscoelástica a la superficie corneal.
- Coloque un pequeño tobogán cubierta redonda en la parte superior de la córnea para visualizar la retina.
- Perforar un pequeño agujero en ligero detrás del limbo utilizando un estéril 30 G 1/2 aguja para la inyección subretiniana más. Hacer el agujero inferior for el ojo derecho, y superior para el ojo izquierdo por la comodidad.
NOTA: Si el agujero se hace en temporal o nasal, es difícil ser cubierto por el párpado después de la inyección. Punción inicial debe hacerse ligeramente por detrás del limbo para evitar los vasos del limbo que se ejecutan a lo largo del limbo y se pueden reconocer fácilmente. Tenga cuidado de no golpear el objetivo con la aguja al hacer la punción inicial. No inserte todo el bisel de la aguja para evitar la punción de la lente. - Coloque la aguja roma 33 G de la jeringa microlitro a través del orificio pre-perforado y acercarse a la aguja en el espacio subretiniano, hasta el punto en que se sienta resistencia leve.
NOTA: Para la inyección subretiniana, el mejor ángulo de aproximación de la aguja es de unos 45 grados contra plano del iris, y la aguja roma debería ser empujado posteriormente hacia el área peripapilar. Cuadrada punteada indica la vía aguja sugerido a través de la cavidad vítrea para el injectio subretinianan en la Figura 1.
NOTA: No habrá resistencia sintió cuando la perforación (o paso) las capas de la retina, ya que son muy suaves. Así, el primer sentimiento de resistencia leve indica que la aguja ya ha tocado la capa de RPE y la inserción de la aguja debe ser detenido. Tener cuidado de no penetrar en el tejido escleral con una presión excesiva debido a que la aguja debe ser colocado en el potencial espacio subretiniano. Si la aguja perfora el tejido de la esclerótica por potencia excesiva, entra en los espacios orbitales extraoculares sin resistencia. (Este paso es crítico)
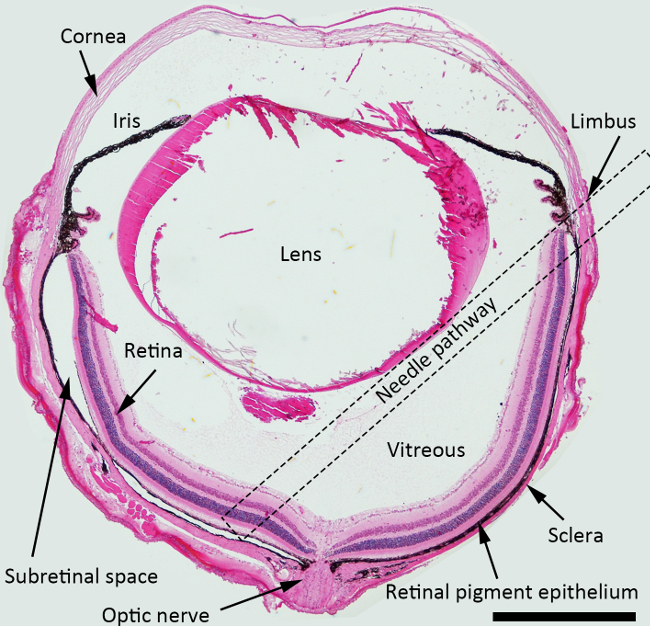
Figura 1. Esquema de la inyección subretiniana. H & E manchadas sección transversal del ojo del ratón que representa las estructuras con una vía de aguja para la inyección subretiniana marcada (un cuadrado de puntos). Ampliación: 40X, barra de escala: 500 micras. Haga clic aquí para ver una versión más grande de esta figura.
- Inyectar los vectores virales (por ejemplo, 1 x 10 6 TU / l) suavemente en el espacio subretiniano sin temblor de evitar daños en el tejido no deseado y retirar la aguja suavemente. Sostenga firmemente el globo ocular durante la inyección como se describe en 2.4.
- Observar la formación de la ampolla subretiniana después de la inyección bajo microscopio quirúrgico para asegurarse de que no hay hemorragia retiniana.
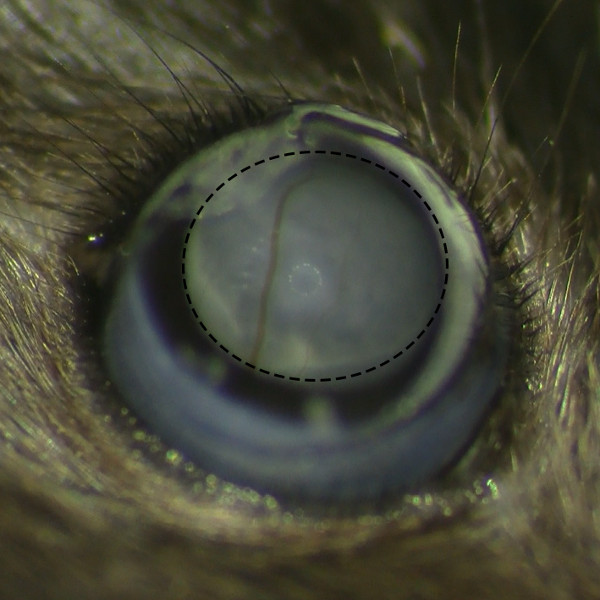
Figura 2. Subretinal BELB Formación sin retiniana Hemorragia. Vista microscópica de BELB subretiniana después de la inyección subretiniana bajo microscopio quirúrgico muestra la formación de vesículas éxito sin hemorragia retiniana.m / files / ftp_upload / 53030 / 53030fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Cierre suavemente el párpado para cubrir el lugar de la inyección para la auto-sellado. Devolver los ratones para jaula y mantenerse con vida hasta la evaluación.
NOTA: Después de que los investigadores se acostumbran a los procedimientos, que pueden obtener los resultados repetibles con procedimientos rápidos saltarse estos pasos por (2.5, 6 y 10)
3. Evaluación de la eficacia de la entrega de genes en el epitelio pigmentario de la retina
- Sacrificar los ratones en la cámara de CO 2. Enuclear los ojos con unas tijeras.
- Fijar los ojos en la solución de paraformaldehído al 4% a 4 ° C durante un mínimo de 1 hora a varios días.
- Coge la córnea con unas pinzas finas y perforar la córnea con micro-tijeras. Retire la córnea después de tijera a lo largo del limbo. Retire la lente con unas pinzas.
- Recorte el cuerpo ciliar con mICRO-tijeras que permiten el desprendimiento de retina. Tire suavemente toda la retina de la / coroides / esclerótica complejo EPR. Cortar el RPE / coroides / complejo escleral radialmente desde la periferia hacia el centro, cerca del nervio óptico varias veces para asegurarse de 4 a 8 hojas para el montaje plana.
- Da la vuelta al RPE / coroides / complejo escleral para hacer lateral RPE abajo, y recortar todos los tejidos que quedan en la parte escleral incluyendo los músculos, la conjuntiva y el nervio óptico. Este paso es importante hacer una RPE / coroides / complejo escleral plana porque cualquier tejido restante hace que el complejo desigual.
- Incubar el complejo con el anticuerpo primario y secundario para sus fines específicos de investigación (opcional, consulte las referencias para los métodos detallados). Piso-montar las RPE / coroideo / complejos escleral en el portaobjetos de vidrio y absorber el PBS con una esponja absorbente.
- Añadir 30 l de solución de montaje y coloque la tapa deslizante. Observar la muestra de la eficacia de la prestación de vector bajo el microscopio fluoresceína. Mantener las muestras enel refrigerador para su posterior observación.
Resultados
Para evaluar la eficacia de la inyección subretiniana en viral transducción génica mediante este protocolo, hemos utilizado vectores LV disponibles en el mercado con el promotor CMV que expresa tanto las buenas prácticas agrarias y RFP para el indicador. Los ojos fueron enucleados después de que el período de tiempo adecuado de acuerdo con el propósito de la investigación. Para los resultados representativos, los ojos fueron enucleados 10 semanas y 20 semanas después de la inyección subretiniana. Después de l...
Discusión
En este artículo de vídeo, describimos la técnica de inyección subretiniana limbo-enfoque en detalle con resultados representativos de RPE / coroides / esclerótica de montaje plana. Esta es una técnica fácil y conveniente para la inyección subretiniana de vectores virales en RPE. La visualización directa de la formación de la ampolla durante la inyección es un paso importante para la entrega exacta para los principiantes. Hay algunas técnicas subretinianas inyección introducidos en Journal of experimentos v...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este estudio fue apoyado por la Universidad Nacional de Seúl Beca de Investigación (800-20140542), el Programa de Investigación de Pioneer NRF / MEST (2012-0009544), y el Programa de Bio-Signal Analysis Innovación Tecnológica de la NRF / MEST (2009-0090895), y la concesión de NRF / MEST (2015M3A9E6028949).
Materiales
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Referencias
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados