需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
病毒载体的基因治疗的小鼠视网膜色素上皮缘方针,视网膜下注射
摘要
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
摘要
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
引言
在眼科,基因治疗已成为治疗方式在单基因遗传性视网膜病变。存在与基因在视网膜色素上皮细胞(RPE)包括莱伯先天性amurosis 1,2,色素性视网膜炎3,和脉络膜4相关遗传性视网膜病变。基因治疗的研究领域正在扩大在临床前研究和使用病毒载体的临床试验,例如腺机相关病毒(AAV), 慢病毒 (LV)和腺病毒 (广告)5。不同的病毒载体具有不同的取向,在视网膜上。一种安全有效的基因治疗,病毒载体应仔细根据靶细胞和靶基因。
基因递送途径也很重要,为有效的基因递送至靶细胞,因此,应该仔细选择为好。用于眼内递送病毒载体的两种最常见的方法是subretINAL注射玻璃体内注射6。后者,玻璃体内注射,已被广泛地用于药物输送到治疗在湿性年龄相关性黄斑变性(AMD)和黄斑水肿脉络膜新生血管形成,糖尿病性视网膜病7。玻璃体内途径提供的病毒载体到玻璃体和视网膜内层的暴露,但向量到外视网膜的扩散受到限制。另一方面,在视网膜下途径提供直接递送病毒载体到视网膜和RPE之间的潜在空间,诱导局部疱。因此,视网膜下注射是目前被认为用于靶向感光细胞和RPE一个更有效的路由。在手术方式上,玻璃体被选为安全区的玻璃体内注射,避免在人类患者视网膜损伤。通过简单地修改这个方法给小鼠,我们可以通过角膜缘视网膜下的方法或intravireally注入病毒载体。
在这个视频本文中,我们证明视网膜下注射病毒载体的容易且方便的方法到小鼠视网膜色素上皮。在后方缘用30 G 1/2单针穿刺后,一个33克钝针配备微升注射器插入通过角膜缘穿刺部位的视网膜下腔。 1.5病毒载体 - 2微升体积被注入到视网膜和RPE诱导视网膜下泡之间的潜在空间。这个过程可以在直视下使用手术显微镜下进行。反复练习将保证复制的结果,即使没有气泡形成的直接可视化。这将有助于研究人员进行精确和节省时间用于实验的小鼠视网膜色素上皮基因传递。
研究方案
对动物的所有实验均按照研究协会在视觉与眼科声明使用动物的眼科和视觉研究的进行,以及指导方针和条例规定由首尔国立大学机构动物护理和使用委员会和国立首尔大学附属医院生物安全委员会。
1.准备注射套件和病毒载体
- 制备微升注射器配备有33克钝针用环氧乙烷气体消毒。稀释在PBS中的病毒载体用于在微管( 即,1×10 6 TU /微升)在足够滴度。冲洗注射器数次用病毒载体以除去在注射器任何死角。
病毒载体2.视网膜下注射
- 麻醉成年小鼠( 即,6 - 8周龄)腹膜内注射tiletami的混合物的NE和唑拉西泮(1:1,2.25毫克/公斤体重)和赛拉嗪盐酸盐(0.7毫克/公斤体重)或另一种合适的麻醉制度。
- 瞳孔扩张与去氧肾上腺素0.5%滴眼剂及托0.5%。
- 2μl病毒载体 - 通过加载1.5准备的注射器微升。
- 打开眼睑和突出眼睛,以暴露赤道注射方便和在手术显微镜下重点关注。保持凸眼睛的位置,直到在完成注射针,或位移可以发生在注射过程。要牢牢占据眼球,将手指眶缘外。
- 申请一滴眼科粘弹性溶液到角膜表面。
- 放置在角膜上以可视化的视网膜的顶部小圆盖滑动。
- 穿刺小孔后略有使用无菌30 G 1/2针为进一步视网膜下注射角膜缘。让孔劣质FOr处的右眼,和优越的用于左眼为方便。
注:如果孔是由在时间或鼻腔,很难涵盖在注射后的眼睑。初始穿刺应略作出后侧到角膜缘,以避免其沿角膜缘运行,并且可以容易地识别该边缘血管。要小心,以避免撞上镜头针,而在初始穿刺。不要插入针头的整个斜面,以避免爆胎的镜头。 - 将微升注射器33克钝针经过前期的穿刺孔,并接近针进入视网膜下腔,直到点,当轻微的感觉到阻力。
注:对于视网膜下注射时,针最好接近角是针对虹膜平面约45度,并且钝针应当向后推向乳头周围区域。虚线方框表示整个玻璃体腔建议针途径视网膜下注射液中的n 图1。
注:不会有阻力觉得当刺穿(或合格)的视网膜层,因为他们是非常柔软。因此,温和阻力的第一感觉指示该针已触到RPE层和所述针的插入应当停止。小心不要穿透巩膜组织过度的压力,因为在针应放置在潜在视网膜下腔。如果针头穿刺由剩余电力的巩膜组织,其进入无阻力眼外轨道的空间。 (这一步是至关重要的)
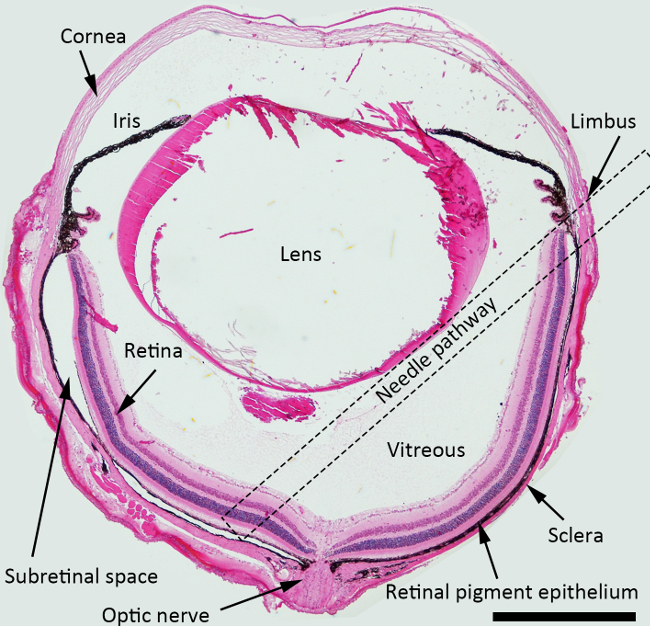
在视网膜下注射的图1示意图。H&E的小鼠眼描绘的结构用针通路为视网膜下注射标记的染色的横截面(虚线正方形)。放大倍数:40X,比例尺: 500微米。 请点击此处查看该图的放大版本。
- 轻轻注入病毒载体( 即,1×10 6 TU /微升)到视网膜下腔无震颤,以避免不必要的组织损伤,并轻轻拔出针头。在2.4中描述的注射过程中牢牢占据眼球。
- 观察注射手术显微镜下后形成的水泡视网膜下,以确保没有视网膜出血。
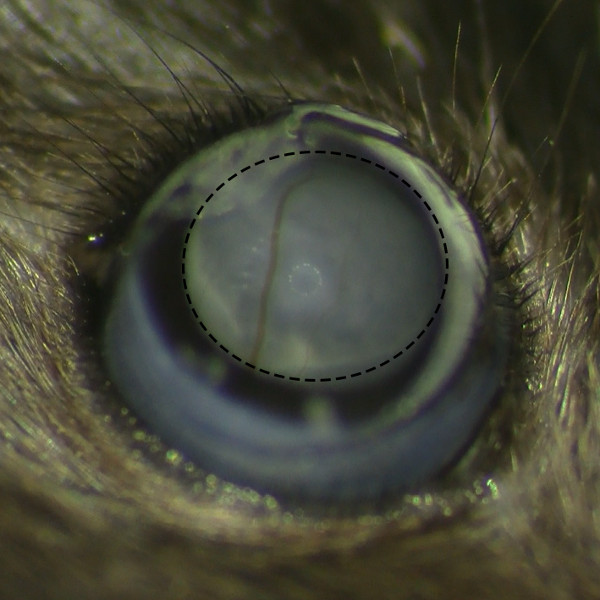
图2.视网膜下Belb没有形成视网膜出血,视网膜下注射手术显微镜下视网膜后的belb微观角度显示没有视网膜出血成功水泡形成。M /文件/ ftp_upload / 53030 / 53030fig2large.jpg"目标="_空白">点击此处查看该图的放大版本。
- 轻轻合上眼睑覆盖注射部位为自密封。返回小鼠家笼永葆直到评价。
注:在研究人员习惯的程序,它们可以通过跳过这些步骤获得快速的程序可重复的结果(2.5,6和10)
3.评估基因传递的视网膜色素上皮细胞的功效
- 牺牲小鼠中的CO 2室中。用剪刀剜除眼睛。
- 固定在眼睛中,在4℃的4%多聚甲醛溶液至少1小时至数天。
- 抢用细镊子角膜和穿刺微型剪刀角膜。沿缘剪式后取下眼角膜。取出钳镜头。
- 修剪睫状体具有mICRO剪刀使视网膜脱离。轻轻一拉从RPE /脉络膜/巩膜复杂的整个视网膜。切RPE /脉络膜/巩膜复杂的径向从外围向中心靠近视神经几次,以4〜8叶平安装。
- 翻转RPE /脉络膜/巩膜复杂,使RPE的一面朝下,并修剪在巩膜侧的肌肉,包括,结膜和视神经所有剩余的组织。这个步骤是重要的,以一平的RPE /脉络膜/巩膜复杂的,因为任何残留组织使复杂的不均匀。
- 孵育一级和二级抗体复合物为特定的研究目的(可选,请参阅详细方法的引用)。平面安装的RPE /脉络膜/巩膜载玻片上复合物和吸收的PBS用吸水海绵。
- 加入30微升的安装解决方案,然后将盖子滑。观察样品载体递送的荧光显微镜下的功效。保持的样品中的冰箱进一步观察。
结果
通过该协议评估视网膜下注射病毒基因转导的功效,我们用巨细胞病毒启动子表达GFP和RFP的指标市售LV载体。根据研究目的合适的时间后,眼睛被摘除。对于代表性的结果,眼睛被剜出10周20周视网膜下注射后。完全除去使用上述方法的视网膜后,RPE /脉络膜/巩膜复杂的平面安装在荧光显微镜下进行了评价。代表性结果示于图3A(与完全除去视网膜的很好的例子)和图3B(?...
讨论
在这个视频文章中,我们介绍了缘,方法视网膜下注射技术详细RPE /脉络膜/巩膜平座的代表性成果。这是一个简单而方便的技术为视网膜下注射病毒载体进入RPE。的气泡形成在注射过程中直接可视化是准确的交货期为初学者的一个重要步骤。有在Journal引入可视化实验8-10中某些视网膜下注射技术。视网膜下空间是视网膜和RPE之间的潜在空间,因此有两种可能的路由接近视网膜下的空间...
披露声明
The authors have nothing to disclose.
致谢
这项研究是由首尔国立大学研究资助(800-20140542)的支持下,先锋研究计划NRF / MEST的(2012-0009544),和NRF / MEST的生物信号分析技术创新计划(2009-0090895),及NRF / MEST的格兰特(2015M3A9E6028949)。
材料
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
参考文献
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。