このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス網膜色素上皮における遺伝子治療用ウイルスベクターの縁アプローチ、網膜下注射
要約
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
要約
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
概要
眼科では、遺伝子治療は、単一遺伝子継承網膜症における治療法として浮上しています。レーバー先天性amurosis 1,2、網膜色素変性症3、および先天性脈絡膜欠如4を含む網膜色素上皮(RPE)における遺伝子に関連した継承された網膜症があります。遺伝子治療の研究分野は、前臨床研究や、 アデノ -関連ウイルス(AAV)、 レンチウイルス (LV)およびアデノウイルス (AD)などのウイルスベクターを用いた臨床試験の両方に拡大している5。別のウイルスベクターは、網膜内の異なる親和性を有しています。安全かつ効果的な遺伝子治療のために、ウイルスベクターは、注意深く標的細胞および標的遺伝子に応じて選択されるべきです。
遺伝子送達の経路は、従って、それは慎重に同様に選択されるべきで、また、細胞を標的とする効果的な遺伝子送達のために重要です。ウイルスベクターの眼内送達のための2つの最も一般的な方法は、subretされていますinal注射や硝子体内注射6。後者は、硝子体内注射は、広く滲出型加齢黄斑変性症(AMD)および糖尿病性網膜症7の黄斑浮腫で脈絡膜血管新生を治療するための薬物送達のために使用されています。硝子体内経路は、硝子体と内側の網膜へのウイルスベクターの露出を提供していますが、外側の網膜へのベクターの拡散が制限されています。一方、網膜下の経路は、ローカライズ胞を誘導する、網膜とRPEの間の潜在的な空間へのウイルスベクターの直接送達を提供します。したがって、網膜下注射は、現在、光受容体細胞およびRPEを標的とする、より効率的なルートであると考えられます。外科的アプローチの面では、プラナは、ヒト患者における網膜の損傷を避けるために硝子体内注射のための安全なエリアとして選択されているPARS。単にマウスにこの方法を変更することによって、私たちは輪部アプローチを介して、網膜下またはintravireallyウイルスベクターを注入することができます。
このビデオで記事は、我々は、マウスのRPEへのウイルスベクターの網膜下注射の簡単で便利な方法を示しています。 30 G 1/2針で角膜輪部の後方に単一の穿刺後、33 G鈍針搭載マイクロリットルのシリンジは輪部穿刺部位を介して網膜下腔に挿入されます。 1.5のウイルスベクター - 2μlのボリュームが網膜下ブレブを誘発網膜とRPEとの間の潜在的な空間に注入されます。この手順では、手術用顕微鏡を用いて直接可視化の下で行うことができます。反復練習も、ブレブ形成の直接可視化することなく、複製の結果を保証します。これは、研究者がマウスのRPEにおける網膜下の遺伝子送達のために、正確かつ時間節約実験を行うのに役立ちます。
プロトコル
動物の全ての実験は、眼科と視覚研究における動物の使用のためのビジョンと眼科文の研究のための協会に従って実行、およびガイドラインや規制は、ソウル国立大学施設内動物管理使用委員会とソウルで定められました大学病院バイオセーフティ委員会。
1.インジェクションキットおよびウイルスベクターを準備
- 酸化エチレンガスを使用して滅菌33 G鈍針を備えたマイクロシリンジを準備します。マイクロチューブ( すなわち、1×10 6 TU /μL)で十分な力価のために、PBS中のウイルスベクターを希釈します。シリンジ内の任意のデッドスペースを除去するために、ウイルスベクターを用いて、シリンジを数回フラッシュします。
ウイルスベクターの2網膜下注射
- tiletamiの混合物の腹腔内注射で-成体マウス(8週齢、すなわち、6)麻酔NE及びゾラゼパム(1:1、2.25 mg / kg体重)及びキシラジン塩酸塩(0.7 mg / kg体重)、または代替の適切な麻酔レジーム。
- フェニレフリン0.5%の点眼で瞳孔を拡張し、0.5%のトロピカミド。
- ウイルスベクター2μlの - 1.5でロードすることにより、マイクロシリンジを準備します。
- まぶたを開いて、便利な注射のための赤道を露出させ、手術用顕微鏡下に集中するために目を突出しています。注入を終えまで突出目の位置を維持する、または針の変位が注入中に発生する可能性があります。しっかりと眼球を保持するために、眼窩縁の外側に指を置きます。
- 角膜表面への眼科用粘弾性溶液の液滴を適用します。
- 網膜を視覚化するために、角膜の上に小さな丸いカバースライドを置きます。
- さらに網膜下注射のための無菌の30 G 1/2針を使用して角膜縁にわずかに後方に小さな穴を穿刺。劣っFO穴を作りますR右目、利便性のために、左眼のための優れました。
注:穴が時間的または経鼻で行われる場合、それは注射後まぶたによって覆われるのは難しいです。初期パンクはわずか輪部に沿って実行して、容易に認識することができ輪部血管を回避するために、角膜輪部に後方なされるべきです。最初の穿刺をしながら針でレンズを打つないように注意してください。レンズ穿刺を回避するために、針の全体の傘を挿入しないでください。 - プレパンクチャーホールを介してマイクロリットルの注射器の33 G鈍針を置き、穏やかな抵抗が感じられる点まで、網膜下腔に針を近づけます。
注:網膜下注射のために、針の最良のアプローチ角は、虹彩面に対して約45度であり、鈍い針は乳頭周囲の領域に向かって後方に押されるべきです。点線の四角は網膜下の充血のために硝子体腔を横切る示唆針経路を示しました図1中のn。
注:彼らは非常に柔らかいようピアス(または通過)網膜層ときに抵抗が感じないがあるでしょう。このように、軽度の抵抗の最初の気持ちは、針が既にRPE層に触れた、針の挿入が停止されるべきであることを示しています。針は、潜在的な網膜下腔に配置する必要がありますので、過度の圧力と強膜組織を貫通しないように注意してください。針が過大な力で強膜組織を穿刺した場合、それは抵抗なく外眼軌道の空間に入ります。 (このステップは非常に重要です)
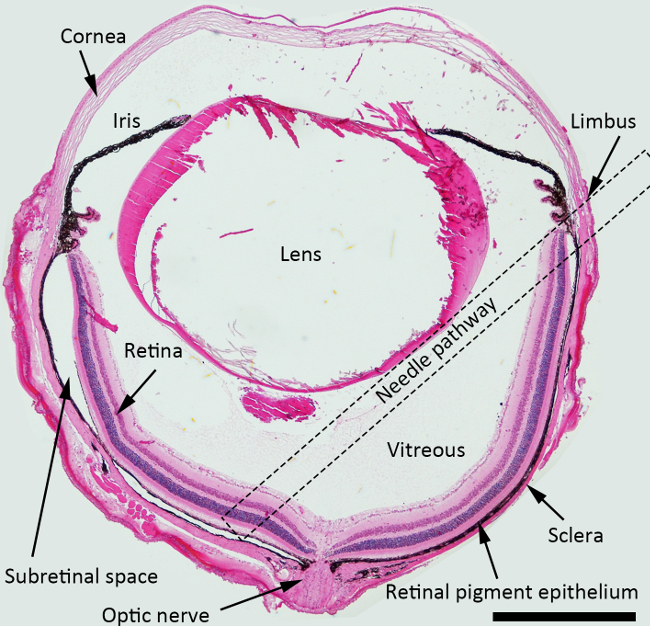
網膜下注射の図1の模式図で。H&Eは、マークされた網膜下注射用の針経路(点線の四角)との構造を描いたマウスの眼の断面を染色しました。倍率:40X、スケールバー: 500ミクロン。 この図の拡大版を表示するには、こちらをクリックしてください。
- 不要な組織の損傷を避けるため、ゆっくりと針を撤回する震えずに網膜下の空間に静かにウイルスベクター( すなわち、1×10 6 TU /μl)を注入します。 2.4で説明したように、注射の際にしっかりと眼球を保持します。
- 何の網膜出血がないことを確認する手術用顕微鏡下で注入後の網膜下ブレブの形成を観察します。
図2.網膜出血せずに網膜下Belb形成。手術用顕微鏡下での網膜下注射後の網膜下belbの顕微鏡図は、網膜出血のない成功ブレブ形成を示します。M /ファイル/ ftp_upload / 53030 / 53030fig2large.jpg「ターゲット= "_空白">この図の拡大版を表示するには、こちらをクリックしてください。
- 静かに自己封止用注射部位をカバーするために瞼を閉じます。ホームケージにマウスを返し、評価まで生き続けます。
注:研究者は手順に慣れた後、彼らはこれらのステップをスキップすることにより、迅速な手順で再現性のある結果を得ることができます(2.5、6、および10)
網膜色素上皮における遺伝子送達の有効性の評価3。
- CO 2チャンバー内でマウスを生け贄に捧げます。はさみを使用して、目を摘出。
- 数日に最低1時間、4℃で4%パラホルムアルデヒド溶液中で目を修正しました。
- 細かい鉗子で角膜をつかみ、マイクロはさみで角膜を穿刺。角膜輪部に沿ってシザリング後の角膜を削除します。ピンセットでレンズを取り外してください。
- mの毛様体トリムicro-はさみ網膜剥離を可能にします。静かRPE /脈絡膜/強膜複合体からの全網膜を引っ張ります。フラットマウント用4〜8葉を作るために視神経に近い中心に周囲から放射状に数回RPE /脈絡膜/強膜複合体をカットします。
- ダウンRPE側を行い、筋肉、結膜および視神経を含む強膜側の残りのすべての組織をトリミングするRPE /脈絡膜/強膜複合体を反転します。残りの組織は複雑な凹凸を作るため、この手順は、フラットRPE /脈絡膜/強膜複合体を作ることが重要です。
- (詳細な方法のための参考文献を参照して、オプション)特定の研究目的のために一次および二次抗体との複合体をインキュベートします。スライドガラス上のRPE /脈絡膜/強膜複合体をフラットマウントし、吸収性スポンジを含むPBSを吸収します。
- 取付溶液30μlを添加して、カバースライドを配置します。フルオレセイン顕微鏡下でベクター送達の有効性のためのサンプルを観察します。でサンプルを保ちますさらに観察用冷蔵庫。
結果
このプロトコルにより、ウイルスの遺伝子導入の網膜下注射の有効性を評価するために、我々は、インジケータ用GFPおよびRFPの両方を発現するCMVプロモーターを有する市販のLVベクターを使用していました。目は研究目的に応じて適切な期間の後に摘出しました。代表的な結果を得るためには、目が網膜下注射後10週および20週に摘出しました。上述の方法を用いて網膜を完全に除去した後、R...
ディスカッション
このビデオの記事では、RPE /脈絡膜/強膜フラットマウントの代表的な結果で詳細に輪部-アプローチ網膜下注入技術を説明しました。これは、RPEへのウイルスベクターの網膜下注射のための簡単で便利な技術です。注入時のブレブ形成の直接可視化は初心者のための正確な配達のための重要なステップです。可視化実験8-10誌で紹介し、いくつかの網膜下注入技術があります。網膜...
開示事項
The authors have nothing to disclose.
謝辞
この研究は、ソウル大学研究助成(800から20140542)によってサポートされていました、NRF / MESTのパイオニア研究プログラム(2012から0009544)、およびNRF / MESTの生体信号解析技術イノベーションプログラム(2009から0090895)、とNRF / MESTのグラント(2015M3A9E6028949)。
資料
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
参考文献
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved