È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Limbare Approccio-sottoretinico iniezione di vettori virali per la terapia genica nei topi retina epitelio pigmentato
In questo articolo
Riepilogo
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Abstract
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introduzione
In oftalmologia, la terapia genica è emerso come la modalità di trattamento di retinopatie ereditarie monogeniche. Ci sono retinopatie ereditarie associate a geni in epitelio pigmentato retinico (RPE) compresi Leber amurosis congenita 1,2, retinite pigmentosa 3, e Coroideremia 4. Il campo di ricerca della terapia genica si sta espandendo in entrambi gli studi preclinici e sperimentazioni cliniche utilizzando vettori virali come il virus adeno -associated (AAV), lentivirus (LV) e adenovirus (Ad) 5. Vettori virali differenti hanno tropismo differente nella retina. Per una terapia genica efficace e sicuro, vettori virali devono essere attentamente selezionati secondo le cellule bersaglio e geni bersaglio.
Il percorso di consegna del gene è importante anche per il trasferimento genico efficace per cellule bersaglio, quindi, deve essere scelta con attenzione pure. I due metodi più comuni per la consegna intraoculare di vettori virali sono subretiniezione inale e iniezione intravitreale 6. Quest'ultimo, iniezione intravitreale, è stato ampiamente utilizzato per la somministrazione di farmaci per il trattamento di neovascolarizzazione coroidale bagnato degenerazione maculare legata all'età (AMD) ed edema maculare nella retinopatia diabetica 7. Route intravitreale prevede l'esposizione di vettori virali per vitreo e retina interna, ma la diffusione dei vettori di retina esterna è limitata. D'altra parte, il percorso sottoretinico fornisce consegna diretta di vettori virali per lo spazio potenziale tra retina e RPE, inducendo una bozza localizzata. Pertanto, l'iniezione sottoretinica attualmente è considerato un percorso più efficiente per il targeting cellule visive e RPE. In termini di approccio chirurgico, pars plana viene scelto come una zona sicura per l'iniezione intravitreale per evitare danni alla retina in pazienti umani. Con la semplice modifica di questo approccio a topi, potremmo iniettare vettori virali subretinally o intravireally via approccio limbare.
In questo videoarticolo, abbiamo dimostrato un metodo facile e conveniente di iniezione sottoretinica di vettori virali in topi RPE. Dopo singola puntura di posteriormente al limbus con 30 G 1/2 ago, un 33 ago G smussato siringa microlitro attrezzato si inserisce nello spazio sottoretinico attraverso il sito di puntura limbare. I vettori virali di 1,5-2 volumi microlitri vengono iniettati nello spazio potenziale tra retina e RPE indurre blebs subretiniche. Questa procedura può essere eseguita sotto visualizzazione diretta con microscopio chirurgico. Pratica ripetuta garantirà risultati replicabili anche senza la visualizzazione diretta della formazione bozza. Questo aiuterà i ricercatori a condurre esperimenti accurati e risparmio di tempo per la consegna del gene nei topi sottoretinico RPE.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con l'Associazione per la Ricerca e la Visione e Oftalmologia Dichiarazione per l'uso di animali in Oftalmica e Vision Research, e le linee guida e regolamenti stabiliti dalla cura degli animali dell'Università Istituzionale e Usa Comitato Nazionale di Seul e Seoul National University Hospital Comitato Biosicurezza.
1. Preparazione Kit iniezione e vettori virali
- Preparare la siringa microlitro dotata di un ago smussato 33 G sterilizzato con ossido di etilene. Diluire i vettori virali in PBS per il titolo adeguata nel tubicino (cioè, 1 x 10 6 TU / ml). Lavare la siringa più volte con vettori virali per rimuovere qualsiasi spazio morto nella siringa.
2. Iniezione sottoretinico di vettori virali
- Anestetizzare i topi adulti (cioè, 6 - 8 settimane) con una iniezione intraperitoneale di miscela di tiletamine e zolazepam (1: 1, 2,25 mg / kg di peso corporeo) e xilazina cloridrato (0,7 mg / kg di peso corporeo) o un regime di anestesia valida alternativa.
- Dilatare gli alunni con un collirio di fenilefrina 0,5% e tropicamide 0,5%.
- Preparare la siringa microlitro caricando con 1,5 - 2 ml di vettori virali.
- Aprire la palpebra e l'occhio sporgente per esporre l'equatore per l'iniezione comoda e mettere a fuoco sotto il microscopio operatorio. Mantenere la posizione dell'occhio sporgeva fino a terminare l'iniezione, o spostamento dell'ago può verificarsi durante l'iniezione. Per mantenere il bulbo oculare con fermezza, posizionare le dita al di fuori del cerchio orbitale.
- Applicare una goccia di soluzione viscoelastica oftalmica alla superficie corneale.
- Inserire un coperchietto scorrevole rotonda sulla parte superiore della cornea per visualizzare la retina.
- Puntura un piccolo foro in lieve posteriormente al limbus usando una sterile 30 G 1/2 ago per l'ulteriore iniezione sottoretinica. Effettuare il foro inferiore for l'occhio destro e superiore per l'occhio sinistro per la comodità.
NOTA: Se il foro viene effettuata a temporali o nasale, è difficile da coprire con la palpebra dopo l'iniezione. Foratura iniziale sia reso leggermente posteriormente al limbus per evitare i vasi limbal che corrono lungo il limbus e facilmente riconoscibili. Fare attenzione a non colpire l'obiettivo con ago rendendo la foratura iniziale. Non inserire l'intera smussatura dell'ago per evitare lente foratura. - Posizionare l'ago senza punta 33 G della siringa microlitro attraverso il foro pre-forata e avvicinare l'ago nello spazio sottoretinico fino al punto in cui la resistenza mite si fa sentire.
NOTA: Per l'iniezione sottoretinica, il miglior angolo di attacco dell'ago è di circa 45 gradi contro piano iris, e l'ago smussato deve essere inserito posteriormente verso zona peripapillare. Piazza tratteggiata indica il percorso dell'ago suggerito attraverso la cavità vitrea per la injectio sottoretinicon in figura 1.
NOTA: Non ci sarà alcuna resistenza provato quando penetrante (o scomparsa) degli strati retinici in quanto sono molto morbidi. Così, la prima sensazione di resistenza lieve indica che l'ago ha già accennato strato RPE e l'inserimento dell'ago deve essere fermato. Fare attenzione a non penetrare il tessuto sclerale con eccessiva pressione perché l'ago deve essere posto in potenziale spazio sottoretinico. Se l'ago perfora il tessuto sclerale dal potere eccessivo, entra negli spazi orbitali estrinseci senza caratteristiche di resistenza. (Questo passaggio è fondamentale)
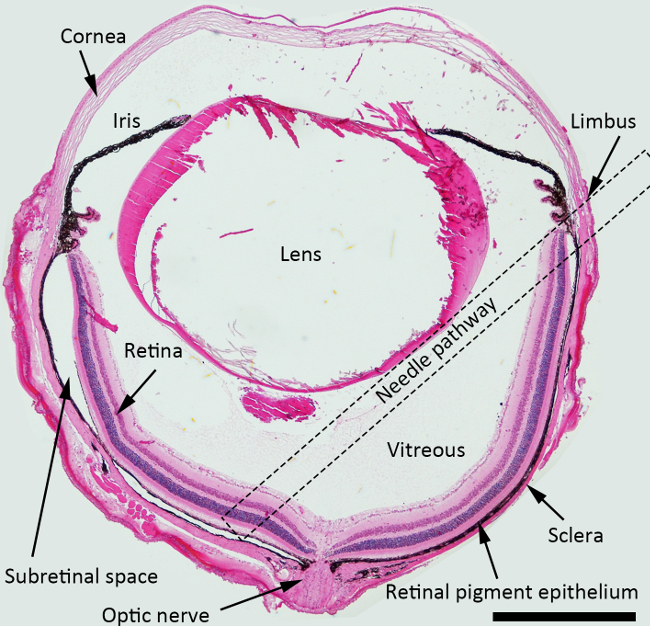
Figura 1. Schema di iniezione sottoretinica. H & E sezione macchiato dell'occhio del mouse raffigurante le strutture con un percorso ago per l'iniezione sottoretinica marcato (un quadrato tratteggiato). Ingrandimento: 40X, bar Scala: 500 micron. Cliccate qui per vedere una versione più grande di questa figura.
- Iniettare i vettori virali (ad esempio, 1 x 10 6 TU / mL) delicatamente nello spazio sottoretinico, senza tremori per evitare danni ai tessuti indesiderate e ritirare l'ago delicatamente. Tenere il bulbo oculare saldamente durante l'iniezione, come descritto al punto 2.4.
- Osservare la formazione di bozza sottoretinico dopo l'iniezione sotto microscopio operatorio per assicurarsi che non vi è alcun sanguinamento della retina.
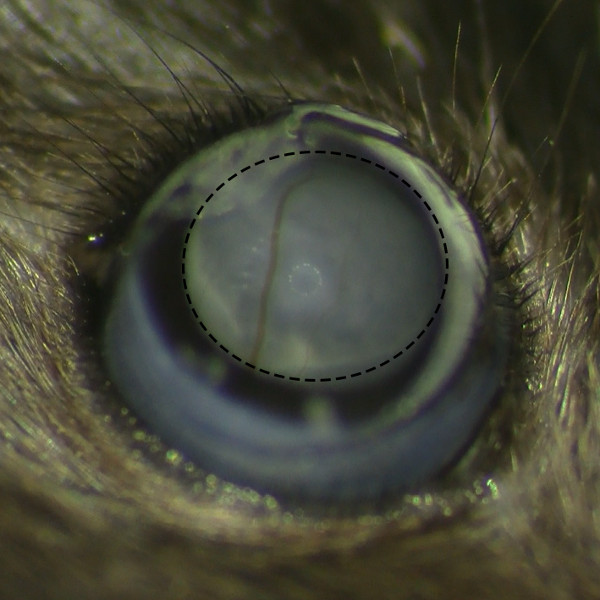
Figura 2. sottoretinico Belb Formazione senza retina emorragia. Vista al microscopio di belb sottoretinico dopo l'iniezione sottoretinica al microscopio operatorio mostra formazione bozza successo senza emorragia retinica.m / files / ftp_upload / 53030 / 53030fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
- Chiudere delicatamente la palpebra per coprire il sito di iniezione per l'auto-sigillatura. Riportare i topi per gabbia a casa e mantenere viva fino alla valutazione.
Nota: Dopo che i ricercatori abituarsi alle procedure, si possono ottenere i risultati ripetibili con procedure rapide saltando questi passaggi (2,5, 6, e 10)
3. Valutazione della efficacia di consegna Gene in epitelio pigmentato retinico
- Sacrificare i topi nella camera di CO 2. Enucleate gli occhi con le forbici.
- Fissare gli occhi nella soluzione di paraformaldeide al 4% a 4 ° C per almeno 1 ora a qualche giorno.
- Afferra la cornea con una pinza sottile e forare la cornea con micro-forbici. Rimuovere la cornea dopo forbice lungo il limbus. Rimuovere l'obiettivo con una pinza.
- Tagliare il corpo ciliare con mICRO-forbici permettendo il distacco della retina. Tirare delicatamente tutta la retina dal / coroide complesso RPE / sclera. Tagliare il RPE / coroide / complesso sclerale radialmente dalla periferia al centro vicino ottica nervose diverse volte per assicurarsi 4-8 foglie per il montaggio piatto.
- Capovolgere il RPE / coroide / complesso sclerale per rendere lato RPE giù, e tagliare tutti gli altri tessuti a lato sclerale compresi i muscoli, congiuntiva e nervo ottico. Questo passaggio è importante fare un piano RPE / coroide / complesso sclerale perché qualsiasi tessuto rimanente rende il complesso irregolare.
- Incubare il complesso con l'anticorpo primario e secondario per gli scopi di ricerca specifici (optional, vedere i riferimenti per i dettagli sui metodi). Flat-montare le RPE / coroide / complessi sclerali sul vetrino e assorbire il PBS con una spugna assorbente.
- Aggiungere 30 ml di soluzione di montaggio e mettere il vetrino di copertura. Osservare il campione per l'efficacia della consegna vettore sotto il microscopio fluoresceina. Conservare i campioni infrigorifero per ulteriori osservazioni.
Risultati
Per valutare l'efficacia dell'iniezione sottoretinica sulla trasduzione genica virale da questo protocollo, abbiamo utilizzato in commercio vettori LV con CMV promoter esprime sia GFP e RFP per l'indicatore. Gli occhi sono stati enucleato dopo il periodo di tempo appropriato in base allo scopo di ricerca. Per i risultati rappresentativi, gli occhi sono stati enucleati 10 settimane e 20 settimane dopo l'iniezione sottoretinica. Dopo la rimozione completa della retina con il metodo sopra descritto, l'a...
Discussione
In questo articolo il video, abbiamo descritto il limbare approccio tecnica di iniezione sottoretinica in dettaglio con risultati rappresentativi di RPE / coroide / sclerale flat-mount. Questa è una tecnica facile e conveniente per l'iniezione sottoretinica di vettori virali in RPE. La visualizzazione diretta della formazione di bozza durante l'iniezione è un passo importante per la consegna accurata per i principianti. Ci sono alcune tecniche di iniezione subretiniche introdotte nel Journal of Experiments Vis...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo studio è stato sostenuto dal Seoul National University Research di Grant (800-20140542), il Programma Pioneer Research di NRF / MEST (2012-0009544), e la Bio-Signal Analysis Tecnologia Programma Innovazione NRF / MEST (2009-0090895), e la concessione di NRF / MEST (2015M3A9E6028949).
Materiali
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Riferimenti
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon