Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Лимбальных подход-субретинальной впрыска вирусных векторов для генной терапии у мышей пигментного эпителия сетчатки
В этой статье
Резюме
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Аннотация
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Введение
В офтальмологии, генная терапия возникла как метода лечения в моногенных наследственных ретинопатии. Есть унаследованные ретинопатии, связанные с генами в пигментный эпителий сетчатки (ПЭС), включая Leber врожденной amurosis 1,2, пигментный ретинит 3 и 4 choroideremia. Полевые исследования генной терапии расширяется в обоих доклинических исследований и клинических испытаний с использованием вирусных векторов, таких как адено -associated вируса (AAV), лентивирус (LV) и аденовируса (Ad) 5. Различные вирусные векторы имеют разные тропизм в сетчатке. Для безопасной и эффективной генной терапии, вирусные векторы должны быть тщательно подобраны в соответствии с клетками-мишенями и генов-мишеней.
Маршрут доставки генов также важна для эффективного доставки генов в клетки-мишени, таким образом, она должна быть тщательно подобраны так. Два наиболее распространенных методов внутриглазного доставки вирусных векторов subretИнал впрыска и инъекция 6. Последнее, инъекция, широко используется для доставки наркотиков для лечения сосудистой оболочки глаза неоваскуляризации в мокрой возрастной макулярной дегенерации (AMD) и отека макулы в диабетической ретинопатии 7. Интравитреальная маршрут обеспечивает экспозицию вирусных векторов в стекловидного тела и внутренней сетчатки, но диффузия векторов внешней сетчатки ограничено. С другой стороны, субретинальная маршрут обеспечивает прямой доставки вирусных векторов для потенциального пространства между сетчатки и ПЭС, вызывая локализованное волдырь. Таким образом, субретинальной инъекции в настоящее время считается более эффективный маршрут для ориентации клетки фоторецепторов и РПЭ. С точки зрения хирургического подхода, пп Плана выбран в качестве безопасной зоне для инъекции в стекловидное тело, чтобы избежать повреждения сетчатки у больных людей. Просто изменяя этот подход к мышей, мы могли бы придать вирусных векторов subretinally или intravireally помощью лимбальных подхода.
В этом видеоСтатья, мы демонстрируем простое и удобный способ субретинальной инъекции вирусных векторов мышам ПЭС. После одного прокола в кзади от лимба с 30 г 1/2 иглы, 33 г тупой иглы оборудован мкл шприца вставлен в субретинальном пространства через лимбальных месте прокола. Вирусные векторы 1,5 - 2 мкл объем вводят в пространство между потенциальной сетчатки и РПЭ индукции субретинальной волдыри. Эта процедура может быть выполнена в соответствии с прямой визуализации с помощью операционного микроскопа. Повторное практика будет гарантировать воспроизводимые результаты даже без прямой визуализации образования пузырька. Это поможет исследователям для выполнения точных и экономии времени эксперименты по субретинальной доставки генов у мышей ПЭС.
протокол
Все эксперименты на животных были проведены в соответствии с Ассоциацией по исследованиям в видении и офтальмологии Заявление для использования животных в офтальмологических и Vision Research, и руководящие принципы и правила изложены в Сеульском национальном университете Care Институциональная животных и использование комитета и Сеульский национальный по Комитет Университетская больница биобезопасности.
1. Подготовка комплекта впрыска и вирусные векторы
- Подготовка мкл шприца, снабженного 33 г тупой иглой стерилизованной с помощью газообразной окиси этилена. Развести вирусных векторов в PBS для адекватного титра в микро трубки (т.е., 1 х 10 6 ТУ / мкл). Промойте шприц несколько раз вирусных векторов для удаления мертвого пространства в шприце.
2. субретинальной впрыска вирусных векторов
- Обезболить взрослых мышей (т.е., 6 - 8 недель) путем внутрибрюшинной инъекции смеси tiletamiпе и zolazepam (1: 1, 2,25 мг / кг массы тела) и ксилазина гидрохлорид (0,7 мг / кг массы тела) или альтернативный режим подходит анестезии.
- Разбавить учеников с глазные капли фенилэфрина 0,5% и 0,5% Tropicamide.
- Подготовка мкл шприц загрузкой 1,5 - 2 мкл вирусных векторов.
- Откройте веко и выступают в глаза, чтобы разоблачить экватор для удобного введения и сосредоточиться на под операционным микроскопом. Поддерживать в выступающем положении глаз до окончания инъекции, или смещение иглы может произойти во время инъекции. Чтобы удержать глазное яблоко плотно, поставить пальцы за пределами орбитального края.
- Нанесите каплю глазной раствор вязкоупругого к поверхности роговицы.
- Поместите небольшую круглую крышку скользить по верхней части роговицы, чтобы визуализировать сетчатку.
- Прокол небольшое отверстие в задней небольшим, чтобы лимба с помощью стерильного 30 G 1/2 иглы для дальнейшего субретинальной инъекции. Сделайте отверстие уступает FOг правый глаз, и превосходный для левого глаза для удобства.
ПРИМЕЧАНИЕ: Если отверстие сделано в височной или носовой, трудно быть охвачены века после инъекции. Первоначальный прокол должен быть немного кзади от лимба, чтобы избежать суда лимбальных которые работают по кайме и может быть легко распознать. Будьте осторожны, чтобы избежать удара объектив с иглой, делая первоначальный прокол. Не вставляйте весь скос иглы, чтобы избежать объектива прокол. - Поместите 33 G тупым иглу шприца через микролитровых предварительно проколотого отверстия и не подходить иглу в субретинальной пространстве до момента, когда мягкий ощущается сопротивление.
ПРИМЕЧАНИЕ: Для субретинальной инъекции, лучший угол подход иглы составляет около 45 градусов против диафрагмы плоскости, и тупой иглы должны быть толкнул сзади к околососковой области. Пунктирная квадрат указано предложенную иглы путь через полость стекловидного тела для субретинальной injectioн на рисунке 1.
ПРИМЕЧАНИЕ: Там будет никакого сопротивления не ощущается, когда пирсинг (или прохождения) слоев сетчатки, как они очень мягкие. Таким образом, первый ощущение легкой сопротивления указывает, что игла уже коснулись НПП слой и введение иглы должен быть остановлен. Будьте осторожны, чтобы не проникнуть склеры ткани с чрезмерным давлением, потому что игла должна быть помещена в потенциальной субретинальной пространстве. Если игла прокалывает ткань склеры чрезмерной власти, он входит в экстраокулярных орбитальных пространств без сопротивления. (Этот шаг является критическим)
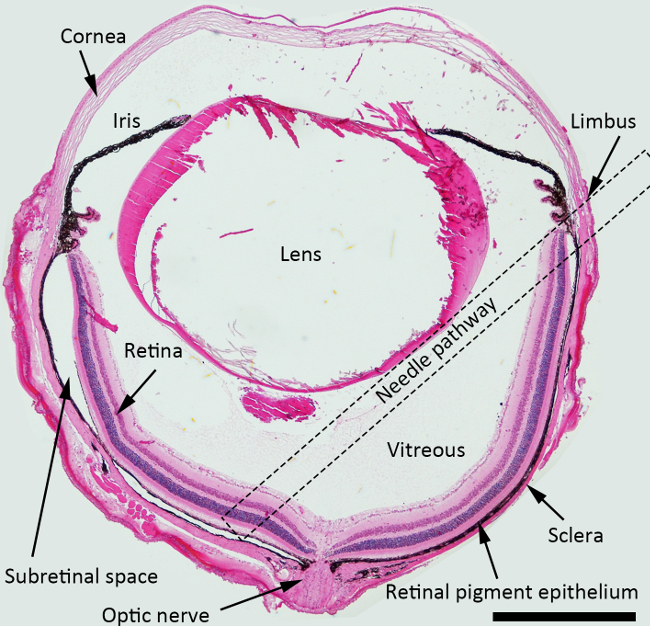
Рисунок 1. Принципиальная схема субретинальной инъекций. Н & Е окрашенных сечение глаза мыши с изображением структуры с иглы пути для субретинальной инъекции отмечены (пунктирная квадрат). Увеличение: 40х, шкала бар: 500 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Вводите вирусные векторы (например, 1 × 10 6 ТУ / мкл) аккуратно в субретинальной пространстве без дрожи, чтобы избежать нежелательного повреждения тканей и вывести иглу осторожно. Держите глазное яблоко плотно во время инъекции, как описано в 2.4.
- Соблюдайте образование субретинальной пузырька после инъекции под операционным микроскопом, чтобы убедиться, что нет кровотечения сетчатки.
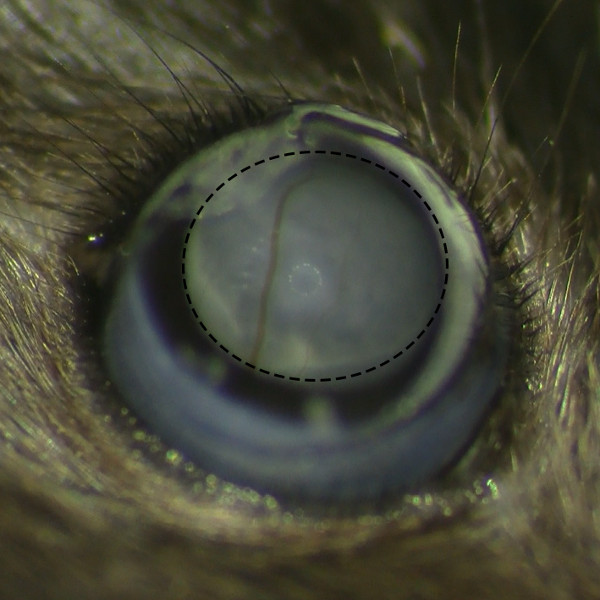
Рисунок 2. субретинальной Belb Формирование без кровоизлияние в сетчатку глаза. Микроскопическое вид субретинальной belb после субретинальной инъекции под операционным микроскопом показывает успешное формирование пузырька без сетчатки кровоизлияния.м / файлы / ftp_upload / 53030 / 53030fig2large.jpg "цель =" _ пустое "> Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Аккуратно закройте веко, чтобы покрыть участок инъекции для самоуплотнением. Возврат мышей клетку и держать в живых, пока оценки.
ПРИМЕЧАНИЕ: После того, как исследователи привыкнуть к процедурам, они могут получить воспроизводимые результаты с быстрыми процедурами, пропуская эти шаги (2,5, 6 и 10)
3. Оценка эффективности доставки генов в пигментный эпителий сетчатки
- Жертвоприношение мышей в CO 2 камеры. Выяснять глаза с помощью ножниц.
- Закрепите глаза в 4% -ном растворе параформальдегида при 4 ° С в течение минимум 1 часа до нескольких дней.
- Возьмите роговицы с тонкими щипцами и прокол роговицы с микро-ножниц. Удалить роговицы после ножницами вдоль лимба. Снимите объектив с щипцами.
- Обрезать цилиарного тела с мМОИК-ножницы, позволяющие отслоение сетчатки. Осторожно потяните весь сетчатку от НПП / сосудистое / склеры комплекса. Вырезать НПП / сосудистое / склеры комплекс в радиальном направлении от периферии к центру возле зрительного нерва несколько раз, чтобы сделать от 4 до 8 листьев для плоской монтажа.
- Переверните НПП / сосудистое / склеры комплекс, чтобы сделать НПП стороной вниз, и обрезать все оставшиеся ткани на склеры стороны, включая мышцы, конъюнктивы и зрительного нерва. Этот шаг важен, чтобы сделать плоскую НПП / сосудистое / склеры комплекс, потому что все оставшиеся ткани делает комплекс неравномерно.
- Выдержите комплекс с первичного и вторичного антитела для ваших конкретных научно-исследовательских целей (опционально, см ссылки на подробные методы). Мини-установки ПЭС / сосудистое / склеры комплексы на стекло и поглощать PBS с абсорбирующим губка.
- Добавить 30 мкл решение для монтажа и поместите крышку слайд. Соблюдайте образец для эффективности вектора поставки по флуоресцеина микроскопом. Держите образцыхолодильник для дальнейшего наблюдения.
Результаты
Чтобы оценить эффективность субретинальной инъекции на вирусных генов трансдукции этим протоколом, мы использовали коммерчески доступные векторы LV с промотора цитомегаловируса, экспрессирующих GFP как и RFP для индикатора. Глаза удаляли ядра после соответствующего периода времени в с?...
Обсуждение
В этом видео статье мы описали лимбальных-подход субретинальной технику впрыска подробно с представительными результатами НПП / сосудистой оболочки / склеры плоским горе. Это простой и удобный метод для субретинальной инъекции вирусных векторов в ПЭС. Прямая визуализация образования...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Это исследование было поддержано Сеульского национального университета научно-исследовательского гранта (800-20140542), Программа исследований Пионер NRF / МОНТ (2012-0009544), и анализ технологии Программа Био-сигнала Инновация NRF / МОНТ (2009-0090895), и Грант NRF / МОНТ (2015M3A9E6028949).
Материалы
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Ссылки
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены