Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fareler Retina Pigment Epitel Gen Tedavisi için Viral Vektörler Limbal Yaklaşım-Subretinal Enjeksiyon
Bu Makalede
Özet
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Özet
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Giriş
Oftalmolojide, gen terapisi monogenik miras retinopatilerin tedavi yöntemi olarak ortaya çıkmıştır. Leber konjenital amurosis 1,2, retinitis pigmentosa 3 ve Koroideremi 4 olmak üzere retina pigment epiteli (RPE) genlerin ilişkili kalıtsal retinopatiler vardır. gen tedavisi araştırma alanı preklinik çalışmalarda ve adeno virüsü enzimi yüksek yoğunluklu lipoproteinlerde (AAV), lentivirüs (LV) ve adenovirüs (Ad) gibi viral vektörler kullanılarak klinik çalışmalarda hem de genişliyor 5. Farklı viral vektörler retina farklı tropizm ihtiva. Güvenli ve etkili bir gen terapisi için viral vektörler, dikkatli bir şekilde hedef hücreler ve hedef genlerin uygun olarak seçilmelidir.
etkili bir gen verici hedef hücrelere gen teslim yolu bu nedenle, dikkatli bir şekilde da seçilmelidir, da önemlidir. viral vektörlerin göz içi teslimat için en yaygın iki yöntemler subret edilirinal enjeksiyon ve intravitreal enjeksiyon 6. İkincisi, intravitreal enjeksiyon, yaygın diyabetik retinopati 7 ıslak yaşa bağlı makula dejenerasyonu (YBMD) ve maküla ödemi koroid neovaskülarizasyon tedavisi için ilaç verilmesi için kullanılır olmuştur. İntravitreal rota vitreus ve iç retina viral vektörlerin pozlama sağlar, ancak dış retinaya vektörlerin difüzyon sınırlıdır. Öte yandan, alt retinal yol lokalize bir kabarcık indükleyici, retina ve RPE arasındaki potansiyel boşluğa viral vektörlerin doğrudan dağıtım sağlar. Bu nedenle, alt retinal enjeksiyon anda fotoreseptör hücreleri ve RPE hedefleme için daha verimli bir yol olarak kabul edilir. Cerrahi yaklaşım açısından, plana insan hastalarda retina hasarı önlemek için intravitreal enjeksiyon için güvenli bir alan olarak seçilmiştir pars. Sadece farelere bu yaklaşımı değiştirerek, biz limbal yaklaşımla subretinally veya intravireally viral vektörlerin enjekte edebilir.
Bu videodamakale, biz fareler RPE viral vektörlerin subretinal enjeksiyonu kolay ve uygun bir yöntem ortaya koymaktadır. 30 G 1/2 iğne ile limbusa posterior tekli delme sonra, 33 G iğne künt donanımlı mikrolitre şırınga limbal ponksiyon sitesi üzerinden subretinal boşluğa yerleştirilir. 1.5 viral vektörler - 2 ul hacminde, retina ve RPE subretinal kabarcıkları indükleyici arasındaki potansiyel boşluğa enjekte edilir. Bu prosedür, cerrahi mikroskop kullanılarak doğrudan görüş altında gerçekleştirilebilir. Tekrarlanan uygulama bile kabarcık oluşumu doğrudan görselleştirme olmadan tekrarlanabilir sonuçları garanti edecektir. Bu fareler RPE subretinal gen aktarımı için doğru ve zaman kazandıran deneyler gerçekleştirmek için araştırmacıların yardımcı olacaktır.
Protokol
Hayvanlar üzerinde deneyler tüm Oftalmik ve Vizyon Araştırma Hayvanların Kullanım Vizyon ve Oftalmoloji Tablosunda Araştırma Derneği göre yapılan ve kurallar ve yönetmelikler Seul Ulusal Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi ve Seul Ulusal öngördüğü edildi Üniversite Hastanesi Biyogüvenlik Komitesi.
1. Enjeksiyon Kit ve Viral Vektörler hazırlanması
- Etilen oksit gazı ile sterilize edilmiş bir 33 G, kör bir iğne ile donatılmış mikrolitre şırınga hazırlayın. Mikro tüp (yani, 1 x 10 6 TU / ml) 'de yeterli bir titre PBS içinde viral vektörleri ile seyreltilir. Şırınga herhangi ölü boşluğu kaldırmak için enjektörü viral vektörler ile birkaç kez yıkayın.
Viral vektörler 2. Subretinal Enjeksiyon
- Tiletami karışımının intraperitoneal enjeksiyonu ile - (8 haftalık, yani, 6), yetişkin fareler anesteziKD ve zolazepam (1: 1, 2.25 mg / kg vücut ağırlığı) ve ksilazin hidroklorür (0.7 mg / kg vücut ağırlığı) ya da alternatif olarak uygun anestezi rejimi.
- Fenilefrin% 0.5 göz damlası ile öğrenciler dilate ve% 0.5 tropikamid.
- Viral vektörlerin 2 ul - 1.5 ile yüklenerek mikrolitre şırınga hazırlayın.
- Göz kapağı açın ve uygun enjeksiyon için ekvator ortaya çıkarmak ve işletim mikroskop altında odaklanmak göz çıkıntı. Enjeksiyon sırasında oluşabilecek iğne enjeksiyonu veya deplasman bitirme kadar çıkıntı göz pozisyonunu koruyun. Sıkıca göz küresi tutun, yörünge jant dışında parmaklarını yerleştirin.
- Kornea yüzeyine oftalmik viskoelastik bir çözelti damla uygulanır.
- Retina görselleştirmek için kornea üstünde küçük bir yuvarlak kapak slayt yerleştirin.
- Daha fazla subretinal enjeksiyon için steril 30 G 1/2 iğne kullanılarak limbusa hafif posterior küçük bir delik delmek. Fo delik aşağı olunr sağ göz ve rahatlık için sol göz için üstün.
NOT: delik zamansal ya da nazal yapılır ise, enjeksiyondan sonra göz kapağında kapsamına zor. İlk ponksiyon hafifçe yapılan limbusun boyunca çalışacak ve kolayca tanınabilir limbal damarları önlemek için limbusa posteriorunda edilmelidir. İlk ponksiyon yapılırken iğne ile lensi çarpmamak için dikkatli olun. Lens ponksiyon önlemek için iğnenin tüm konik takmayın. - Önceden delinmiş delikten mikrolitre şırınga 33 G künt iğne yerleştirin ve hafif direnç hissedilir zaman noktaya kadar subretinal boşluğa iğne yaklaşım.
NOT: subretinal enjeksiyon için, iğnenin en iyi yaklaşım açısı iris düzleminin karşı yaklaşık 45 derece, ve künt bir iğne peripapiller alana doğru posterior itti olmalıdır. Noktalı kare subretinal injectio için vitreus boşluğuna genelinde önerilen iğne yolu belirtilenŞekil 1 'de: n.
NOT: Onlar çok yumuşak olduğu gibi delici (veya geçen) retina katmanları zaman direnç hissettim olacak. Böylece, hafif direnç ilk duygu iğne zaten RPE dokundu ve iğnenin takılması durdurulması gerektiğini belirtir. İğne potansiyel subretinal alana konulmalıdır çünkü aşırı basınç skleral doku nüfuz için dikkatli olun. İğne aşırı güç tarafından skleral doku deler, bu direnç olmadan göz dışı yörünge alanlarda girer. (Bu adım önemlidir)
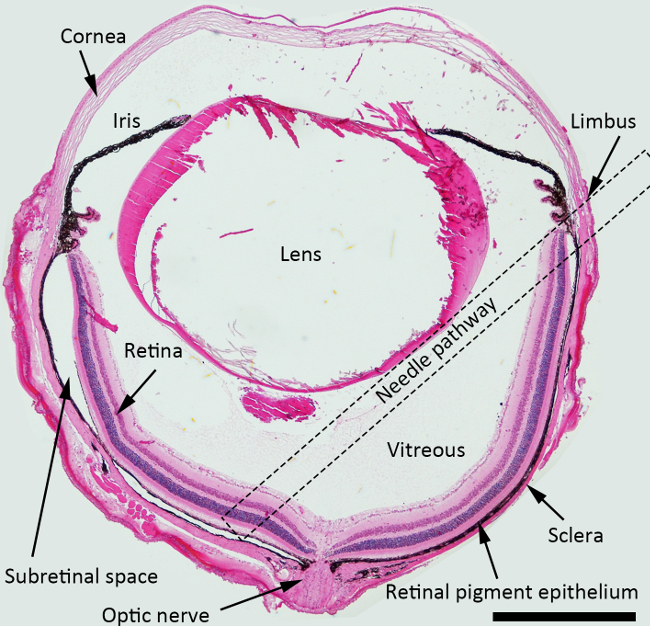
Subretinal Enjeksiyon Şekil 1. Şematik. H & E işaretli subretinal enjeksiyon için bir iğne yolunun olan yapıları resmeden fare göz lekeli kesiti (noktalı kare). Büyütme: 40X, Ölçek çubuğu: 500 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- İstenmeyen doku hasarını önlemek ve yavaşça iğneyi çekilme titreme olmadan subretinal boşluğa yavaşça viral vektörler (örneğin, 1 x 10 6 TU / ul) enjekte edilir. 2.4'te tarif edildiği gibi enjeksiyon sırasında sıkıca gözün tutun.
- Hiçbir retina kanaması olduğundan emin olmak için, işletim mikroskop altında enjekte edildikten sonra subretinal bleb oluşumunu gözlemleyin.
Şekil 2. Retina Kanama olmadan Subretinal BELB Formasyonu. Işletim mikroskop altında subretinal enjeksiyondan sonra subretinal BELB mikroskopik görünümü retinal kanama olmadan başarılı bleb oluşumu göstermektedir.m / files / ftp_upload / 53030 / 53030fig2large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
- Yavaşça kendini sızdırmazlık için enjeksiyon yerinde kapsayacak şekilde göz kapaklarını kapatın. Ev kafesine fareler dönün ve değerlendirme kadar canlı tutmak.
NOT: Araştırmacılar prosedürlere alışması sonra, aşağıdaki adımları atlayarak hızlı prosedürlere tekrarlanabilir sonuçlar elde (2.5, 6, ve 10) olabilir
Retina Pigment Epitel Gen Teslimat Etkinliğinin Değerlendirilmesi 3.
- CO2 odası içinde fareler kurban. Makas kullanılarak gözleri enükleasyon.
- Birkaç gün için en az 1 saat boyunca 4 ° C 'de% 4 paraformaldehit solüsyonunda gözleri düzeltildi.
- Ince forseps ile kornea tut ve mikro-makas ile kornea delinme. Limbusun boyunca makaslama sonra kornea çıkarın. Forseps ile lensi çıkarın.
- M siliyer cisim Trimretina dekolmanı izin ICRO-makas. Yavaşça RPE / koroid / sklera karmaşık bütün retinanın çekin. Düz montaj için 4 ila 8 yaprakları yapmak için optik sinir birkaç kez yakın merkeze çevresinden radyal RPE / koroid / sklera kompleksi kesin.
- Aşağı RPE tarafı yapmak ve kas, konjonktiva ve optik sinir dahil skleral tarafında kalan tüm dokuları kesmek için RPE / koroid / sklera kompleksi çevirin. Kalan doku, karmaşık düzensiz hale getirir, çünkü bu adım, düz RPE / koroid / sklera kompleksi yapmak önemlidir.
- (Ayrıntılı yöntemleri için referanslara bakın, isteğe bağlı) özel araştırma amaçlı birincil ve ikincil antikor ile kompleks inkübe edin. Cam slayt RPE / koroid / sklera kompleksleri Düz montaj ve emici bir sünger ile PBS emer.
- Montaj çözümü 30 ul ekleyin ve kapağını kaydırarak yerleştirin. Floresein mikroskop altında vektör teslim etkinliği için örnek gözlemleyin. Örnekleri tutunDaha fazla gözlem için buzdolabı.
Sonuçlar
Bu protokol ile viral gen transdüksiyon üzerinde subretinal enjeksiyonunun etkinliğini değerlendirmek için, göstergesi GFP ve RFP hem ifade CMV promotör ile piyasada mevcut LV vektörleri kullanılır. Gözler araştırma amacına göre uygun süre sonra iki parçaya ayrıldı. Temsilcisi sonuçları için gözler 10 hafta ve subretinal enjeksiyondan sonra 20 hafta parçaya ayrıldı. Yukarıda tarif edilen yöntem kullanılarak, retina tamamen uzaklaştırıldıktan sonra, RPE / koroid / sklera kompleksinin düz...
Tartışmalar
Bu video makalede, biz RPE / koroid / sklera düz montaj temsilcisi sonuçları ile detaylı limbal-yaklaşım subretinal enjeksiyon tekniği nitelendirdi. Bu RPE viral vektörlerin retina altı enjeksiyon için kolay ve uygun bir tekniktir. Enjeksiyon sırasında kabarcık oluşumu doğrudan görselleştirme yeni başlayanlar için doğru bir teslimat için önemli bir adımdır. Visualized Experiments 8-10 Journal tanıtılan bazı subretinal enjeksiyon teknikleri vardır. Subretinal alan retina ve RPE aras...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu çalışma Seul Ulusal Üniversitesi Araştırma Grant (800-20140542) tarafından desteklenen, NTG / EBTB Pioneer Araştırma Programı (2012-0009544) ve NRF / EBTB Bio-Sinyal Analizi Teknoloji İnovasyon Programı (2009-0090895), ve NRF / EBTB Hibe (2015M3A9E6028949).
Malzemeler
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Referanslar
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır