A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הזרקת גישת subretinal Limbal של ויראלי וקטורים לטיפול גנטי בעכברים הרשתית פיגמנט האפיתל
In This Article
Summary
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Abstract
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introduction
ברפואת עיניים, ריפוי גנטי התגלה כשיטת הטיפול בretinopathies ירש monogenic. יש retinopathies ירושה הקשורים לגנים באפיתל של רשתית פיגמנט (RPE) כולל amurosis לבר מולדת 1,2, פיגמנטוזה רטיניטיס 3, וchoroideremia 4. שדה המחקר של ריפוי גנטי מתרחב בשני מחקרים פרה-קליניים וניסויים קליניים באמצעות וקטורים ויראליים כגון וירוס adeno -associated (AAV), lentivirus (LV) ואדנווירוס (מודעות) 5. יש וקטורים ויראליים שונים כמיהות שונות ברשתית. לריפוי גנטי בטוח ויעיל, יש לבחור וקטורים ויראליים בזהירות בהתאם לתאי מטרה וגני המטרה.
תוואי מסירת הגן הוא גם חשובים למסירת גן יעילה למקד תאים, ובכך, אותו יש לבחור בקפידה, כמו גם. שתי שיטות הנפוצות ביותר למסירת התוך עינית של וקטורים ויראליים הם subretהזרקת INAL והזרקת זגוגית 6. ההזרקה האחרונה, הזגוגית, כבר בשימוש נרחב למסירת תרופה לטיפול בneovascularization choroidal בניוון רטוב הקשורות לגיל מקולרי (AMD) ובצקת מקולרית ברטינופתיה סוכרתית 7. מסלול זגוגית מספק חשיפה של וקטורים ויראליים לרשתית זגוגית והפנימית, אבל דיפוזיה של הווקטורים לרשתית חיצונית היא מוגבלת. מצד השני, מסלול subretinal מספק משלוח ישיר של וקטורים ויראליים למרחב הפוטנציאלי בין הרשתית ורשתית, גרימת בועה מקומית. לכן, הזרקת subretinal נחשבת כיום דרך יעילה יותר למיקוד תאי קולטי האור ורשתית. במונחים של גישה ניתוחית, pars Plana נבחר כאזור בטוח להזרקת זגוגית כדי למנוע נזק ברשתית בחולים אנושיים. פשוט על ידי שינוי בגישה זו כדי עכברים, אנחנו יכולים להזריק וקטורים ויראליים subretinally או intravireally באמצעות גישת limbal.
בסרטון הזהמאמר, אנחנו מדגימים שיטה קלה ונוחה של הזרקת subretinal של וקטורים ויראליים לרשתית עכברים. לאחר ניקור יחיד באחורי לימבוס עם מחט 30 G 1/2, מזרק microliter המצויד 33 מחט קהה G מוכנס לתוך חלל subretinal באמצעות האתר לנקב limbal. הווקטורים ויראליים של 1.5 - 2 μl נפח מוזרקים למרחב הפוטנציאלי בין הרשתית ורשתית גרימת שלפוחיות subretinal. הליך זה יכול להתבצע תחת הדמיה ישירה באמצעות מיקרוסקופ הניתוחי. תרגול חוזרים ונשנים יבטיח תוצאות לשכפול גם ללא הדמיה ישירה של היווצרות בועה. זה יעזור לי החוקרים לבצע ניסויים מדויקים וחיסכון בזמן למסירת גן subretinal ברשתית עכברים.
Protocol
כל הניסויים בבעלי החיים בוצעו בהתאם לעמותה למחקר בהצהרת חזון ורפואת עיניים לשימוש בבעלי חיים ברפואת עיניים ומחקר חזון, וההנחיות והתקנות שנקבעו על ידי הוועדה מוסדית אוניברסיטת הטיפול בבעלי חיים והשימוש סיאול הלאומית וסיאול הלאומית ועדת בטיחות ביולוגית בבית חולים האוניברסיטאי.
1. הכנת ערכת הזרקה ווקטורים ויראליים
- הכן את מזרק microliter מצויד במחט קהה 33 G המעוקרים באמצעות גז אתילן אוקסיד. לדלל את הווקטורים ויראליים בPBS לכייל נאות בצינור מיקרו (כלומר, 1 x 10 6 TU / μl). לשטוף את המזרק מספר פעמים עם וקטורים ויראליים כדי להסיר כל שטח מת במזרק.
2. הזרקת subretinal של וקטורים ויראליים
- להרדים את העכברים הבוגרים (כלומר, 6-8 שבועות) עם זריקת intraperitoneal של התערובת של tiletamine וzolazepam (1: 1, 2.25 מ"ג / קילוגרם משקל גוף) וhydrochloride xylazine (0.7 מ"ג / קילוגרם משקל גוף) או משטר הרדמה מתאים חלופית.
- להתרחב תלמידים עם ירידה של 0.5% עין phenylephrine וtropicamide 0.5%.
- הכן את מזרק microliter על ידי טעינה עם 1.5 - 2 μl של וקטורים ויראליים.
- פתח את העפעף ובולט לעין כדי לחשוף את קו המשווה להזרקה נוחה ולהתמקד במתחת למיקרוסקופ ההפעלה. לשמור על מיקום העין בלטו עד גמר ההזרקה, או עקירה של המחט יכול להתרחש במהלך ההזרקה. להחזיק את גלגל העין בחוזקה, למקם את האצבעות מחוץ לשפת מסלולית.
- החל ירידה של פתרון viscoelastic עיניים אל פני השטח של הקרנית.
- מקום שקופית כיסוי עגול קטנה בחלק העליון של הקרנית כדי להמחיש את הרשתית.
- לנקב חור קטן באחורי קלה לימבוס באמצעות מחט סטרילית 30 G 1/2 להזרקת subretinal נוספת. הפוך את החור נחותים FOr עין ימין, ומעולה לעין השמאל לנוחות.
הערה: אם החור הוא עשה בזמן, או באף, זה קשה להיות מכוסה על ידי העפעף לאחר ההזרקה. לנקב ראשוני צריכים להיעשות מעט אחורי לימבוס, כדי למנוע את כלי limbal אשר לרוץ לאורך ימבוס וניתן לזהות בקלות. להיות זהיר כדי להימנע מפגיעה בעדשה עם מחט בעת ביצוע הניקור הראשוני. אל תכניס את כל השיפוע של המחט, כדי למנוע ניקור עדשה. - מניחים את המחט הקהה 33 G של מזרק microliter דרך החור המנוקב מראש ומתקרב למחט לתוך חלל subretinal עד הנקודה שבה התנגדות קלה מורגשת.
הערה: להזרקת subretinal, זווית הגישה הטובה ביותר של המחט היא כ -45 מעלות נגד מטוס איריס, והמחט הקהה יש דחף בדיעבד כלפי אזור peripapillary. כיכר מנוקדת הצביעה על מסלול המחט הציע על פני חלל הזגוגית לInjectio subretinaln באיור 1.
הערה: לא יהיה התנגדות הרגישה כאשר פירסינג (או הפטירה) שכבות רשתית כפי שהם רכים מאוד. לפיכך, התחושה הראשונה של התנגדות מתונה מצביעה על כך שהמחט כבר נגעה בשכבת הרשתית והחדרת המחט צריכה להיפסק. היזהר שלא לחדור לרקמות scleral עם לחץ מוגזם בגלל המחט צריכה להיות ממוקמת בחלל subretinal הפוטנציאלי. אם המחט מפוצצת רקמות scleral ידי כוח מופרז, הוא נכנס לתוך חללי מסלולית extraocular ללא התנגדות. (שלב זה הוא קריטי)
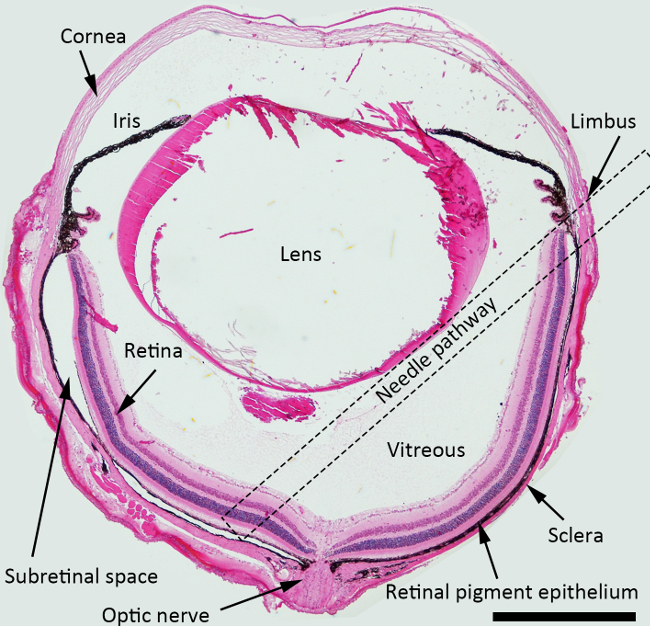
איור 1. סכמטי תרשים של הזרקת subretinal. H & E סעיף מוכתם צלב של העין העכבר המתארת את המבנים עם מסלול מחט להזרקת subretinal המסומן (כיכר מקווקו). הגדלה: 40X, בר סולם: 500 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- להזריק את הווקטורים ויראליים (כלומר, 1 x 10 6 TU / μl) בעדינות לתוך חלל subretinal ללא רעד, כדי למנוע נזק לרקמות לא רצויים ולמשוך את המחט בעדינות. החזק את גלגל העין בחוזקה במהלך ההזרקה כפי שתואר ב2.4.
- לצפות את ההיווצרות של בועה subretinal לאחר ההזרקה תחת מיקרוסקופ כדי לוודא שאין דימום ברשתית.
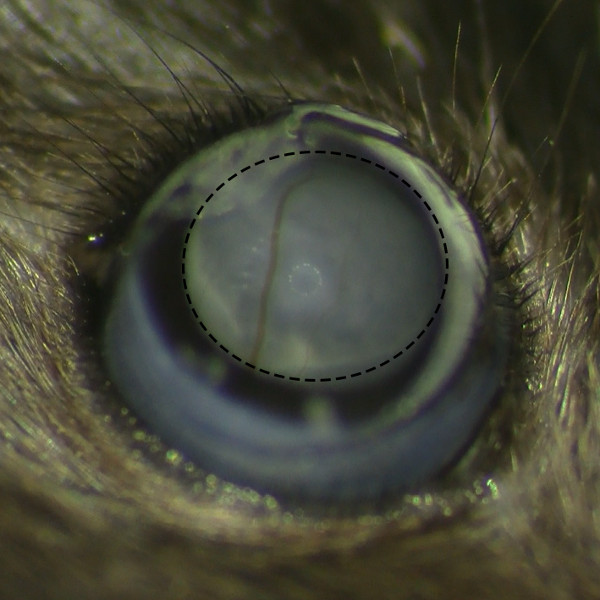
איור 2. גיבוש subretinal Belb ללא רשתית דימום. מבט מיקרוסקופי של belb subretinal לאחר הזרקת subretinal תחת מיקרוסקופ ניתן לראות היווצרות בועה מוצלחת ללא דימום ברשתית.מ '/ קבצים / ftp_upload / 53030 53030fig2large.jpg "target =" / _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- בעדינות לסגור את העפעף כדי לכסות את אתר ההזרקה לאיטום עצמי. להחזיר את העכברים לכלוב בבית ולהישאר בחיים עד ההערכה.
הערה: לאחר שהחוקרים להתרגל לנהלים, הם יכולים לקבל את תוצאות הדיר עם נהלים מהירים על ידי דילוג על השלבים הבאים (2.5, 6, ו -10)
3. הערכת היעילות של ג'ין משלוח ברשתית פיגמנט האפיתל
- להקריב את העכברים בתא CO 2. Enucleate העיניים באמצעות מספריים.
- תקן את העיניים בפתרון paraformaldehyde 4% ב 4 מעלות צלזיוס במשך שעה 1 מינימום לכמה ימים.
- תפוס את הקרנית עם מלקחיים עדינים ולנקב את הקרנית עם מיקרו מספריים. הסר את הקרנית לאחר המספריים לאורך ימבוס. הסר את העדשה עם מלקחיים.
- חתוך את גוף הריסים עם מ 'icro-מספריים המאפשרים היפרדות רשתית. משוך בעדינות את כל הרשתית מהרשתית / דמית העין / מורכבת לובן העין. חותך את הרשתית / דמית העין / המורכב scleral רדיאלית מהפריפריה למרכז ליד כמה פעמים עצב הראייה לעשות 4-8 עלים להרכבה שטוחה.
- הפוך את הרשתית / דמית העין / המורכב scleral לעשות צד הרשתית למטה, ולקצץ את כל הרקמות שנותרו בצד scleral כולל שרירים, לחמית ועצב ראייה. שלב זה חשוב לעשות הרשתית / דמית העין / מורכב scleral שטוח כי כל רקמה שנותרה הופכת אחידה מורכב.
- דגירה מורכבת עם נוגדן ראשוני והמשני למטרות הספציפיות שלך המחקר (אופציונליות, ראה אזכור לשיטות מפורטות). שטוח הר הרשתית / דמית העין / מתחמי scleral בשקופית הזכוכית ולספוג את PBS עם ספוג סופג.
- הוסף 30 μl של פתרון הרכבה ולמקם את כיסוי השקופיות. שים לב לדוגמא ליעילות של משלוח וקטור תחת מיקרוסקופ והעמסת. שמור את הדגימות בהמקרר לתצפית נוספת.
תוצאות
כדי להעריך את היעילות של הזרקת subretinal על התמרה גנטית נגיפית על ידי פרוטוקול זה, השתמשנו וקטורי LV זמינים מסחרי עם אמרגן CMV להביע שני GFP וRFP למדד. עיניים enucleated לאחר תקופת הזמן המתאימה בהתאם למטרת המחקר. לקבלת תוצאות הנציג, עיניים enucleated 10 שבועות ו -20 שבועות לאחר הזרקת subretinal. ...
Discussion
במאמר זה וידאו, שתארנו את טכניקת הזרקת subretinal limbal-גישה בפירוט עם תוצאות נציג של הרשתית / דמית העין / שטוח הר scleral. זוהי טכניקה קלה ונוחה להזרקת subretinal של וקטורים ויראליים לרשתית. הדמיה ישירה של היווצרות בועה במהלך ההזרקה היא צעד חשוב למסירה מדויקת למתחילים. יש כמה טכניקות...
Disclosures
The authors have nothing to disclose.
Acknowledgements
מחקר זה נתמך על ידי סיאול האוניברסיטה הלאומית מענק המחקר (800-20140542), תכנית פיוניר המחקר של NRF / MEST (2012-0009544), וניתוח הטכנולוגיה התכנית ביו-האיתותים החדשנות של NRF / MEST (2009-0090895), וגרנט של NRF / MEST (2015M3A9E6028949).
Materials
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
References
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved