JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 망막 색소 상피의 유전자 치료에 대한 바이러스 벡터의 윤부 접근 - 망막 주입
요약
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
초록
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
서문
안과에서, 유전자 치료는 단일 유전자 상속 망막증의 치료법으로서 등장했다. Leber 씨 선천성 amurosis 1,2, 색소 성 망막염 (3), (4)를 포함 choroideremia 망막 색소 상피 (RPE) 유전자와 연관된 상속 망막 병증이있다. 유전자 치료의 연구 분야는 전임상 연구 및 아데노 -associated 바이러스 (AAV), 렌티 바이러스 (LV) 및 아데노 바이러스 (AD)와 같은 바이러스 벡터를 사용하여 임상 시험 모두에서 확대되고있다 (5). 다른 바이러스 성 벡터는 망막에 다른 친 화성이있다. 안전하고 효과적인 유전자 치료의 경우, 바이러스 벡터 신중 표적 세포와 표적 유전자에 따라 선택되어야한다.
효율적인 유전자 전달이 표적 세포에 대한 유전자 전달의 경로는 따라서 신중뿐만 선택되어야한다, 또한 중요하다. 바이러스 벡터의 인공 전달을위한 가장 일반적인 두 가지 방법이 subret된다원고 판 주입과 유리체 강내 주입 6. 후자 주입술 널리 당뇨 망막 7 습식 노인성 황반변 성 (AMD) 및 황반부 종의 맥락막 혈관 신생을 치료하는 약물 전달을 위해 사용되었다. 유리체 강내 경로 및 내측 망막 바이러스 벡터의 노광을 제공하지만, 외측 망막 벡터의 확산이 제한된다. 한편, 망막 경로 지역화 여과포를 유도, 망막 및 RPE 간의 잠재적 바이러스 벡터 공간으로의 직접 전달을 제공한다. 따라서, 망막 하 주사 현재 시각 세포 및 RPE를 타겟팅보다 효율적인 경로로 간주된다. 수술 방법의 측면에서, 인간 환자 유리체 망막 손상을 방지하기 위해 주입술 안전한 영역으로서 선택된다 갈 거예요. 단순히 쥐에이 방법을 수정하여, 우리는 윤부 접근 방식을 통해 subretinally 또는 intravireally 바이러스 벡터를 주입 할 수있다.
이 비디오에서기사, 우리는 쥐의 망막 색소 상피에 바이러스 벡터의 망막 주사의 쉽고 편리한 방법을 보여줍니다. 30 G 1/2 바늘 윤부에 후방에서 단일 천자 후, 33 G 무딘 바늘 장착 된 마이크로 리터 주사기는 윤부 천자 사이트를 통해 망막 하 공간에 삽입됩니다. 1.5의 바이러스 성 벡터 - 2 μL 볼륨은 망막과 망막 색소 상피가 망막 소포를 유도 사이의 잠재적 인 공간으로 주입된다. 이 절차는 수술 현미경을 사용하는 직접적인 시각화 하에서 수행 될 수있다. 반복 연습도 여과포 형성의 직접 시각화없이 복제 결과를 보장합니다. 이 쥐의 망막 색소 상피에서 망막 유전자 전달에 대한 정확하고 시간을 절약 실험을 수행하는 연구자 도움이 될 것입니다.
프로토콜
동물에 대한 모든 실험은 안과 및 비전 연구에서 동물의 사용에 대한 비전 및 안과 문에 연구를위한 협회에 따라 수행하고, 지침과 규정은 서울 대학교 기관 동물 관리 및 사용위원회와 서울 대학교가 정한했다 대학 병원 바이오 안전성위원회.
1. 주입 키트 및 바이러스 성 벡터를 준비
- 에틸렌 옥사이드 가스를 사용하여 멸균 33 G 무딘 바늘을 갖춘 마이크로 리터 주사기를 준비한다. 마이크로 튜브 (즉, 1 × 6 TU / μL)의 적절한 역가에 대한 PBS에서 바이러스 벡터를 희석. 주사기 임의 사강을 제거하는 주사기를 바이러스 벡터로 수회 세척.
바이러스 성 벡터의 2. 망막 주입
- tiletami의 혼합물의 복강 내 주사 - (8 주 오래 즉, 6) 성인 쥐를 마취NE 및 zolazepam (1 : 1, 2.25 ㎎ / ㎏ 체중)과 자일 라진 하이드로 클로라이드 (0.7 ㎎ / ㎏ 체중) 또는 다른 적절한 마취 정권.
- 페닐에 0.5 %의 점안제와 동공 팽창 및 0.5 % tropicamide.
- 바이러스 벡터의 2 μL - 1.5로드하여 마이크로 리터 주사기를 준비합니다.
- 눈꺼풀을 열고 편리 주입 적도 노출 및 운영 현미경에 초점을 눈 돌출. 주입 동안 발생할 수있는 바늘의 주입, 또는 변위 마무리까지 돌출 눈 위치를 유지한다. 단단히 안구를 유지하기 위해, 궤도 림 외부에서 손가락을 놓습니다.
- 각막 표면 안과 점탄성 용액 한 방울을 적용한다.
- 망막을 시각화하는 각막의 상단에 작은 원형 커버 슬라이드를 놓습니다.
- 추가적인 망막 주 사용 멸균 1/2 30 G 바늘을 사용 윤부에 약간 후방에 작은 구멍이 천공. FO 구멍이 열등 확인R 우안과 편의상 좌안 우수한.
주 : 구멍 시간적 또는 비강에서 이루어진다면, 그것은 주입 후 눈꺼풀에 의해 커버되기 어렵다. 초기 구멍은 약간 만든 윤부를 따라 실행하고 쉽게 인식 할 수 윤부 혈관을 피하기 위해 윤부에 후부해야합니다. 초기 구멍을하는 동안 바늘로 렌즈를 타격 않도록주의하십시오. 렌즈 구멍을 피하기 위해 바늘의 전체 경사를 삽입하지 마십시오. - 사전 천공 구멍을 통해 마이크로 리터 주사기의 33 G 무딘 바늘을 놓고 가벼운 저항이 느껴지는 경우 지점까지 망막 하 공간에 바늘을 접근.
참고 : 망막 주사를 들어, 바늘의 가장 좋은 방법 각도는 조리개면에 대해 약 45도이며, 무딘 바늘은 유두 주위 지역을 향해 후방으로 밀어해야합니다. 점선 사각형은 망막 injectio의 유리 체강에서 제안 된 바늘의 경로를 표시그림 1에서 N.
참고 : 그들은 매우 부드럽고으로 관통 (또는 전달) 망막 층 경우에는 저항이 느끼지있을 것이다. 따라서, 온화한 저항 제 느낌 바늘 이미 RPE 층을 터치하고 바늘의 삽입이 중단되어야 함을 나타낸다. 바늘이 잠재적 인 망막 공간에 배치해야하기 때문에 과도한 압력과 공막 조직에 침투하지 않도록주의하십시오. 바늘이 과도한 전력에 의해 공막 조직을 천공하면, 저항없이 안구 궤도 공간으로 들어간다. (이 단계는 매우 중요하다)
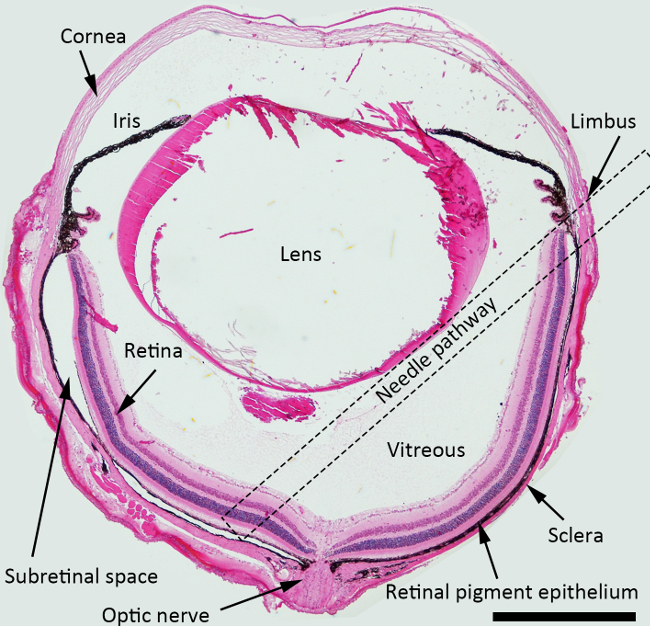
망막 사출 그림 1. 회로도. H & E 표시 망막 주사 바늘 경로와 구조를 묘사 마우스 눈의 스테인드 단면 (점선 사각형). 배율 : 40X, 스케일 바 : 500 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 불필요한 조직 손상을 방지하고 조심스럽게 바늘을 철회 떨림없이 망막 하 공간에 부드럽게 바이러스 벡터 (즉, 1 × 6 TU / μL)를 주입한다. 2.4에 설명 된대로 주입하는 동안 단단히 안구를 잡습니다.
- 더 망막 출혈이없는 것을 확인하기 위해 운영 현미경으로 주사 후 망막 여과포의 형성을 관찰한다.
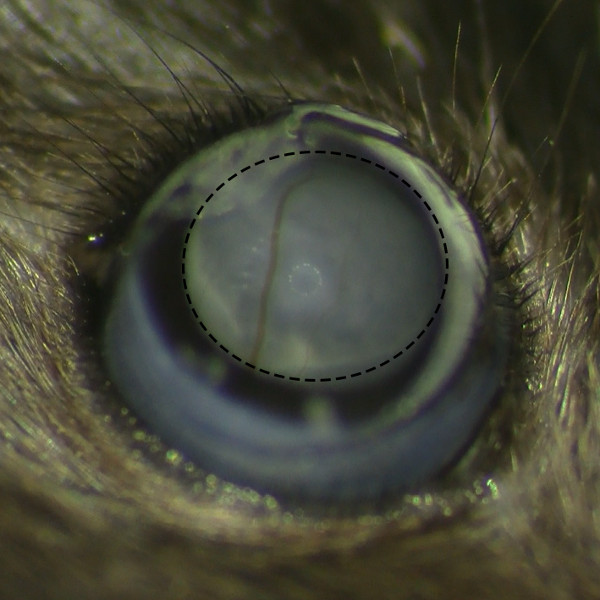
그림 2. 망막 출혈없이 망막 Belb 형성. 운영 현미경으로 망막 주사 후 망막 belb의 현미경보기 망막 출혈없이 성공적으로 여과포 형성을 보여줍니다.M / 파일 / ftp_upload / 53030 / 53030fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 부드럽게 자체 밀봉 용 주사 부위를 덮도록 눈꺼풀을 닫을. 홈 케이지에 마우스를 반환하고, 평가까지 살아 유지.
참고 : 연구자가 절차에 익숙해 후, 다음 단계 건너 뛰어 신속한 절차에 반복 가능한 결과를 얻을 수 (2.5, 6, 10) 수
망막 색소 상피의 유전자 전달의 효능 3. 평가
- CO 2 챔버에서 쥐를 희생. 가위를 사용하여 눈을 명백히하다.
- 며칠에 최소 1 시간 동안 4 ℃에서 4 % 파라 포름 알데히드 용액에서 쳐다.
- 미세 집게로 각막을 잡고 마이크로 가위로 각막에 구멍. 윤부를 따라 가위질 한 후 각막을 제거합니다. 집게로 렌즈를 제거합니다.
- M와 모양체 트림망막 박리를 허용 icro 가위. 조심스럽게 RPE / 맥락막 / 공막 단지에서 전체 망막을 잡아 당깁니다. 평면 실장 용 4~8 잎 있도록 시신경 수회 가까운 중심 둘레로부터 반경 RPE / 맥락막 / 공막 복합체를 잘라.
- 아래 망막 색소 상피면을 만들고, 근육, 결막 및 시신경을 포함하는 공막 측에 남아있는 모든 조직을 손질 할 수있는 RPE / 맥락막 / 공막 복잡한 플립. 나머지 조직은 복잡한 요철 구조를 만들기 때문에이 단계는 플랫 RPE / 맥락막 / 공막 복합체를 확인하는 것이 중요하다.
- (자세한 방법에 대한 내용을 참조, 선택 사항) 특정 연구 목적으로 기본 및 보조 항체 복합체를 품어. 유리 슬라이드에 RPE / 맥락막 / 공막 단지를 플랫 마운트 흡수성 스폰지로 PBS를 흡수한다.
- 장착 솔루션의 30 μl를 추가하고 커버 슬라이드를 배치합니다. 형광 현미경 벡터 전달의 효능에 대한 샘플을 관찰한다. 에 샘플을 유지더 관찰 냉장고.
결과
이 프로토콜에 의해 바이러스 성 유전자 전달에 망막 주사의 효능을 평가하기 위해, 우리는 인디케이터 GFP 및 RFP를 모두 표현하는 CMV 프로모터와 시판 LV 벡터를 사용했다. 눈은 연구 목적에 따라 적절한 시간 후에 적출 하였다. 대표적인 결과를 들어, 눈을 10 주에서 망막 주사 후 20 주 적출 하였다. 전술 한 방법을 사용하여 망막의 완전한 제거 후, RPE / 맥락막 / 공막 복합체의 평면 실장 형광 ...
토론
이 비디오 문서에서는, 우리는 RPE / 맥락막 / 공막 평면 마운트의 대표적인 결과를 상세하게 윤부-접근 망막 주입 기술을 설명했다. 이것은 망막 색소 상피에 바이러스 벡터의 망막 주입을위한 쉽고 편리한 기술이다. 주입시 여과포 형성의 직접 시각화는 초보자를위한 정확한 전달을위한 중요한 단계입니다. 시각 실험 8-10의 저널에 소개 된 일부 망막 사출 기술이있다. 망막 하 공간이 망?...
공개
The authors have nothing to disclose.
감사의 말
본 연구는 서울 대학교 연구 그랜트 (800-20140542)에 의해 지원되었다, NRF / 교육 과학 기술부의 개척자 연구 프로그램 (2012-0009544)과 NRF / 교육 과학 기술부의 바이오 신호 분석 기술 혁신 프로그램 (2009-0090895) 과 NRF / 교육 과학 기술부의 그랜트 (2015M3A9E6028949).
자료
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
참고문헌
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유