É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Limbo Abordagem-Subretinal injeção de vetores virais para terapia genética em ratos Retinal Pigment Epithelium
Neste Artigo
Resumo
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Resumo
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introdução
Em oftalmologia, terapia genética surgiu como a modalidade de tratamento em retinopatias hereditárias monogênicas. Há retinopatias herdados associados com genes no epitélio pigmentar da retina (RPE), incluindo Leber amurosis congênita 1,2, retinite pigmentosa 3, 4 e choroideremia. O campo da terapia genética de pesquisa está em expansão em ambos os estudos pré-clínicos e clínicos que utilizam vectores virais tais como vírus adeno -associated (AAV), lentivírus (LV) e adenovírus (Ad) 5. Diferentes vectores virais possuem tropismo diferente na retina. Para uma terapia génica eficaz e segura, vectores virais devem ser cuidadosamente seleccionados de acordo com as células alvo e genes alvo.
A via de entrega de genes, também é importante para a entrega de genes a células alvo eficaz, assim, deve ser cuidadosamente escolhida bem. Os dois métodos mais comuns para entrega intra-ocular de vectores virais são subretinal injeção e injeção intravítrea 6. Este último, injecção intravítrea, tem sido amplamente utilizada para a entrega de drogas para tratar a neovascularização coroidal em molhado degeneração macular relacionada com a idade (AMD) e o edema macular em retinopatia diabética 7. Via intravítrea proporciona uma exposição de vectores virais para a retina interna e vítreo, mas a difusão dos vectores a retina externa é limitada. Por outro lado, a via sub-retiniano fornece a entrega directa de vectores virais para o espaço potencial entre retina e EPR, induzindo uma vesícula localizada. Portanto, a injeção sub-retiniana é actualmente considerado como uma rota mais eficiente para o direcionamento de células fotorreceptoras e RPE. Em termos de abordagem cirúrgica, pars plana é escolhida como uma área segura para injeção intravítrea para evitar danos na retina em pacientes humanos. Por simplesmente modificar essa abordagem para ratos, poderíamos injetar vetores virais subretinally ou intravireally via abordagem de limbo.
Neste vídeoartigo, demonstramos um método fácil e conveniente de injecção sub-retiniana de vectores virais em ratinhos EPR. Após a punção único no limbo posterior para com uma agulha 30 G 1/2, 33 g de uma agulha romba microlitro equipado seringa é inserida no espaço sub-retiniano através do local de punção limbo. Os vectores virais de 1,5-2 ul de volume são injectados para o espaço potencial entre retina e EPR induzir bolhas subretinal. Este procedimento pode ser realizado sob visualização directa utilizando microscópio cirúrgico. A prática repetida irá garantir resultados replicáveis mesmo sem a visualização direta da formação de bolha. Isso vai ajudar os pesquisadores a realizar experimentos precisos e que economizam tempo para entrega gene em camundongos subretinal RPE.
Protocolo
Todos os experimentos em animais foram realizados de acordo com a Associação de Pesquisa em Visão e Oftalmologia Declaração para o uso de animais em Oftalmologia e Vision Research, e as diretrizes e regulamentos estabelecidos pela Universidade Animal Care Institucional e Comitê de Uso Seoul Nacional e Nacional de Seul Hospital Universitário Comitê de Biossegurança.
1. Preparação Kit injeção e Vetores Virais
- Prepare a seringa microlitro equipado com uma agulha romba 33 G esterilizados usando gás de óxido de etileno. Dilui-se a vectores virais em PBS durante a titulação adequada no tubo de micro (ou seja, 1 x 10 6 TU / mL). Lave a seringa várias vezes com vectores virais para remover qualquer espaço morto na seringa.
2. Injecção sub-retiniana de vetores virais
- Anestesiar os ratos adultos (ou seja, 6-8 semanas de idade) com uma injecção intraperitoneal de uma mistura de tiletamine zolazepam e (1: 1, 2,25 mg / kg de peso corporal) e cloridrato de xilazina (0,7 mg / kg de peso corporal) ou um regime de anestesia adequada alternativa.
- Dilatar pupilas com um colírio de fenilefrina e tropicamida 0,5% a 0,5%.
- Preparar a seringa microlitro por carregamento com 1,5-2 ul de vectores virais.
- Abra a pálpebra do olho e se projetam para expor o equador para injecção conveniente e focar sob o microscópio cirúrgico. Manter a posição dos olhos salientes até terminar a injecção, ou de deslocamento da agulha pode ocorrer durante a injecção. Para segurar o globo ocular firme, coloque os dedos fora da borda orbital.
- Aplicar uma gota de solução viscoelástica oftálmica para a superfície da córnea.
- Colocar uma pequena tampa deslizante rodada no topo da córnea para visualizar a retina.
- Perfurar um pequeno buraco no ligeira posterior ao limbo usando um estéril 30 G 1/2 agulha para a nova injecção sub-retiniana. Faça o buraco inferior for o olho direito, e superior para o olho esquerdo para a conveniência.
NOTA: Se o buraco é feito no temporais ou nasal, é difícil de ser coberta pela pálpebra após a injeção. Punção inicial deve ser feita ligeiramente posterior ao limbo para evitar os vasos do limbo, que correm ao longo do limbo e podem ser facilmente reconhecidas. Tenha cuidado para evitar bater a lente com agulha ao fazer a punção inicial. Não insira todo o bisel da agulha para evitar a perfuração da lente. - Inserir a agulha romba 33 g de microlitro seringa através do orifício pré-furado e aproximar-se a agulha no espaço sub-retiniano até o ponto em que é sentida a resistência moderada.
NOTA: Para a injeção sub-retiniana, o melhor ângulo de abordagem da agulha é de cerca de 45 graus contra plano da íris, ea agulha sem corte deve ser empurrado posteriormente em direção à área peripapilar. Quadrado pontilhado indicou o trajeto da agulha sugerido através da cavidade vítrea para o injectio subretinaln na Figura 1.
NOTA: Não haverá resistência sentiu quando perfuração (ou passagem) as camadas da retina como eles são muito moles. Assim, a primeira sensação de resistência leve indica que a agulha já tiver tocado na camada de EPR e a inserção da agulha deve ser interrompido. Tenha cuidado para não penetrar o tecido escleral com pressão excessiva porque a agulha deve ser colocada no potencial espaço sub-retiniano. Se a agulha perfura o tecido escleral por excesso de poder, ele entra nos espaços orbitais extra-oculares sem resistência. (Esta etapa é crítica)
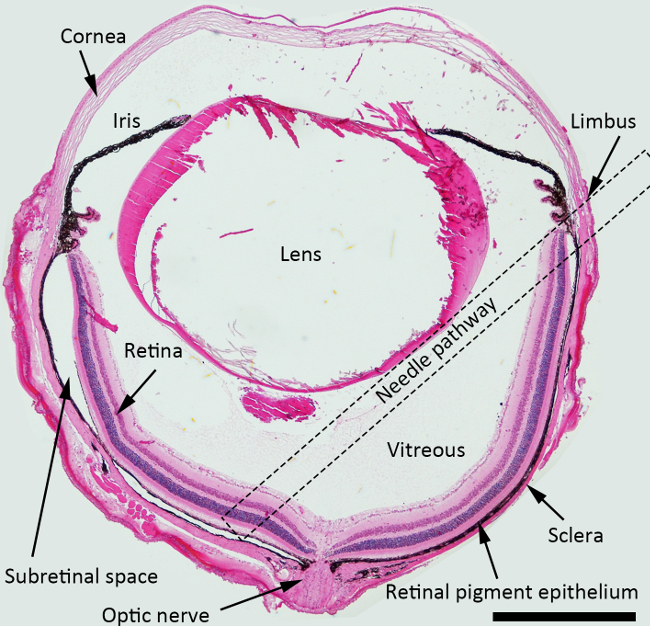
Figura 1. Diagrama esquemático da injeção sub-retiniana. H & E corte manchado do olho do rato que descreve as estruturas com um trajeto da agulha para a injeção sub-retiniana marcados (um quadrado pontilhada). Ampliação: 40X, Barra de escala: 500 mm. Por favor clique aqui para ver uma versão maior desta figura.
- Injectar os vectores virais (por exemplo, 1 x 10 6 TU / ul) suavemente para o espaço sub-retiniano sem tremor para evitar danos nos tecidos não desejados e retirar a agulha suavemente. Segurar firmemente o globo ocular durante a injecção, tal como descrito em 2.4.
- Observar a formação de bolha subretinal após a injecção sob microscópio cirúrgico para se certificar de que não há sangramento na retina.
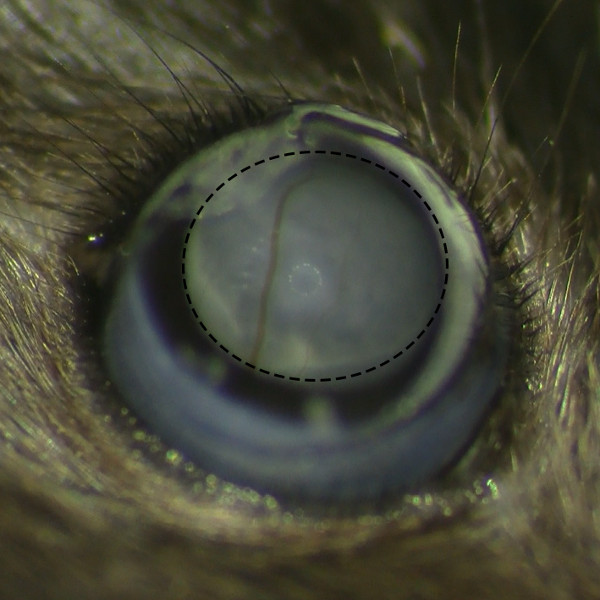
Figura 2. Formação Subretinal Belb sem retina Hemorragia. Vista microscópica de belb subretinal após a injeção sub-retiniana sob o microscópio de operação mostra a formação de bolha bem sucedido sem hemorragia retiniana.m / files / ftp_upload / 53030 / "target =" _ blank 53030fig2large.jpg "> Clique aqui para ver uma versão maior desta figura.
- Com cuidado, feche a pálpebra para cobrir o local da injecção de auto-selagem. Retornar os ratos para gaiola e manter viva até a avaliação.
NOTA: Depois que os pesquisadores se acostumar com os procedimentos, eles podem obter os resultados repetíveis com procedimentos rápidos saltando etapas (2,5, 6 e 10)
3. Avaliação da Eficácia da Entrega Gene em Retinal Pigment Epithelium
- Sacrifício dos ratinhos na câmara de CO 2. Enuclear os olhos com uma tesoura.
- Fixar os olhos na solução de paraformaldeído a 4% a 4 ° C durante um mínimo de 1 hora a alguns dias.
- Agarre a córnea com uma pinça fina e perfurar a córnea com micro-tesoura. Remover a córnea após tesoura ao longo do limbo. Retire a lente com uma pinça.
- Apare o corpo ciliar com mICRO-tesoura, permitindo o descolamento de retina. Puxe cuidadosamente toda a retina do / coróide / complexo esclera RPE. Cortar o RPE / coróide / complexo escleral radialmente a partir da periferia para o centro perto do nervo óptico várias vezes para fazer 4-8 folhas para montagem plana.
- Virar o RPE / coróide / complexo escleral para fazer lado RPE para baixo, e aparar todos os tecidos restantes na parte lateral escleral incluindo músculos, conjuntiva e nervo óptico. Este passo é importante fazer uma RPE / coróide / complexo escleral plana porque qualquer tecido remanescente torna o complexo desigual.
- Incubar o complexo com o anticorpo primário e secundário para seus fins específicos de investigação (opcional, consulte as referências para os métodos detalhados). Plano de montagem do EPR / coróide / complexos esclerais sobre a lâmina de vidro e absorver o PBS com uma esponja absorvente.
- Adicionar 30 ml de solução de montagem e coloque a cobertura deslizante. Observar a amostra para a eficácia da entrega do vetor sob o microscópio fluoresceína. Mantenha as amostras emo refrigerador para posterior observação.
Resultados
Para avaliar a eficácia da injecção sub-retinal na transdução de genes virais por este protocolo, foi utilizada vectores LV disponíveis comercialmente com o promotor de CMV expressando GFP e RFP para o indicador. Os olhos foram enucleados após o período de tempo adequado de acordo com a finalidade da investigação. Para os resultados representativos, os olhos foram enucleados 10 semanas e 20 semanas após a injeção sub-retiniana. Após a remoção completa da retina utilizando o método descrito acima, o plan...
Discussão
Neste artigo de vídeo, descrevemos o limbo abordagem técnica de injeção sub-retiniana em detalhe com resultados representativos de RPE / coróide / escleral flat-mount. Esta é uma técnica fácil e conveniente para a injecção sub-retiniana de vectores virais em EPR. A visualização direta da formação de bolha durante a injeção é um passo importante para a entrega correta para os novatos. Existem algumas técnicas de injeção subretinal introduzidas no Journal of Experiments Visualized 8-10. Espa...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este estudo foi apoiado pelo Seoul National University Research Grant (800-20140542), o Programa Pioneer Pesquisa da NRF / MEST (2012-0009544) ea Análise de Tecnologia Programa de Inovação Bio-Signal da NRF / MEST (2009-0090895), ea concessão da NRF / MEST (2015M3A9E6028949).
Materiais
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Referências
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados