Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Limbal injection Approche-sous-rétinienne de vecteurs viraux pour la thérapie génique chez la souris épithélium pigmentaire rétinien
Dans cet article
Résumé
Subretinal injection is a surgical technique for effective gene delivery to retinal pigment epithelium in the mouse eye. Here we describe an easy and replicable method for subretinal injection of viral vectors to retinal pigment epithelium in experimental mice.
Résumé
The eye is a small and enclosed organ which makes it an ideal target for gene therapy. Recently various strategies have been applied to gene therapy in retinopathies using non-viral and viral gene delivery to the retina and retinal pigment epithelium (RPE). Subretinal injection is the best approach to deliver viral vectors directly to RPE cells. Before the clinical trial of a gene therapy, it is inevitable to validate the efficacy of the therapy in animal models of various retinopathies. Thus, subretinal injection in mice becomes a fundamental technique for an ocular gene therapy. In this protocol, we provide the easy and replicable technique for subretinal injection of viral vectors to experimental mice. This technique is modified from the intravitreal injection, which is widely used technique in ophthalmology clinics. The representative results of RPE/choroid/scleral complex flat-mount will help to understand the efficacy of this technique and adjust the volume and titer of viral vectors for the extent of gene transduction.
Introduction
En ophtalmologie, la thérapie génique a émergé comme la modalité de traitement dans les rétinopathies héréditaires monogéniques. Il ya rétinopathies héréditaires associés à des gènes de l'épithélium pigmentaire rétinien (EPR) dont Leber amurosis congénitale 1,2, la rétinite pigmentaire 3 et 4 choroideremia. Le domaine de la thérapie génique de la recherche est en pleine expansion dans les deux études précliniques et des essais cliniques utilisant des vecteurs viraux tels que le virus adéno -associated (AAV), lentivirus (LV) et l'adénovirus (Ad) 5. Différents vecteurs viraux ont un tropisme différent dans la rétine. Pour une thérapie génique efficace et sans danger, les vecteurs viraux doivent être soigneusement sélectionnées en fonction des cellules cibles et des gènes cibles.
La voie d'administration de gènes est également important pour la délivrance de gènes efficace à des cellules cibles, par conséquent, il doit être choisi avec soin aussi bien. Les deux méthodes les plus courantes pour la livraison intra-oculaire de vecteurs viraux sont subretInal injection et injection intravitréenne 6. Ce dernier, l'injection intravitréenne, a été largement utilisé pour l'administration de médicaments pour traiter la néovascularisation choroïdienne dans humide de la dégénérescence maculaire liée à l'âge (DMLA) et de l'œdème maculaire dans la rétinopathie diabétique 7. Voie intravitréenne offre une exposition à des vecteurs viraux vitré et la rétine interne, mais la diffusion des vecteurs de rétine externe est limitée. D'autre part, la voie sous-rétinien fournit plus directement de vecteurs viraux à l'espace potentiel entre la rétine et RPE, induisant une bulle localisée. Par conséquent, l'injection sous-rétinien est actuellement considéré comme une voie plus efficace pour cibler des cellules photoréceptrices et RPE. En termes d'approche chirurgicale, pars plana est choisie comme une zone de sécurité pour injection intravitréenne pour éviter d'endommager la rétine chez des patients humains. En modifiant simplement cette approche à des souris, nous pourrions injecter vecteurs viraux sous-rétinienne ou intravireally via approche limbique.
Dans cette vidéoarticle, nous démontrons une méthode facile et pratique de l'injection sous-rétinien de vecteurs viraux dans des souris RPE. Après la ponction unique au postérieure à limbe avec une aiguille 30 G 1/2, un 33 G aiguille émoussée microlitre équipée seringue est insérée dans l'espace sous-rétinien via le site de ponction limbique. Les vecteurs viraux de 1,5 à 2 volume ul sont injectés à l'espace potentiel entre la rétine et RPE induire bulles sous-rétiniens. Cette procédure peut être réalisée sous visualisation directe utilisant microscope chirurgical. Pratique répétée garantira des résultats reproductibles, même sans la visualisation directe de la formation de vésicules. Cela aidera les chercheurs à réaliser des expériences précises et gagner du temps pour la livraison de gènes sous-rétinien chez la souris RPE.
Protocole
Toutes les expériences sur les animaux ont été effectuées en conformité avec l'Association pour la recherche en vision et ophtalmologie Déclaration pour l'utilisation d'animaux dans ophtalmique et Vision Research, et les directives et règlements énoncés par le Comité nationale de Séoul soin et l'utilisation des animaux et institutionnelle Université nationale de Séoul Comité de biosécurité de l'hôpital universitaire.
1. Préparation Kit d'injection et vecteurs viraux
- Préparer la seringue microlitre équipé d'une aiguille émoussée 33 G stérilisée en utilisant du gaz d'oxyde d'éthylène. Diluer les vecteurs viraux dans PBS pour le titre adéquat dans le micro tube (soit 1 x 10 6 TU / pi). Rincer la seringue à plusieurs reprises avec des vecteurs viraux pour éliminer tout espace vide dans la seringue.
2. Injection sous-rétinienne de vecteurs viraux
- Anesthésier les souris adultes (par exemple, 6 - 8 semaines) par une injection intraperitoneale du mélange de tiletamiet ne zolazepam (1: 1, 2,25 mg / kg de poids corporel) et de chlorhydrate de xylazine (0,7 mg / kg de poids corporel) ou un régime d'anesthésie adapté alternative.
- Dilater les élèves avec un collyre de phényléphrine 0,5% et tropicamide 0,5%.
- Préparer la seringue microlitre en chargeant avec 1,5 à 2 pi de vecteurs viraux.
- Ouvrir la paupière et l'oeil en saillie pour exposer l'équateur pour injection pratique et se concentrer sur la sous microscope opératoire. Maintenir la position de l'oeil en saillie jusqu'à terminer l'injection, ou le déplacement de l'aiguille peut se produire lors de l'injection. Pour tenir le globe oculaire fermement, placer les doigts à l'extérieur du rebord orbitaire.
- Appliquer une goutte de solution viscoélastique ophtalmique à la surface de la cornée.
- Placer une petite lamelle ronde sur le haut de la cornée afin de visualiser la rétine.
- Percer un petit trou à peu en arrière du limbe en utilisant une aiguille stérile 30 G 1/2 pour la poursuite de l'injection sous-rétinien. Faire le trou inférieur for l'œil droit, et supérieur pour l'oeil gauche pour la commodité.
NOTE: Si le trou est fait au temporelle ou nasale, il est difficile d'être couvert par la paupière après l'injection. Ponction initiale devrait être rendue légèrement derrière le limbe pour éviter les vaisseaux limbiques qui courent le long du limbe et peut être facilement reconnus. Soyez prudent pour éviter de heurter la lentille avec l'aiguille tout en rendant la ponction initiale. Ne pas insérer l'ensemble du biseau de l'aiguille pour éviter lentille crevaison. - Placez l'aiguille émoussée 33 G de microlitre seringue à travers le trou pré-percé et l'approche de l'aiguille dans l'espace sous-rétinien jusqu'au moment où une légère résistance se fait sentir.
NOTE: Pour l'injection sous-rétinien, le meilleur angle d'approche de l'aiguille est d'environ 45 degrés contre iris avion, et l'aiguille émoussée doit être poussé en arrière vers la zone péripapillaire. Carré en pointillés indique la voie de l'aiguille suggéré dans la cavité vitréenne pour la sous-rétinien injection sur la figure 1.
NOTE: Il n'y aura pas de résistance ressentie lorsque perçage (ou passage) les couches de la rétine car ils sont très doux. Ainsi, le premier sentiment de légère résistance indique que l'aiguille a déjà touché la couche RPE et l'insertion de l'aiguille doit être arrêté. Attention à ne pas pénétrer dans le tissu scléral avec une pression excessive parce que l'aiguille doit être placé dans l'espace sous-rétinien potentiel. Si l'aiguille perce le tissu scléral par la puissance excessive, il entre dans les espaces extra-orbitales sans résistance. (Cette étape est essentielle)
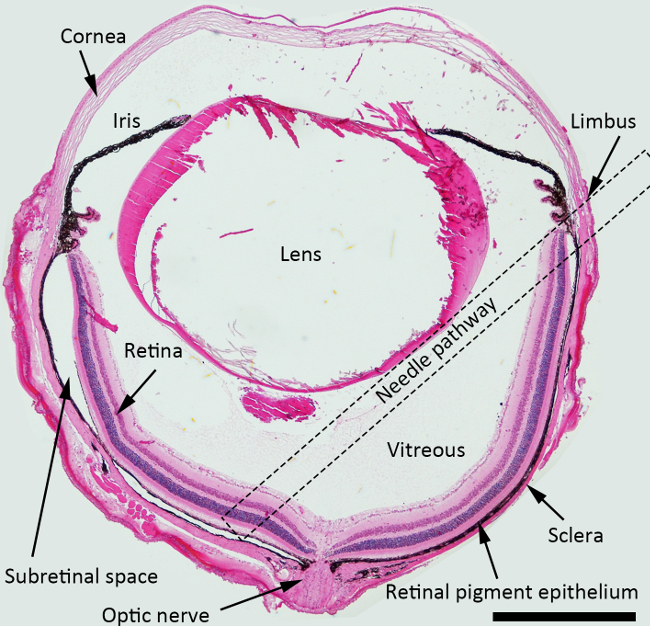
Figure 1. Schéma de l'injection sous-rétinienne. H & E de section teinté de l'œil de la souris représentant les structures avec une voie d'aiguilles pour l'injection sous-rétinienne marquée (un carré pointillé). Grossissement: 40X, Barre d'échelle: 500 um. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
- Injecter les vecteurs viraux (par exemple, 1 x 10 6 TU / pi) doucement dans l'espace sous-rétinien, sans tremblements d'éviter des dommages aux tissus non désirées et retirer délicatement l'aiguille. Tenez fermement le globe oculaire pendant l'injection comme décrit dans 2.4.
- Observer la formation de bulle sous-rétinien après l'injection sous microscope opératoire pour vous assurer qu'il n'y a pas de saignement de la rétine.
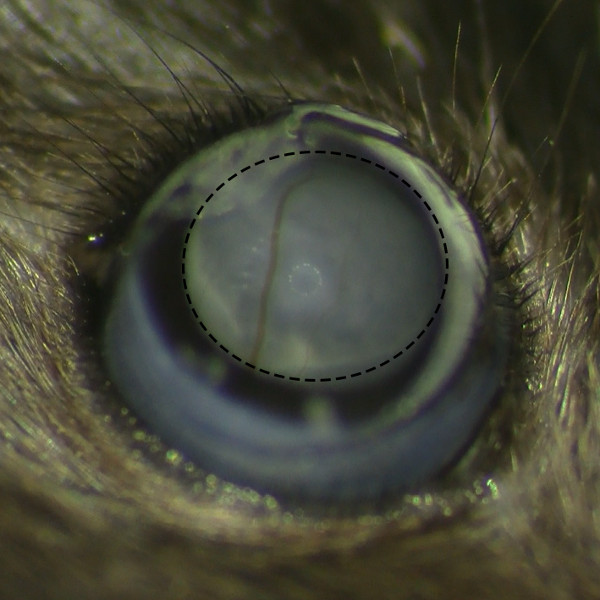
Figure 2. Formation sous-rétinienne Belb sans hémorragie rétinienne. Vue microscopique de belb sous-rétinien après l'injection sous-rétinien sous microscope opératoire montre succès la formation de bulle sans hémorragie rétinienne.m / files / ftp_upload / 53030 / 53030fig2large.jpg "target =" _ blank "> S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
- Fermez doucement la paupière pour recouvrir le site d'injection pour l'auto-étanchéité. Retourner les souris à la maison cage et garder en vie jusqu'à ce que l'évaluation.
NOTE: Après les chercheurs obtiennent utilisés pour les procédures, ils peuvent obtenir des résultats reproductibles avec des procédures rapides en sautant les étapes (2,5, 6 et 10)
3. Evaluation de l'efficacité de Gene Livraison en épithélium pigmentaire rétinien
- Sacrifiez la souris dans la chambre de CO 2. Énucléer les yeux avec des ciseaux.
- Fixer les yeux dans la solution de paraformaldehyde à 4% à 4 ° C pendant au moins une heure à quelques jours.
- Prenez la cornée avec des pinces fines et à la perforation de la cornée avec des micro-ciseaux. Retirer la cornée après ciseaux le long du limbe. Retirez la lentille avec une pince.
- Coupez le corps ciliaire avec mICRO-ciseaux permettant décollement de la rétine. Tirez doucement sur l'ensemble de la rétine / choroïde / sclérotique complexe de l'EPR. Couper le complexe RPE / choroïde / scléral radialement de la périphérie vers le centre, près du nerf optique à plusieurs reprises de faire 4 à 8 feuilles pour montage à plat.
- Retournez le RPE / choroïde / complexe scléral pour faire face RPE vers le bas, et couper tous les tissus restants sur le côté scléral y compris les muscles, de la conjonctive et du nerf optique. Cette étape est importante pour faire un / choroïde / scléral complexe de l'EPR à plat parce que tout tissu restant inégale rend le complexe.
- Incuber le complexe avec l'anticorps primaire et secondaire pour vos fins de recherche spécifiques (en option, voir les références pour les méthodes détaillées). Flat-monter les RPE / choroïde / sclérotique complexes sur la lame de verre et d'absorber l'PBS avec une éponge absorbant.
- Ajouter 30 pi de solution de montage et placer la lame de couverture. Observer l'échantillon pour l'efficacité de la prestation de vecteur au microscope fluorescéine. Gardez les échantillons dansle réfrigérateur pour observation.
Résultats
Pour évaluer l'efficacité de l'injection sous-rétinienne sur la transduction du gène viral par ce protocole, nous avons utilisé des vecteurs disponibles dans le commerce BT avec le promoteur du CMV exprimant à la fois la GFP et DP pour l'indicateur. Les yeux ont été énucléés, après la période de temps appropriée selon le but de la recherche. Pour les résultats représentatifs, les yeux ont été énucléés 10 semaines et 20 semaines après l'injection sous-rétinien. Après l'élimina...
Discussion
Dans cet article, vidéo, nous avons décrit la technique d'injection sous-rétinien limbique-approche en détail avec des résultats représentatifs de RPE / choroïde / scléral plate-mount. Ceci est une technique facile et pratique pour l'injection sous-rétinien de vecteurs viraux en RPE. La visualisation directe de la formation de bulle pendant l'injection est une étape importante pour la livraison précis pour les débutants. Il existe des techniques d'injection sous-rétiniens introduites dans le...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Cette étude a été soutenue par le Grant Université nationale de Séoul de recherche (800-20140542), le Programme de Pioneer Research de la NRF / MEST (2012-0009544), et le Programme Bio-Signal Analysis Technology Innovation de la NRF / MEST (2009-0090895), et la subvention de la NRF / MEST (2015M3A9E6028949).
matériels
| Name | Company | Catalog Number | Comments |
| TWEEZERS DUMONT #5 11cm DUMOSTAR 0.1 x 0.06 mm TIPS | WPI | 500233 | |
| VANNAS Scissors S/S, 105mm | WPI | 555583S | |
| 33G Blunt needle | WPI | NF33BL-2 | |
| NanoFil Syringe, 10 microliter | WPI | NANOFIL | |
| RPE-KIT | WPI | RPE-KIT | For easy one hand injection |
| 30Gx1/2 (0.3mmx 13mm) BD PrecisionGlideTM Needle | BD | 305107 | Initial puncture for subretinal injection |
| Microscope Cover Glasses (No. 1 3 mm diameter) | Warner Instruments | 64-0720 (CS-3R) | |
| Leica operating microscope | Leica | LM M80 | |
| Fluoresecein microscope | Nikon | Eclipse 80i | |
| Lentivirus | Thermo scientific | TMO.LV-Ctr | Used to dilute vectors |
| PBS | Gibco | 10010-015 | Used to dilute vectors |
| Troperin (Phenylephrin 0.5%-Tropicamide 0.5%) | Hanmi | For dilation | |
| Proparacaine Hydrochloride Ophthalmic Solution USP, 0.5% (Sterile) | Bausch&Lomb | For topical anesthesia | |
| Healon GV OVD | Abbott Medical Optics Inc. | ||
| Zoletil 50 (tiletamine hypochloride and zolazepam hypochloride) | Virbac | For general anesthesia | |
| Rompun® injection (Xylazine HCl) | Bayer | For general anesthesia |
Références
- Maguire, A. M., et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med. 358 (21), 2240-2248 (2008).
- Jacobson, S. G., et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol. 130 (1), 9-24 (2012).
- Conlon, T. J., et al. Preclinical potency and safety studies of an AAV2-mediated gene therapy vector for the treatment of MERTK associated retinitis pigmentosa. Hum Gene Ther Clin Dev. 24 (1), 23-28 (2013).
- MacLaren, R. E., et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet. 383 (9923), 1129-1137 (2014).
- Trapani, I., Puppo, A., Auricchio, A. Vector platforms for gene therapy of inherited retinopathies. Prog Retin Eye Res. 43, 108-128 (2014).
- Liang, F. Q., Anand, V., Maguire, A. M., Bennett, J. Intraocular delivery of recombinant virus. Methods Mol Med. 47, 125-139 (2001).
- Peyman, G. A., Lad, E. M., Moshfeghi, D. M. Intravitreal injection of therapeutic agents. Retina. 29 (7), 875-912 (2009).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. (79), (2013).
- Wert, K. J., Skeie, J. M., Davis, R. J., Tsang, S. H., Mahajan, V. B. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. (69), (2012).
- Eberle, D., Santos-Ferreira, T., Grahl, S., Ader, M. Subretinal transplantation of MACS purified photoreceptor precursor cells into the adult mouse retina. J Vis Exp. (84), e50932 (2014).
- Sahel, J. A., Roska, B. Gene therapy for blindness. Annu Rev Neurosci. 36, 467-488 (2013).
- Allocca, M., et al. Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol. 81 (20), 11372-11380 (2007).
- Takahashi, K., et al. Sustained transduction of ocular cells with a bovine immunodeficiency viral vector. Hum Gene Ther. 13 (11), 1305-1316 (2002).
- Rolling, F., et al. Gene therapeutic prospects in early onset of severe retinal dystrophy: restoration of vision in RPE65 Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Bull Mem Acad R Med Belg. 161 (10-12), 497-508 (2006).
- Le Meur, G., et al. Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium. Gene Ther. 14 (4), 292-303 (2007).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Puche, N., et al. Genetic and environmental factors associated with reticular pseudodrusen in age-related macular degeneration. Retina. 33 (5), 998-1004 (2013).
- Campochiaro, P. A. Gene transfer for neovascular age-related macular degeneration. Hum Gene Ther. 22 (5), 523-529 (2011).
- Park, S. W., et al. Intracellular amyloid beta alters the tight junction of retinal pigment epithelium in 5XFAD mice. Neurobiol Aging. 35 (9), 2013-2020 (2014).
- Shin, B., et al. Intracellular cleavage of amyloid beta by a viral protease NIa prevents amyloid beta-mediated cytotoxicity. PLoS One. 9 (6), e98650 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon