A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقرير زيتا المحتملة عبر جسيمات متناهية الصغر إزفاء السرعات من خلال الانضباطي ثقب النانو: استخدام الجسيمات المعدلة الحمض النووي كمثال
In This Article
Summary
نحن هنا استخدام ثقب النانو البولي الانضباطي دمجها في تقنية الاستشعار عن نبض مقاوم للتميز الكيمياء السطحية النانوية عن طريق قياس سرعات الجسيمات النبات، والتي يمكن استخدامها لتحديد إمكانات زيتا من الجسيمات النانوية الفردية.
Abstract
تقنيات ثقب النانو، والمعروفة ب مجسات نبض مقاوم (RPS)، وتستخدم لكشف وتحديد وتوصيف البروتينات والجزيئات والجسيمات النانوية. الاستشعار عن الانضباطي مقاوم النبض (TRPS) هو التكيف حديث نسبيا إلى RPS أن يشتمل على المسام الانضباطي التي يمكن تغييرها في الوقت الحقيقي. هنا، ونحن نستخدم TRPS لمراقبة مرات النبات النانوية المعدلة الحمض النووي لأنها تعبر الغشاء مسام الانضباطي بوصفها وظيفة من تركيز الحمض النووي والهيكل (أي، واحد الذين تقطعت بهم السبل على الحمض النووي المزدوج تقطعت بهم السبل).
ويستند TRPS على قطبين حج / أجكل، مفصولة غشاء المسام من اللدائن المرنة التي تؤسس تيار الأيونية مستقر على حقل كهربائي التطبيقية. وخلافا لمختلف التكنولوجيات الجسيمات توصيف مقرها البصرية، ويمكن TRPS تميز الجزيئات الفردية بين عينة من السكان، مما يسمح للعينات متعددة الوسائط ليتم تحليلها بكل سهولة. هنا، علينا أن نظهر القياسات المحتملة زيتاعبر سرعات الجسيمات النبات من المعايير المعروفة وتطبيق هذه لعينة مرات النبات تحليلها، مما أدى إلى قياس زيتا المحتملة من تلك التحاليل.
وكذلك اكتساب القيم المحتملة زيتا متوسط، يتم قياس جميع العينات باستخدام منظور الجسيمات التي الجسيمات واظهار مزيد من المعلومات على عينة معينة من خلال توزيعات السكان عينة، على سبيل المثال. هذا، يوضح هذه الطريقة إمكانية ضمن تطبيقات الاستشعار عن كل من المجالات الطبية والبيئية.
Introduction
النانوية Functionalized تزداد شعبية كما أجهزة الاستشعار في كل المجالات الطبية والبيئية. القدرة على تغيير كيمياء سطح جسيمات متناهية الصغر، ومع الحمض النووي، على سبيل المثال، تثبت مفيدة لأنظمة توصيل الدواء المستهدف 1، ورصد تفاعلات الحمض النووي والبروتينات 2-4. خاصية جسيمات متناهية الصغر شائعة بشكل متزايد يجري استخدامها في اختبارات بيولوجية وفي تقديم العلاجات غير superparamagnetism 5. الجسيمات مغنطيسية مسايرة فائقة superparamagnetic (SPPS) مفيدة للغاية في تحديد وإزالة التحاليل محددة من مخاليط معقدة ويمكن أن تفعل ذلك مع الاستخدام البسيط للمغناطيس واحد. إزالة مرة واحدة، والجسيمات ملزمة تحليلها يمكن وصفها وتحليلها يصلح للغرض.
وتشمل الطرق السابقة المستخدمة للكشف وتوصيف الجسيمات النانوية التقنيات البصرية مثل تشتت الضوء الحيوي (DLS)، والمعروف باسم التحليل الطيفي الفوتون الارتباط. على الرغم من أن مرحباغ التقنية الإنتاجية، DLS يقتصر على كونه الطريقة القائمة على المتوسط وعند تحليل عينات متعددة الوسائط بدون إضافة برنامج متخصص، فإن الجزيئات الكبيرة تنتج إشارة أكثر هيمنة من ذلك بكثير، وترك بعض من جسيمات أصغر دون أن يلاحظها أحد تماما 6،7. الجسيمات التي الجسيمات تقنيات توصيف وبالتالي أكثر ملاءمة لتحليل جسيمات متناهية الصغر وأنظمة جسيمات متناهية الصغر functionalized.
وتعتمد التكنولوجيات القائمة RPS حول تطبيق حقل كهربائي على عينة ومراقبة آلية نقل الجزيئات من خلال ثقب النانو الاصطناعية أو البيولوجي. وكشف جسيمات متناهية الصغر وتوصيف تقنية حديثة نسبيا استنادا RPS هو مقاوم الانضباطي نبض الاستشعار (TRPS) 8-16. TRPS هو نظام ثنائي القطب مفصولة، غشاء المسام الانضباطي من اللدائن المرنة. يسمح طريقة الانضباطي المسام للالتحاليل مجموعة من شكل 17 و حجم المراد قياسها عن طريق العابرة لهاآليات الميناء من خلال المسام. وقد سبق أن استخدمت المسام الانضباطي للكشف عن الجسيمات الصغيرة (70-95 قطرها نانومتر) تحقيق نتائج مماثلة لغيرها من التقنيات مثل التحليل الطيفي انتقال الإلكترون (تيم) 10. عندما يتم تطبيق حقل كهربائي، لوحظ حدوث تيار الأيونية وبمرور الجزيئات / الجزيئات من خلال المسام، ومنع مؤقتا المسام، مما تسبب في انخفاض الحالية التي يمكن تعريفها بأنها "حدث الحصار". كل حدث الحصار هو ممثل جسيم واحد بحيث أن كل الجسيمات في عينة يمكن وصفها على أساس فردي على حجم الحصار، Δ 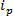 ، والعرض الكامل نصف كحد أقصى، FWHM، فضلا عن غيرها من الخصائص الحصار. تحليل الجزيئات الفردية لأنها تمر من خلال ثقب النانو هو مفيد للعينات متعددة الوسائط كما TRPS يمكن بنجاح وفعالية يميز مجموعة من الجسيمات أحجام آمونGST عينة واحدة. الانضباطي الاستشعار نبض مقاوم يكمل حجم 10، زيتا المحتملة 12،18 وتركيز 15 القياسات في وقت واحد في شوط واحد، وبالتالي لا تزال تفرق عينات من ما شابه ذلك، إن لم يكن بنفس الحجم من قبل المسؤول سطحها 19. ميزة على تقنيات التحجيم بديلة.
، والعرض الكامل نصف كحد أقصى، FWHM، فضلا عن غيرها من الخصائص الحصار. تحليل الجزيئات الفردية لأنها تمر من خلال ثقب النانو هو مفيد للعينات متعددة الوسائط كما TRPS يمكن بنجاح وفعالية يميز مجموعة من الجسيمات أحجام آمونGST عينة واحدة. الانضباطي الاستشعار نبض مقاوم يكمل حجم 10، زيتا المحتملة 12،18 وتركيز 15 القياسات في وقت واحد في شوط واحد، وبالتالي لا تزال تفرق عينات من ما شابه ذلك، إن لم يكن بنفس الحجم من قبل المسؤول سطحها 19. ميزة على تقنيات التحجيم بديلة.
ويعرف إمكانات زيتا كما إمكانات الكهربائي في الطائرة من القص 20، وتحتسب من سرعات الجسيمات لأنها تعبر مسام (19). قياسات المحتملة زيتا من الجزيئات الفردية مما يعطي نظرة ثاقبة على آليات النبات وسلوك النظم جسيمات متناهية الصغر في حل، معلومات قيمة لمستقبل تصاميم جسيمات متناهية الصغر فحص لمجموعة من التطبيقات. الجسيمات التي الجسيمات تحليل من هذا النوع يسمح أيضا لانتشار وتوزيع القيم المحتملة زيتا بين عينة من السكان من يكتشفها، والسماح لمزيد من المعلومات سحركية التفاعل ن (واحد الذين تقطعت بهم السبل على الحمض النووي المزدوج تقطعت بهم السبل، على سبيل المثال) وبثبات الجسيمات في الحل التي ينبغي تحقيقها.
هنا، نحن تصف تقنية يكتشف ويميز كل السطوح SPP معدلة وتعديل الحمض النووي. بروتوكول الموصوفة هنا ينطبق على مجموعة من الجسيمات النانوية غير العضوية والبيولوجية، ولكن علينا أن نظهر الإجراء باستخدام أسطح تعديل الحمض النووي نظرا لمداها واسعة من التطبيقات. تقنية تسمح للمستخدم للتمييز بين الأهداف الحمض النووي المفرد الذين تقطعت بهم السبل وتقطعت بهم السبل مزدوجة على سطح جسيمات متناهية الصغر، استنادا إلى سرعات الجسيمات النبات من خلال نظام المسام وبالتالي إمكاناتها زيتا.
Protocol
1. جعل الفوسفات مخزنة المالحة مع توين-20 (PBST) العازلة
- حل واحد PBS قرص (0.01 عازلة M الفوسفات، 0.0027 M كلوريد البوتاسيوم، 0.137 M كلوريد الصوديوم، ودرجة الحموضة 7.4) في 200 مل من الماء منزوع الأيونات (18.2 MΩ سم).
- إضافة 100 ميكرولتر (0.05 (ت / ت)٪) توين-20 إلى الحل 200 مل العازلة كما السطحي.
2. إعداد معايير الجسيمات كربوكسيل البوليستيرين
- دوامة الجسيمات معايرة لمدة 30 ثانية قبل صوتنة لمدة 2 دقيقة في 80 واط لخلق monodispersity من الجسيمات.
- تمييع الجسيمات معايرة 1 في 100 إلى تركيز 1X10 10 الجسيمات / مل في المخزن PBST ودوامة لمدة 30 ثانية.
3. إعداد الجسيمات Streptavidin المغلفة
- دوامة جسيمات لمدة 30 ثانية قبل صوتنة لمدة 2 دقيقة في 80 واط لضمان monodispersity.
- تمييع الجسيمات streptavidin المغلفة 1 في 100 العازلة في PBST إلى تيار مترددhieve تركيز الناتجة من 1X10 9 الجسيمات / مل ودوامة لمدة 30 ثانية.
ملاحظة: حجم عينة نموذجية 200 ميكرولتر. على سبيل المثال، إذا تحقق إعداد خمسة تركيز الحمض النووي 1 مل من الجسيمات streptavidin المغلفة المخفف.
4. إعداد أليغنوكليوتيد]
- إعادة أليغنوكليوتيد مع الماء منزوع الأيونات إلى تركيز الناتج من 100 ميكرومتر.
5. إضافة لقطة التحقيق (CP) الحمض النووي للجسيمات Streptavidin المغلفة
- قبل الحمض النووي ملزمة، دوامة streptavidin المغلفة الجسيمات (200 حجم العينة ميكرولتر) لمدة 30 ثانية تليها صوتنة 2 دقيقة في 80 واط.
- واستنادا إلى قدرة الملزمة التي يقدمها المورد (4352 بمول / ملغ)، إضافة التركيز المناسب من الحمض النووي للجسيمات لتركيزات الناتجة من 10، 20، 30، 40، 47، 95، 140، و 210 نانومتر الحمض النووي.
- دوامة العينات لمدة 10 ثانية ومكان على عجلة دوارة في درجة حرارة الغرفةلمدة 30 دقيقة للسماح الحمض النووي لربط أسطح الجسيمات عن طريق التفاعل streptavidin البيوتين.
- مرة واحدة تم إضافة الحمض النووي التقاط وحضنت مع جزيئات streptavidin المغلفة، وإزالة الحمض النووي الزائد في حل عن طريق الفصل المغناطيسي عن طريق وضع العينات على الرف المغناطيسي لمدة 30 دقيقة.
- إزالة طاف، مع الحرص على عدم تعكير صفو الكتلة التي تكونت حديثا من الجسيمات الأقرب إلى المغناطيس، واستبدالها مع نفس الحجم من العازلة PBST الجديد.
6. التهجين الحمض النووي التكميلي للجسيمات CP
- إضافة المبلغ المطلوب من الحمض النووي الهدف (ما يزيد على 500 نانومتر) لضمان أقصى قدر من الأهداف الممكنة تم التوصل ملزمة.
- دوامة العينات لمدة 10 ثانية ومكان على عجلة دوارة في درجة حرارة الغرفة لمدة 30 دقيقة.
- وبمجرد أن التهجين كاملة، إزالة الحمض النووي الهدف الزائد عن طريق الفصل المغناطيسي عن طريق وضع العينات على الرف المغناطيسي لمدة 30 دقيقة.
- إزالة طاف، مع الحرص على عدم تعكير صفو الكتلة التي تكونت حديثا من الجسيمات الأقرب إلى المغناطيس، واستبدالها مع نفس الحجم من العازلة PBST الجديد.
- كرر الخطوات من 6،1-6،4 لعينات المكررة ووضع هذه العينات على عجلة دوارة في درجة حرارة الغرفة لمدة 16 ساعة للتحقيق في الأوقات تهجين الحمض النووي.
إعداد 7. TRPS
- سد العجز في الصك في نظام الكمبيوتر مع البرمجيات في المكان.
- معايرة تمتد الأولي باستخدام الفرجار.
- قياس المسافة بين السطح الخارجي للاثنين فكي موازية.
- مساهمة في البرنامج عن طريق كتابة تمتد في الحقل "تمتد" في علامة التبويب "إعدادات صك" والنقر على "معايرة تمتد" تحت علامة التبويب.
- تناسب أفقيا غشاء من مادة البولي يوريثين ثقب النانو من التحجيم المناسب للتحليل على الفكين مع رقم ثقب النانو تواجه التصاعدي. ثم، وتمتد بين فكي على امتداد المطلوبة للتحليل باستخداممقبض تعديل تمتد على الجانب الصك. تمتد بين فكي بين 43 و 48 ملم.
ملاحظة: يتم تحديد القيمة الدقيقة للامتداد إلى جانب الجهد التطبيقي بحيث الحصار معايرة الجسيمات ما لا يقل عن 0.3 غ في الحجم. وإدخالها تمتد بالفعل في البرنامج في الخطوة 7.2 وسوف تعدل تلقائيا كما امتدت بين فكي. - ضع 80 ميكرولتر من العازلة PBST في الخلية أقل السوائل، تحت ثقب النانو، وضمان عدم وجود فقاعات الحالية التي قد تؤثر على القياس. إذا كان هناك فقاعات ينظر، وإزالة واستبدال العازلة.
- انقر فوق الخلية السوائل العليا في مكانه ووضع 40 ميكرولتر من العازلة في ذلك، ضمان مرة أخرى عدم وجود فقاعات الحاضر. إذا فقاعات موجودة في الخلية السوائل العليا، إزالتها عن طريق استبدال السائل.
- عندما تم التوصل إلى خط الأساس الحالية استنساخه من استبدال الخلايا السوائل العليا مع العازلة، إضافة 40 ميكرولتر من عينة إلى الخلية السوائل العليا والتدبير النقر على 'شارعالفن "في" علامة التبويب الحصول على البيانات "على شاشة البرنامج.
ملاحظة: يتم الانتهاء من الحصول على البيانات على تردد 50 كيلوهرتز مع الحد الأدنى لحجم الحصار المفروض على 0.05 غ، على الرغم من أن هذا يمكن تغييرها باستخدام البرنامج عبر علامة التبويب "بيانات تحليل" (تحت "إعدادات تحليل" و "مقاوم الحصارات ') . - ضع قفص فاراداي على الجزء العلوي من نظام خلايا السائل للحد من الضوضاء الخلفية الكهربائي على القياسات.
- استخدام وحدات ضغط متغير (VPM) لتطبيق ضغط أو فراغ للعينات.
- لتطبيق الضغط الخارجي ربط فوهة إلى الخلية السوائل العليا، ثم تدوير الذراع الضغط والنقر في مكان (اعتمادا على ما إذا كان ضغط إيجابي (PRE) أو فراغ (VAC) سيتم تطبيق).
- الضغط في "سم" أو الحجم "مم" باستخدام مقبض مرحلة الضغط التي تقع على الجزء العلوي من VPM. اضغط على مقبض الباب وصولا الى ممارسة الضغط على مقياس "سم" وتسحبه إلى أعلى رس الضغط على مقياس "ملم".
8. عينات التحضير لتحليل TRPS
- عينات دوامة لمدة 30 ثانية، ويصوتن لمدة 2 دقيقة في 80 واط قبل التحليل TRPS.
9. معايرة ثقب النانو لتحليل زيتا
- بعد وضع 40 الجسيمات معايرة ميكرولتر (1X10 10 الجسيمات / مل) في الخلية السوائل العليا، واستكمال قياس TRPS (الإعداد كما في القسم 7) في 3 الفولتية المطبقة. تغيير الجهد عن طريق النقر على '+' و '-' أزرار على مقياس الجهد في علامة التبويب "إعدادات أداة" على البرنامج.
- تأكد من أن 3 الفولتية تعود التيارات خلفية ما يقرب من 140، 110، و 80 غ. ضمان على الجهد المتوسط الجسيمات معايرة تنتج متوسط حجم الحصار المفروض على 0.3 على الأقل غ.
- تطبيق الضغط حتى متوسط الكامل نصف عرض الحد الأقصى (FWHM) المدد من الجسيمات معايرة ما لا يقل عن0.15 ميللي ثانية. القيام بذلك يدويا باستخدام ذراع الضغط تعلق على وحدة ضغط متغير. حدد الضغط (PRE) أو فراغ (VAC) عن طريق تدوير الذراع حتى تستقر في الموضع المطلوب وتطبق وفقا لذلك ما يلي تعليمات الإعداد في خطوة 7.8.2. متى تحققت هذه الشروط، بدء التشغيل عن طريق النقر على 'بداية' على البرنامج في علامة التبويب "الحصول على البيانات.
- استكمال تشغيل عن طريق الضغط على "وقف" في علامة التبويب "الحصول على البيانات" عندما تم قياسها لا يقل عن 500 الجسيمات (انظر "عدد الجسيمات" في الجزء السفلي من الشاشة البرنامج خلال قياس) وعلى المدى قد تجاوزت 30 ثانية (انظر " وقت تشغيل 'أيضا باتجاه الجزء السفلي من الشاشة).
- معايرة نظام من خلال استكمال تشغيل المعايرة كما هو موضح في كل مرة يتم إدخال ثقب النانو الجديد أو كل يوم جديد من التحليل من قبل إكمال الخطوة 9،1-9،4.
10. تشغيل عينة
- تشغيل عينات على أعلى أوثاني أعلى الجهد كما العينات المعايرة في ضمان مماثل (± 10 غ)، إن لم يكن نفسه، التيار الأساسي.
- مرة واحدة ويتحقق الأساس التيار المناسب، استبدال بالكهرباء في الخلية السوائل العليا مع 40 ميكرولتر من العينة. عندما يتم إدخال العينة، وسوف ينظر الحصار على تتبع الإشارة. بدء عينة تشغيل عن طريق النقر على "ابدأ" في علامة التبويب "الحصول على البيانات" وتسجيل ما لا يقل عن 500 الجسيمات (راجع "عدد الجسيمات" تقع تحت التتبع إشارة) وضمان وقت التشغيل هو الحد الأدنى من 30 ثانية (انظر "تشغيل الوقت "تقع أيضا تحت أثر إشارة).
- لإتمام القياس، انقر فوق "إيقاف" في "علامة التبويب الحصول على البيانات" وحفظ ملف البيانات.
- لحفظ الملف، وإدخال معلومات الملف في الشكل التالي. "التحقيق" هو المجلد سيتم حفظ الملف في، "ثقب النانو معرف 'هو الرقم التسلسلي للمسام المستخدمة،' الجزء # 'طق نوع من المسام (أي NP150 / NP200)، 'معرف نموذج' هو اسم العينة، 'معايرة أو عينة "تفاصيل ما إذا كان هو معايرة أو عينة القياس،" التخفيف "يستخدم إذا تم تخفيفه العينة ( اكتب 100 اذا كان المخفف العينة 100 أضعاف)، 'الضغط' هو الضغوط التي مورست على عينة (في سم - انظر القسم 7.8)، 'معرف بالكهرباء' هو اسم العازلة تم عينة تصل في، و" تلاحظ "هي أي ملاحظات شخصية حول العينة أو التشغيل.
- بين كل تشغيل عينة، وغسل النظام من خلال وضع 40 ميكرولتر من PBST المخزن المؤقت في الخلية السوائل العليا عدة مرات وتطبيق الضغوط المختلفة (عادة في -10، -5 سم (فراغ)، و 5 و 10 سم (ضغط إيجابي)) حتى لا مزيد من الأحداث الحصار موجودة، ضمان عدم وجود جزيئات المتبقية المتبقية في النظام وبالتالي عدم وجود تلوث المتبادل بين العينات. عينات تشغيل في ثلاث نسخ مع هذه الخطوة غسل الانتهاء بين كل تكرار نموذج تشغيل وأهلا وسهلال كما بين عينات مختلفة.
النتائج
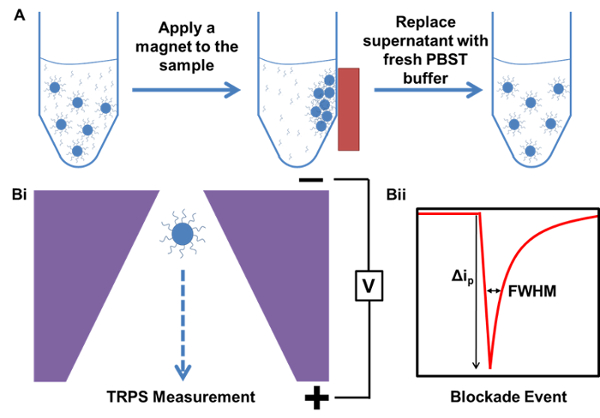
الشكل 1. تمثيل تخطيطي لعمليات تنقية المغناطيسي وقياس TRPS. أ) مثال لتنقية المغناطيسية للعينة بدءا من عينة تحتوي على فائض، غير منضم القبض على التحقيق الحمض النووي. ب) TRPS سبيل المثال قياس...
Discussion
حساب لإمكانات زيتا استخدام طريقة تستند معايرة المتعلقة بالعمل التي كتبها Arjmandi وآخرون. 21. مدة النبات من الجزيئات لأنها تعبر يقاس على ثقب النانو بوصفها وظيفة من الجهد التطبيقية، وذلك باستخدام متوسط الكهربائية السرعات الميدانية والجسيمات على كامل ال?...
Disclosures
ويدعم ELCJB التي كتبها Izon العلوم المحدودة
Acknowledgements
الكتاب أشكر Izon العلوم المحدودة لدعمهم. وأيد هذا العمل من قبل المفوضية الأوروبية للأبحاث (PCIG11-GA-2012-321836 Nano4Bio).
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 ml deionized water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1 x 1012 particles/ml, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2 x 1019 C/nm2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4,352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1 x 1011 particles/ml. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCACTAC GCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGA GGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 100 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved