Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Ayarlanabilir Nanopore aracılığıyla Nanopartikül Translokasyon Hızları aracılığıyla Zeta Potansiyeli Belirlenmesi: Bir Örnek olarak DNA modifiye Parçacıklar kullanma
Bu Makalede
Özet
Burada tek tek nanopartiküllerin zeta potansiyelini belirlemek için kullanılabilir partikül translokasyon hızlarının ölçümü ile nanopartiküller yüzey kimyası karakterize etmek için bir dirençli darbe algılama tekniği entegre bir poliüretan ayarlanabilir Nanopore kullanımı.
Özet
Dirençli Darbe Sensörleri (RPS) olarak topluca bilinen nanopore teknolojileri, tespit ölçmek ve proteinler, moleküller ve nanopartiküller karakterize etmek için kullanılmaktadır. Ayarlanabilir direnç darbe algılama (TRPS) gerçek zamanlı olarak değişmiş olabilir ayarlanabilir bir gözenek içeren RPS için nispeten yeni bir uyarlamasıdır. Bunlar DNA konsantrasyonu ve yapısının bir fonksiyonu olarak ayarlanabilir bir gözenek membran çapraz olarak burada, DNA-modifiye edilmiş nanopartiküller translokasyon kez izlemek için TRPS kullanımı (örneğin, tek sarmallı iki-şeritli DNA'ya).
TRPS uygulanan bir elektrik alanı üzerine bir sabit iyon akımı oluşturan elastomerik bir gözenekli membran ile ayrılmış, iki Ag / AgCI elektrot dayanır. Çeşitli optik tabanlı parçacık karakterizasyonu teknolojilerinin aksine, TRPS modelli örnekleri kolaylıkla analiz edilmesi için izin, bir örnek nüfusu arasında bireysel parçacıklar karakterize edilebilir. Burada, zeta potansiyel ölçümleri göstermektedirBilinen standartların parçacık translokasyon hızlar aracılığı ile ve böylece bu analitlerin zeta potansiyelini ölçmek sonuçlanan analit translokasyon kez örneklemek için bu geçerlidir.
Yanı sıra ortalama zeta potansiyeli değerleri elde olarak, numune, tüm Örneğin, örnek nüfustan vasıtası ile verilen bir örnek üzerinde daha ayrıntılı bilgi gösteren bir parçacık tarafından tanecikli perspektif kullanılarak ölçülür. Böyle ki, bu yöntem hem tıbbi ve çevresel alanlar için algılama uygulamaları içinde potansiyelini göstermektedir.
Giriş
Fonksiyonlu nanopartiküller, tıbbi ve çevresel alanlarda hem biyosensörler olarak giderek daha popüler hale gelmektedir. Kabiliyeti, örneğin, hedeflenen ilaç verme sistemleri 1 ve izleme, DNA-protein etkileşimleri 2-4 için yararlı olduğunu kanıtlamaktadır, DNA ile, bir nanopartikül yüzey kimyasını değiştirmek için. Giderek yaygınlaşan bir nanoparçacık mülkiyet biyo-deneylerde kullanılan ve terapötik teslim süperparamanyetizma 5'tir ediliyor. Süpermanyetik parçacıklar (SPSS) belirlenmesi ve karmaşık karışımlarından özel analitleri çıkarılmasında son derece yararlıdır ve tek bir mıknatıs basit kullanımı ile bunu yapabilirsiniz. Bir kez çıkarıldı analit-bağlanmış parçacıklar, özelliği ve amaca uygun olarak analiz edilebilir.
Nanopartiküllerin saptanması ve tanımlanması için kullanılan önceki metotlarda, aksi foton korelasyon spektroskopisi olarak bilinen bu dinamik ışık saçılımı (DLS) gibi optik teknikler bulunmaktadır. Bir hi rağmengh throughput tekniği, DLS bir ortalama bazlı teknik olmak ve uzman bir yazılım ilavesi olmadan multimodal numunelerin analiz ederken sınırlıdır, büyük partiküller 6,7 tamamen fark edilmeden küçük parçacıkların bazı bırakarak, çok daha baskın bir sinyal üretecek. Parçacık-by-parçacık karakterizasyon teknikleri bu nedenle çok daha olumlu nanoparçacık ve fonksiyonlaşmış nanoparçacık sistemlerini analiz etmek vardır.
RPS tabanlı teknolojiler bir numuneye bir elektrik alanı uygulanması ve bir sentetik veya biyolojik nano-gözeneklere içinde parçacık taşıma mekanizması takip etrafında dayanmaktadır. RPS dayalı nispeten yeni nanoparçacık algılama ve karakterizasyonu tekniği ayarlanabilir direnç darbe algılama (TRPS) 8-16 olduğunu. TRPS bir elastomerik, ayarlanabilir bir gözenek membran ile ayrılmış, iki elektrod sistemidir. Ayarlanabilir bir gözenek yöntem, trans-ölçülebilir şekil 17 ve boyutu, bir dizi analitlerin sağlargözenek yoluyla liman mekanizmaları. Ayarlanabilir gözenekler, daha önce bu transmisyon elektron spektroskopisi (TEM), 10 gibi başka teknikler ile karşılaştırılabilir sonuçlar elde küçük parçacıkların saptanması (70-95 nm çapında) kullanılmıştır. bir elektrik alanı uygulandığında, iyonik akımı görülmektedir ve parçacıklar / molekülü gözenek geçerken, geçici olarak bir "blokaj etkinliği" olarak tanımlanabilir mevcut bir azalmaya neden gözenek bloke eder. Bir örnek içindeki her parçacık, özelliği tek tek blok büyüklüğü, ö göre böylece, her blokaj etkinliği tek bir parçacık temsili 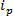 Ve tam genişliği yarım maksimum FWHM, hem de diğer blokaj özellikleri. bir nanopore geçerken tek tek parçacıkların analiz parçacık amon boyutları ve TRPS başarılı ve etkili bir dizi ayırt gibi multimodal numuneler için avantajlıdırTek bir örnek GST. Ayarlanabilir direnç darbe algılama boyutu 10, tek bir vadede aynı anda zeta potansiyeli 12,18 ve konsantrasyon 15 ölçümleri tamamlar ve hala benzer örnekleri ayırt nedenle eğer kendi yüzey yükü 19 tarafından değil aynı boyutta; Alternatif boyutlandırma teknikleri üzerinde bir avantaj.
Ve tam genişliği yarım maksimum FWHM, hem de diğer blokaj özellikleri. bir nanopore geçerken tek tek parçacıkların analiz parçacık amon boyutları ve TRPS başarılı ve etkili bir dizi ayırt gibi multimodal numuneler için avantajlıdırTek bir örnek GST. Ayarlanabilir direnç darbe algılama boyutu 10, tek bir vadede aynı anda zeta potansiyeli 12,18 ve konsantrasyon 15 ölçümleri tamamlar ve hala benzer örnekleri ayırt nedenle eğer kendi yüzey yükü 19 tarafından değil aynı boyutta; Alternatif boyutlandırma teknikleri üzerinde bir avantaj.
Zeta potansiyeli kesme 20 düzleminde elektrostatik potansiyel olarak tanımlanır ve bir gözenek 19 çapraz olarak parçacık hızları hesaplanır. Bireysel partiküllerin zeta potansiyel ölçümleri böylece translokasyon mekanizmaları ve çözelti içinde nanoparçacık sistemleri, uygulamaları bir dizi için nanoparçacık tahlil tasarımları geleceği için değerli bilgilerin davranış içine bir fikir verir. Bu tür doğa parçacık-by-parçacık analizi de o daha fazla bilgi için izin veren bir örnek halk arasında yayıldı ve zeta potansiyeli değerlerinin dağılımı keşfedilmeyi sağlarçözelti içinde n tepkime kinetik (örneğin, iki-şeritli DNA, tek bükümlü) ve partikül stabiliteleri elde edilmesi.
Burada, algılar ve değiştirilmemiş ve DNA modifiye SPP yüzeyleri hem karakterize bir tekniği açıklar. Burada tarif edilen protokol, inorganik ve biyolojik nanopartiküllerin bir dizi için geçerli olmakla birlikte, bağlı uygulama bunların geniş bir DNA modifiye edilmiş yüzeyler kullanılarak prosedürü göstermektedir. tekniği Kullanıcı böylece partikül translokasyon bir gözenek sistemi ile hızları ve zeta potansiyeli göre bir nanopartikül yüzey üzerinde tek sarmallı ve çift sarmallı DNA hedefleri ayırt sağlar.
Protokol
1. Tween-20 (PBST) Tamponu ile fosfat tamponlu tuzlu su yapma
- 200 ml deiyonize su (18.2 cm) bir PBS tablet (0.01 M fosfat tamponu, 0.0027 M potasyum klorür, 0.137 M sodyum klorür, pH 7.4) içinde çözülür.
- bir yüzey aktif madde olarak 200 ml tampon çözeltiye 100 ul (0.05 (hac / hac)%) Tween-20 ekleyin.
2. Karboksil Polistiren Parçacık Standartları Hazırlama
- parçacıkların bir tekli dağılırlık oluşturmak için 80 watt olarak 2 dakika boyunca sonike edilmeden önce 30 saniye için kalibrasyon parçacıkları vorteksleyin.
- 30 sn için PBST tamponu ve vorteks 1x10 10 parçacık / ml 'lik bir konsantrasyona kadar kalibrasyon parçacıkları 100'de 1 seyreltin.
3. Hazırlanması streptavidin kaplı partiküller
- bir tekli dağılırlık sağlamak için 80 watt olarak 2 dakika boyunca sonike edilmeden önce 30 saniye boyunca parçacıkları vorteksleyin.
- AC PBST tamponu içinde 100 streptavidin kaplı partiküller 1 seyreltin30 saniye boyunca bir elde 1x10 9 parçacık / ml konsantrasyon ve girdap hieve.
Not: Tipik bir örnek hacmi 200 ul. Örneğin, soruşturma varsa beş DNA konsantrasyonları seyreltilmiş streptavidin kaplı partiküllerin 1 ml hazırlamak.
Oligonükleotid 4. hazırlanması
- 100 uM'lik bir elde edilen konsantrasyona kadar deiyonize su ile oligonükleotitleri sulandırın.
Streptavidin kaplı partiküller Yakalama Prob (SP) DNA 5'tir
- DNA bağlama önce, girdap 80 watt bir 2 dakika sonikasyon ile, ardından 30 saniye boyunca streptavidin ile kaplı parçacıklar (200 ul numune hacmi).
- satıcılar (4.352 pmol / mg) tarafından sağlanan bir bağlanma kapasitesine dayanarak, 10, 20, 30, 40, 47, 95, 140 ve 210 nm elde edilen DNA konsantrasyonları için partiküllerin DNA'nın uygun bir konsantrasyon ilave edin.
- Oda sıcaklığında bir döner tekerlek üzerinde 10 saniye ve yer Numuneler vorteksleDNA, bir streptavidin-biyotin etkileşimi yoluyla partikül yüzeylerine bağlanma için 30 dakika izin vermesi.
- Yakalama DNA eklenmiş ve streptavidin kaplı partiküller ile inkübe edildikten sonra, 30 dakika için bir manyetik raf üzerine numuneler yerleştirilerek manyetik ayırma ile çözelti içinde fazla DNA çıkarın.
- mıknatısa yakın parçacıkların yeni kurulan küme rahatsız etmemek için özen Süpernatantı ve yeni PBST aynı hacimde tampon ile değiştirin.
6. CP-partiküllerine tamamlayıcı DNA Hibridize
- ulaşıldı bağlanma mümkün olan en yüksek hedef sağlamak için (500 nM'de fazla) hedef DNA gerekli miktarda ekleyin.
- Girdap, 30 dakika boyunca oda sıcaklığında bir döner tekerlek üzerinde 10 saniye ve yer örnekleri.
- melezleştirme işlemi tamamlandıktan sonra, 30 dakika için bir manyetik raf üzerine numuneler yerleştirilerek manyetik ayırma ile fazla hedef DNA çıkarın.
- süpernatantı, Özen mıknatıs yakın parçacıkların yeni kurulan küme rahatsız ve yeni PBST aynı hacimde tampon ile değiştirmek için değil.
- Tekrar 6.1 Kopya örnekler için 6.4 adım ve bunların DNA hibridizasyon kez araştırmak için 16 saat boyunca oda sıcaklığında bir döner tekerlek üzerine, bu örnekleri yer.
7. TRPS Kurulumu
- yerinde yazılımı ile bilgisayar sistemine enstrüman takın.
- Bir kumpas kullanarak ilk streç kalibre edin.
- iki paralel çenelerin dış arasındaki mesafeyi ölçün.
- 'Çalgı Ayarları' sekmesinde 'streç' alanına streç yazıp sekme altındaki 'streç kalibre' tıklayarak yazılımı içine girdi.
- Yanal nanopore kimlik numarası yukarı bakacak şekilde çeneleri üzerine analiz için uygun boyutlandırma bir poliüretan nanopore membran uygun. Daha sonra, analiz kullanmak için gereken esneme çeneleri streçCihazın yan streç ayar kolu. 43 ve 48 mm arasında çeneleri gerin.
Not: streç tam değer uygulanan voltaja yanında kararlı olduğunu kalibrasyon parçacık blokajları boyutu en az 0.3 nA böylece. streç zaten adım 7.2 yazılımı içine girilen ve çeneler gergin olarak otomatik olarak ayarlanır. - sağlanması, nanopore altında, alt sıvı hücrede PBST tamponu 80 ul yerleştirin ölçümü etkileyebilecek mevcut hava kabarcığı vardır. kabarcıklar görülür varsa, kaldırmak ve tampon değiştirin.
- yerine üst sıvı hücreyi tıklatın ve içine tampon 40 ul koyun, tekrar sağlanması hava kabarcığı mevcut bulunmamaktadır. kabarcıklar üst sıvı hücrede varsa, sıvı değiştirerek bunları kaldırın.
- tekrarlanabilir bazal akım tamponu ile üst sıvı hücre yerine gelen ulaşıldığında, 'st tıklayarak üst sıvı hücre ve ölçüye örnek 40 ulyazılım ekranda veri toplama 'sekmesinde' in 'sanat.
Not: Bu 'Analiz Data' sekmesinden yazılımı kullanılarak değiştirilebilir, ancak veri toplama ( 'Analiz Ayarları' ve 'Dirençli blokajları' altında), 0.05 nA bir abluka büyüklüğü alt sınırı ile 50 kHz frekansta tamamlandı . - ölçümlere elektrik arka plan gürültüsünü azaltmak için sıvı hücre sisteminin üstünden bir Faraday kafesi yerleştirin.
- örnekler bir basınç veya vakum uygulamak için bir değişken basınç modülü (VPM) kullanın.
- harici bir basınç üst sıvı hücreye memesini bağlamak uygulamak için, daha sonra basınç kolu döndürün ve (bir pozitif basınç (PRE) ya da bir vakum (VAC) uygulanacaktır bağlı olarak) yerine tıklayın.
- VPM üstünde yer alan basınç sahne düğmesini kullanarak bir 'cm' veya 'mm' ölçekte basınç uygulayın. 't cm ölçekte baskı uygulamak ve yukarı çekin aşağı düğmesine basınızo 'mm' ölçekte basınç uygulayın.
TRPS Analizi 8. Hazırlama Örnekleri
- önceden TRPS analizi 80 watt, 2 dakika için 30 saniye ve sonikasyon vorteksleyin örnekleri.
9. Zeta Analizi için nanopore Kalibre
- Üst sıvı hücreye 40 ul kalibrasyon parçacıkları (1x10 10 parçacıklar / ml) yerleştirdikten sonra, 3 gerilimler uygulanan en (bölüm 7 gibi kurulum) bir TRPS ölçümünü tamamlamak. '-' Tuşları gerilim ölçekte yazılım üzerinde 'Enstrüman Ayarları' sekmesinde '+' ve tıklayarak gerilimi Alter.
- nA 3 gerilimler yaklaşık 140, 110 arka plan akımlarını dönmek olduğunu kontrol edin ve 80. orta gerilim kalibrasyon partikülleri en az 0.3 nA ortalama abluka büyüklüğü üretmek emin olun.
- Kalibrasyon parçacıkların ortalama tam genişlikte yarım maksimum (FWHM) süreleri en az böylece bir basınç uygulayın0.15 ms. elle değişken basınç modülüne bağlı basınç kolu kullanarak bunu. istenilen konumda tıklar ve buna göre adım 7.8.2 talimatları kurmak aşağıdaki uygulamak kadar kol çevirerek seçiniz basıncı (PRE) veya vakum (VAC). Bu koşullar elde edildikten sonra, 'Veri Toplama' sekmesinde yazılıma 'başlangıç' tıklayarak çalışma başlatmak.
- En az 500 partiküller (Ölçüm sırasında yazılım ekranın alt kısmında 'Partikül Sayısı' bölümüne bakınız) ölçülmüştür ve çalıştırma 30 saniye aştı zaman '(bkz' Veri Toplama 'sekmesinde' dur 'tuşuna basarak çalıştırmak tamamlayın Ayrıca ekranın alt kısmına doğru Run Time ').
- Yeni Nanopore tanıtıldı her zaman tarif edilen veya adım 9,1-9,4 tamamlayarak analiz her yeni gün için bir kalibrasyon çalışmasını tamamlayarak sistemi kalibre edin.
10. Bir örnek çalışan
- en yüksek örnekleri çalıştırmak veyaBenzer bir (± 10 nA) sağlanması kalibrasyon örnekleri olarak ikinci en yüksek voltaj, değilse aynı bazal akım.
- Uygun baz akımı elde edilir, örnek 40 ul üst sıvı hücreye elektrolit değiştirin. Bir örnek verildiğinde, abluka sinyal iz üzerinde görülecektir. 'Veri Toplama' sekmesinde 'başlangıç' tıklayarak çalıştırın örnek başlatın ve 500 parçacıkların en az kayıt (sinyal iz altında yer alan 'Parçacık Sayısı' kontrol edin) ve çalışma süresi sağlamak 30 sn minimum ( 'Çalıştır bkz Ayrıca, sinyal izleme altında yer zamanı ').
- Ölçümü tamamlamak için 'Veri Toplama sekmesinde "' dur 'tıklayın ve veri dosyası kaydedin.
- Dosyayı, giriş aşağıdaki biçimde dosya bilgileri kaydetmek için; 'Soruşturma' dosyasında kaydedilir klasör, 'Nanopore kimliği' gözenek seri numarası i, 'Parça' kullanılmakta olanNumune seyreltilmiş ise 'seyreltme' kullanılan bir kalibrasyon veya numune ölçüm, olup olmadığını 'Kalibrasyon ya da örnek bilgilerini, gözenek tipi (yani, NP150 / NP200),' Numune No 'örnek adıdır s ( numune seyreltilmiş ise 100 tip 100 kat), 'basınç' cm numuneye uygulanan basınç (bir - bölüm 7.8 bakınız), 'Elektrolit kimliği' örnek olarak oluşur tampon adıdır ve ' Notlar 'numune ya da kaçak hakkında herhangi bir kişisel notlar vardır.
- Her bir numune çalışması arasındaki kadar (-5 cm (vakum) ve 5 ve 10 cm (pozitif basınç) -10 ° C'de, genellikle) üst sıvı hücreye birkaç kez PBST 40 ul tampon yerleştirilmesi ve çeşitli basınçlar uygulanarak sistemi yıkama artık abluka olayları sistemde kalan hiçbir kalıntı parçacıklar ve numuneler arasında bu nedenle hiçbir çapraz kontaminasyon vardır sağlanması, mevcut bulunmaktadır. Her tekrar numune arasına tamamlanan bu yıkama aşamasında olan üç nüsha olarak çalıştırın numuneler wel olarak çalıştırmakFarklı örnekler arasında olduğu l.
Sonuçlar
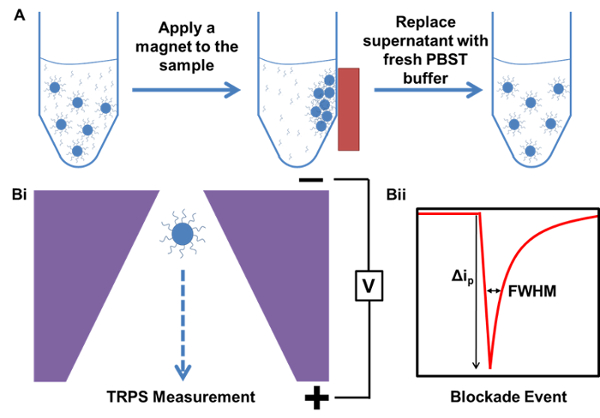
Manyetik saflaştırma ve TRPS ölçüm süreçlerinin 1. şematik gösterimi Şekil. Bir numune içeren fazlalığı, ilişkisiz yakalama prob DNA. B) ile başlayan numunenin manyetik arınma A) Örnek ölçüm örnek TRPS i) Parçacık geçici bir azalmaya neden nanopore geçerek ve ii) Blokaj olay gözenek parçac...
Tartışmalar
Zeta potansiyeli için hesaplama Arjmandi ve ark., 21 işe ilişkin bir kalibrasyon tabanlı yöntem kullanılır. parçacıkların translokasyonu süresi bir nanopore düzenli konik gözenek tümü boyunca bir ortalama elektrik alanı ve parçacık hızları kullanılarak, uygulanan voltajın bir fonksiyonu olarak ölçülür çapraz olarak. Elektroforetik mobilite algılama bölgesi uzunluğunun karesine, l ile çarpılan gerilime göre (T blokajı süresi) 1 / T türevidir. algılam...
Açıklamalar
ELCJB Izon Science Ltd. tarafından desteklenen
Teşekkürler
Yazarlar, desteklerinden dolayı Izon Bilim Ltd teşekkür ederim. iş Research (PCIG11-GA-2012-321836 Nano4Bio) için Avrupa Komisyonu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 ml deionized water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1 x 1012 particles/ml, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2 x 1019 C/nm2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4,352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1 x 1011 particles/ml. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCACTAC GCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGA GGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 100 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
Referanslar
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır