A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעת פוטנציאל זטה באמצעות Nanoparticle טרנסלוקציה מהירויות באמצעות nanopore מתכוונן: באמצעות חלקיקים שונה-DNA כמשל
In This Article
Summary
כאן אנו משתמשים nanopore מתכונן פוליאוריטן משולבים טכניקה חישה הדופק resistive לאפיין כימיה של פני השטח חלקיקים באמצעות מדידת מהירויות טרנסלוקציה החלקיקים, אשר ניתן להשתמש בהם כדי לקבוע את הפוטנציאל זטא של חלקיקים בודדים.
Abstract
טכנולוגיות nanopore, הידוע קולקטיבי חיישנים דופק התנגדותי (RPS), נמצאים בשימוש כדי לזהות, לכמת ולאפיין חלבונים, מולקולות חלקיקים. חישת דופק התנגדות מתכוונן (TRPS) היא עיבוד אחרון יחסית RPS שמשלב נקבובי מתכונן כי ניתן לשנות בזמן אמת. כאן, אנו משתמשים TRPS לפקח על הפעמים טרנסלוקציה של חלקיקים שונים DNA כפי שהם חוצים את הממברנה הנקבובית מתכוננת כפונקציה של ריכוז ה- DNA מבני (כלומר, חד גדילי הדנ"א פעמים תקועות).
TRPS מבוסס על שתי אלקטרודות Ag / AgCl, מופרדות על ידי קרום נקבובי אלסטומרי מקים זרם יוני יציב על שדה חשמלי מיושם. בניגוד לטכנולוגיות אפיון חלקיקים אופטיים מבוסס שונות, TRPS יכול לאפיין חלקיקים בודדים בקרב אוכלוסייה מדגמת, המאפשר דגימות multimodal להיות מנותחות בקלות. הנה, אנחנו מדגימים מדידות פוטנציאל זטהבאמצעות מהירויות טרנסלוקציה חלקיקים של סטנדרטים ידועים ולהחיל אלה לדגום פעמי טרנסלוקציה אנליטי, ולכן תוצאת מדידת פוטנציאל זטה של analytes אלה.
כמו גם רכישת ערכי פוטנציאל זטה ממוצעים, הדגימות נמדדות כל משתמש פרספקטיבת חלקיק אחר חלקיק מציגה מידע נוסף על מדגם נתון בדרך של חלוקות אוכלוסיית מדגם, למשל. על כך, שיטה זו ממחישה את פוטנציאל בתוך יישומי חישה לשני תחומי הבריאות והסביבה.
Introduction
חלקיקים פונקציונליים הופכים פופולריים יותר ויותר כמו biosensors בשני תחומי בריאות והסביבה. היכולת לשנות כימיה השטח של ננו-חלקיקים, עם DNA, למשל, היא להוכיח שימושי עבור מערכות שיגור תרופות 1 ואינטראקציות חלבון דנ"א ניטור 2-4. מאפיין nanoparticle נפוץ יותר ויותר מנוצל bioassays ו באספקה הרפויה הוא פאראמגנטיות על 5. חלקיקים פאראמגנטי (SPPs) הם מאוד שימושיים בזיהוי וסרת analytes הספציפי מתערובות מורכבות ויכולים לעשות זאת עם השימוש פשוט של מגנט יחיד. הוסר לאחר, החלקיקים הנכנס אנליטי ניתן לאפיין ולנתח מתאימים למטרה.
שיטות שהופעלו לצורך זיהוי והאפיון של חלקיקים כוללות שיטות אופטיות כגון פיזור אור דינאמי (DLS), הידוע גם בשם ספקטרוסקופיה קורלציה הפוטון. למרות הייטכניקת תפוקת GH, DLS מוגבל להיות טכניקת מיצוע מבוססת בעת ניתוח דגימות multimodal ללא תוספת של תוכנה מומחית, החלקיקים הגדולים יותר יפיקו אות דומיננטית הרבה יותר, ומשאיר חלק החלקיקים הקטנים לחלוטין 6,7 מעיניהם. חלקיקים-ידי חלקיק טכניקות אפיון ולכן הם הרבה יותר נוחים לנתח ננו-חלקיקים ומערכות ננו-חלקיקים פונקציונליים.
טכנולוגיות מבוססות RPS מבוססות סביב החלת שדה חשמלי מדגם וניטור מנגנון התחבורה של החלקיקים באמצעות nanopore סינטטי או ביולוגי. ננו-חלקיק חדש יחסית טכניקת זיהוי ואפיון מבוססת על RPS היא החישה הדופקת resistive מתכונן (TRPS) 8-16. TRPS היא מערכת דו-אלקטרודה המופרדת על ידי קרום נקבובי אלסטומרי, מתכונן. שיטה נקבובית מתכונן מאפשרת analytes של מגוון של צורה 17 וגודל להימדד באמצעות שלהם טרנסמנגנוני יציאה דרך הנקבוביות. הנקבוביות מתכוננות בעבר שמשו לצורך זיהוי של חלקיקים קטנים (בקוטר ננומטר 70-95) בהפקת תוצאות דומות טכניקות אחרות כגון ספקטרוסקופיה אלקטרוני הילוכים (TEM) 10. כאשר שדה חשמלי מוחל, זרם יוני הוא ציין כחלקיקים / מולקולות לעבור דרך הנקבובית, הם חוסמים זמנית את הנקבוביות, מה שגרם לירידה הנוכחית יכול להיות מוגדרת כ "אירוע מצור". אירוע מצור כל הוא נציג של חלקיק בודד, כך שכל חלקיקים בתוך מדגם ניתן לאפיין באופן אישי המבוסס על גודל המצור, Δ 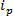 , ורוחב מלא ערך חצי, FWHM, וכן נכסי מצור אחרים. ניתוח חלקיקים בודדים כשהם עוברים דרך nanopore הוא יתרון עבור דגימות multimodal כמו TRPS יכול בהצלחה וביעילות להבחין במגוון של החלקיקים גדלים עמוןGST מדגם יחיד. חישת דופק התנגדות מתכוונן משלימה גודל 10, 12,18 ו -15 מדידות ריכוז פוטנציאל זטה זמנית בטווח אחת ולכן יכולה עדיין להבדיל דגימות של דומה, אם לא באותו הגודל על ידי תשלום השטח שלהם 19; יתרון על פני טכניקות אומדות חלופיות.
, ורוחב מלא ערך חצי, FWHM, וכן נכסי מצור אחרים. ניתוח חלקיקים בודדים כשהם עוברים דרך nanopore הוא יתרון עבור דגימות multimodal כמו TRPS יכול בהצלחה וביעילות להבחין במגוון של החלקיקים גדלים עמוןGST מדגם יחיד. חישת דופק התנגדות מתכוונן משלימה גודל 10, 12,18 ו -15 מדידות ריכוז פוטנציאל זטה זמנית בטווח אחת ולכן יכולה עדיין להבדיל דגימות של דומה, אם לא באותו הגודל על ידי תשלום השטח שלהם 19; יתרון על פני טכניקות אומדות חלופיות.
פוטנציאל זטה מוגדר הפוטנציאל אלקטרוסטטי על המטוס של 20 גזירה, והוא מחושב מן מירויות חלקיקים כפי שהם חוצים נקבוביים 19. מדידות פוטנציאל זטה של חלקיקים בודדים ובכך נותנות תובנה מנגנוני טרנסלוקציה וההתנהגות של מערכות ננו-חלקיקים בתמיסה, מידע רב ערך עבור העתיד של עיצובי assay nanoparticle עבור מגוון רחב של יישומים. החלקיקים-ידי חלקיק ניתוח של אופי כזה גם מאפשר פריסה והפצה של ערכי פוטנציאל זטה בקרב אוכלוסייה מדגם כדי להיחקר, המאפשר למידע נוסף oקינטיקה תגובת n (חד גדילי הדנ"א הדו-גדילית, למשל) ואת יציבות חלקיקים בתמיסה כדי להיות מושגת.
כאן אנו מתארים טכניקת מאתר המאפיינת הן ללא שינוי ו-שונה DNA משטחי SPP. הפרוטוקול המתואר במסמך זה חל על מגוון של חלקיקים אורגניים וביולוגיים, אבל אנחנו מדגימים את ההליך באמצעות משטחים-modified DNA בשל המגוון הרחב של יישומים שלהם. הטכניקה מאפשרת למשתמש להבחין בין מטרות דנ"א חד-גדילי ו פעמיים תקועים על משטח ננו-חלקיקים, מבוסס על מהירויות טרנסלוקציה החלקיקים באמצעות מערכת הנקבוביות ובכך פוטנציאל זטה שלהם.
Protocol
1. ביצוע בופר פוספט עם Tween-20 (PBST) חוצץ
- ממיסים טבליה אחת PBS (0.01 M פוספט חיץ, 0.0027 M אשלגן כלוריד, 0.137 M נתרן כלוריד, pH 7.4) ב 200 מ"ל מים deionized (18.2 MΩ ס"מ).
- הוספת 100 μl (0.05 (v / v)%) Tween-20 הפתרון 200 מ"ל חיץ בתור פעילי שטח.
2. הכנת תקני חלקיקי פוליסטירן carboxyl
- וורטקס חלקיקי כיול למשך 30 שניות לפני sonication עבור 2 דקות ב 80 וואט ליצור monodispersity של חלקיקים.
- לדלל את חלקיקי כיול 1 ב 100 לריכוז של 1x10 10 מ"ל / חלקיקים במאגר מערבולת PBST במשך 30 שניות.
3. הכנת חלקיקים streptavidin מצופים
- וורטקס חלקיקים במשך 30 שניות לפני sonication עבור 2 דקות ב 80 וואט כדי להבטיח monodispersity.
- לדלל את החלקיקים מצופים streptavidin 1 ב 100 חיץ PBST אי.סיhieve ריכוז כתוצאה של 1x10 9 חלקיקים / מ"ל ו מערבולת למשך 30 שניות.
הערה: נפח דגימה טיפוסי הוא 200 μl. לדוגמא, אם חוקר חמישה ריכוזי DNA להכין 1 מיליליטר של חלקיקי streptavidin מצופים מדוללים.
4. הכנת Oligonucleotides
- לשקם oligonucleotides עם מים ללא יונים לריכוז וכתוצאה מכך של 100 מיקרומטר.
תוספת 5. לכידת Probe (CP) DNA כדי החלקיקים המצופים streptavidin
- לפני DNA מחייב, מערבולת חלקיקים מצופים streptavidin (200 נפח דגימה μl) במשך 30 שניות ואחריו sonication 2 דקות ב 80 וואט.
- בהתבסס על קיבולת מחייב שמספק לו הספק (4,352 pmol / מ"ג), להוסיף את הריכוז המתאים של DNA בין החלקיקים לריכוזי וכתוצאה מכך של 10, 20, 30, 40, 47, 95, 140, ו -210 DNA ננומטר.
- וורטקס דגימות במשך 10 שניות ומניחים על גלגל רוטרי בטמפרטורת החדרבמשך 30 דקות, כדי לאפשר את ה- DNA כדי לאגד את משטחי החלקיקים באמצעות אינטראקציה streptavidin ביוטין.
- לאחר DNA ללכוד נוסף וטופח עם החלקיקים מצופים streptavidin, להסיר את ה- DNA העודף בתמיסה באמצעות פרדה מגנטית על ידי הצבת הדגימות על מתלה מגנטית למשך 30 דקות.
- הסר את supernatant, נזהר שלא להפריע באשכול שהוקם זה עתה של חלקיקים קרובים המגנט, ולהחליף עם הנפח הזהה של חיץ PBST חדש.
6. והכלאה DNA משלימים חלקיקי-CP
- להוסיף את הכמות הנדרשת של ה- DNA היעד (העולה ב 500 ננומטר), כדי להבטיח את היעד המקסימאלי האפשרי המחייב הושג.
- וורטקס את הדגימות למשך 10 שניות ומניחים על גלגל רוטרי בטמפרטורת החדר למשך 30 דקות.
- לאחר ההכלאה הושלמה, הסר את ה- DNA היעד העודף באמצעות פרדה מגנטית על ידי הצבת הדגימות על מתלה מגנטית למשך 30 דקות.
- הסר את supernatant, נזהר שלא להפריע באשכול שהוקם זה עתה של חלקיקים קרובים המגנט, ולהחליף אותו הנפח של חיץ PBST חדש.
- חזור על שלבים 6.1 עד 6.4 עבור דגימות כפולות ומניחים דגימות אלה על גלגל רוטרי בטמפרטורת החדר למשך 16 שעות כדי לחקור פעמים הכלאה DNA.
הגדרת TRPS 7.
- חברו את המכשיר לתוך מערכת מחשב עם תוכנת במקום.
- כייל את המתיחה הראשונית באמצעות קליפר.
- למדוד את המרחק בין החלק החיצוני של שתי לסתות במקבילות.
- קלט לתוך התוכנה על ידי הקלדת את המתיחה בשדה 'למתוח' בכרטיסייה 'הגדרות מכשיר' ולחיצה על 'כייל למתוח "מתחת ללשונית.
- רוחבי להתאים קרום nanopore פוליאוריטן של אומדת המתאימה לניתוח על הלסתות עם מספר תעודת זהות nanopore פונה כלפי מעלה. ואז, למתוח את הלסתות ועד המשטח הנדרש לניתוח באמצעותידית התאמה מתיחה בצד של המכשיר. מתח את הלסתות בין 43 ו -48 מ"מ.
הערה: הערך המדויק של המתיחה נקבע לצד מתח מיושם כך חסימות חלקיקי כיול כי הם לפחות 0.3 Na בגודל. המתיחה כבר שהוזנה לתוך התוכנה בשלב 7.2 תתאים באופן אוטומטי כאשר הלסתות נמתחות. - מניחים 80 μl של חיץ PBST בתא נוזל נמוך, מתחת nanopore, הבטחת אין בועות בהווה שעשויים להשפיע על המדידה. אם יש בועות לראות, להסיר ולהחליף את המאגר.
- לחץ על תא הנוזל העליון למקום ומניח 40 μl של חיץ לתוכו, שוב להבטיח שאין בועות בהווה. אם בועות נמצאות בתא הנוזל העליון, להסיר אותם על ידי החלפת הנוזל.
- כאשר זרם בסיס לשחזור הושג מן החלפת תא הנוזל העליון עם חיץ, להוסיף 40 μl של המדגם לתא ולמדוד נוזל העליון באמצעות לחיצה על 'רחאמנות 'ב' הכרטיסייה 'קליטת נתונים על המסך תוכנה.
הערה: רכישת הנתונים הושלמה בתדר של 50 kHz בעצמת מצור גבול תחתון של 0.05 NA, אם כי זה יכול להשתנות באמצעות התוכנה דרך הכרטיסייה 'נתוני Analyse' (תחת 'הגדרות ניתוח' ו 'התנגדותי וחסימות') . - מניח כלוב פאראדיי על החלק העליון של מערכת התא הנוזלת להפחית רעשי רקע חשמליים על המדידות.
- השתמש מודול לחץ משתנה (VPM) להחיל לחץ או ואקום על הדגימות.
- להחלת לחץ חיצוני להתחבר הנחיר אל תא הנוזל העליון, ולאחר מכן סובב את הזרוע לחץ ולחץ למקומו (תלויים אם לחץ חיובי (PRE) או ואקום (VAC) יחול).
- החל הלחץ בקנה מידה 'ס"מ' או 'mm' באמצעות כפתור לחץ הבמה ממוקם בחלק העליון של VPM. לחצו על הכפתור למטה כדי להפעיל לחץ על הסקאלה 'ס"מ "ולמשוך אותו כלפי מעלה to להפעיל לחץ על הסקאלה 'mm'.
8. דוגמאות הכנות לקראת ניתוח TRPS
- דגימות וורטקס למשך 30 שניות sonicate במשך 2 דקות ב 80 וואט לפני ניתוח TRPS.
9. כיול nanopore עבור זיטה ניתוח
- לאחר הצבת 40 חלקיקים כיול μl (1x10 10 חלקיקים / מ"ל) לתוך תא נוזל העליון, להשלים מדידה TRPS (ההתקנה כאמור בסעיף 7) ב 3 מיושם מתח. אלטר מתח על ידי לחיצה על '+' ו '-' כפתורים על סולם המתח בכרטיסייה 'Instrument ההגדרות' על התוכנה.
- בדוק כי לחזור 3 המתחים זרמי רקע של כ 140, 110, ו -80 נה. ודא במתח הבינוני חלקיקי הכיול לייצר גודל מצור ממוצע של לפחות 0.3 NA.
- החלה לחץ כל כך הערך חצי רוחב הממוצע (FWHM) משכים של חלקיקי הכיול לפחות0.15 מילי-שניות. לעשות זאת באופן ידני באמצעות זרוע הלחץ המצורפת מודול הלחץ משתנה. לחץ בחר (PRE) או ואקום (VAC) על ידי סיבוב הזרוע עד שייכנס במיקום הרצוי ולהחיל הוראות הבאות להגדיר בהתאם בשלב 7.8.2. לאחר תנאים אלה הושגו, להתחיל לרוץ על ידי לחיצה על 'התחל' על התוכנה בלשונית 'רכישת הנתונים'.
- השלם את הריצה על ידי לחיצה על 'עצור' בלשונית 'הנתונים רכישת' כאשר 500 חלקיקים לפחות נמדדו (ראו 'רוזן חלקיקים' בתחתית מסך התוכנה במהלך המדידה) ואת הריצה חרגה 30 שניות (ראה " Run Time 'גם לכיוון החלק התחתון של המסך).
- כייל את המערכת על ידי השלמת ריצת כיול כמתואר בכל פעם nanopore חדש הוא הציג או לכל יום חדש של ניתוח על ידי השלמת שלב 9.1-9.4.
10. הפעלה לדוגמא
- הפעל את הדגימות בגבוהה אושני המתח גבוה ביותר כמו דגימות הכיול להבטיח דומים (± 10 NA), אם לא זהה, נוכחי בסיס.
- לאחר זרם הבסיס המתאים מושג, להחליף את האלקטרוליט בתא הנוזל העליון עם 40 μl של מדגם. בעת החלפת מדגם הוא הציג, חסימות תהיינה לראות על עקבות האות. התחל המדגם מנוהל על ידי לחיצה על 'התחל' בלשונית 'הקליטים הנתונים' ולהקליט מינימום של 500 חלקיקים (לבדוק "רוזן חלקיקים 'ממוקם תחת עקבות האות) ולהבטיח את זמן הריצה הוא מינימום של 30 שניות (ראה" הפעלה זמן 'נמצא גם מתחת עקבות אות).
- כדי להשלים את המדידה, לחץ על 'עצור' ב 'כרטיסייה קליטת נתונים' ולשמור את קובץ הנתונים.
- כדי לשמור את הקובץ, להזין את פרטי הקובץ בפורמט הבא; "חקירה" היא התיקייה הקובץ יישמר, 'מזהה nanopore' הוא המספר הסידורי של הנקבובית בשימוש, 'חלק #' iזה סוג של הנקבוביות (כלומר, NP150 / NP200), 'מזהה לדוגמא' הוא שמו של המדגם, 'כיול או מדגם' פרטים אם זה כיול מכשיר המדידה או מדגם, "דילול" משמש אם המדגם היה מדולל ( הקלד 100 אם המדגם היה מדולל פי 100), "לחץ" הוא הלחץ המופעל המדגם (בס"מ - ראה סעיף 7.8), "אלקטרוליט מזהה" הוא שמו של חיץ המדגם מורכב ב, ו ' הערות 'הערות כלשהן אישיות על המדגם או לרוץ.
- בין ריצה לריצה מדגם, לשטוף את המערכת על ידי הצבת 40 μl של PBST חיץ לתוך התא נוזל העליון מספר פעמים ויישום לחצים שונים (בדרך כלל ב -10, -5 ס"מ (ואקום), ו -5 ו -10 ס"מ (לחץ חיובי)) עד לא יותר אירועי מצור נוכחים, הבטחה אין חלקיקים שיורית הנותרים במערכת ולכן לא זיהום צולב בין דגימות. דגימות לרוץ בשלושה עותקים עם שלב זה לשטוף הושלם בין כל דגימה חוזר לרוץ כמו well כמו בין מדגמים שונים.
תוצאות
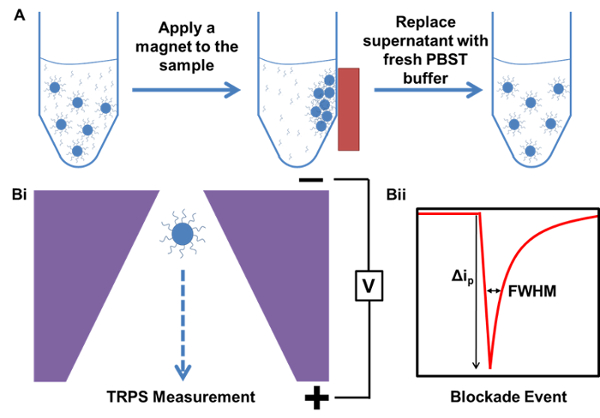
באיור 1. ייצוג סכמטי של תהליכי טיהור מגנטי מדידה TRPS. א) דוגמא של טיהור המגנטית של מדגם החל מדגם המכיל עודף, DNA בדיקה ללכוד מאוגד. B) TRPS למשל מדידת i) חלקיקים העוברים דרך nanopore ו ii) אירוע מצ...
Discussion
החישוב עבור פוטנציאל זטה השתמש בשיטה המבוססת כיול הקשורים לעבודת Arjmandi et al. 21. משך טרנסלוקציה של חלקיקים כאשר הם חוצים nanopore נמדדת כפונקציה של מתח מיושם, באמצעות מהירויות שדה חלקיק חשמליות ממוצע על המכלול של נקבובי חרוטים קבועים. ניידות electrophoretic היא נגזרת...
Disclosures
ELCJB נתמך על ידי Izon מדע בע"מ
Acknowledgements
המחברים מודים Izon מדע בע"מ על תמיכתם. העבודה נתמכה על ידי הנציבות האירופית למחקר (PCIG11-GA-2,012-321,836 Nano4Bio).
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved