JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
조정 나노 기공을 통해 나노 입자 전좌 속도를 통해 제타 전위의 측정 : 예를 들어 DNA 변성 입자를 사용하여
요약
여기에서는 개개의 나노 입자의 제타 포텐셜을 결정하는데 사용될 수있다 입자 전위 속도의 측정을 통해 나노 입자의 표면 화학을 특징 저항 펄스 감지 기술에 통합 된 폴리 우레탄 동조 나노 기공을 사용한다.
초록
저항 펄스 센서 (RPS)로 총칭 알려진 나노 기공 기술, 탐지, 정량화 및 단백질 분자와 나노 입자의 특성을 사용하고있다. 조정 가능한 저항 펄스 센서 (TRPS)는 실시간으로 변경 될 수있는 조정 가능한 공극을 포함 RPS 비교적 최근에 적응된다. 그들은 DNA 농도 및 구조의 함수로서 가변 기공 멤브레인을 통과 여기 우리 DNA 변성 나노 입자의 전위의 시간을 모니터링하는 TRPS를 사용하여 (즉, 단일 쇄 이중 가닥 DNA)이다.
TRPS는 전계인가시 안정한 이온 전류를 설정 엘라스토머 기공 막에 의해 분리 된 두개의 Ag / AgCl을 전극에 기초한다. 각종 광학 기반 입자 특성 기술과 달리, TRPS는 복합 샘플 용이하게 분석 할 수 있도록하는 샘플 모집단 중에서 개개의 입자를 특성화 할 수있다. 여기, 우리는 제타 전위 측정을 보여공지 된 표준 입자 전위 속도 통해 따라서 이러한 분석의 제타 전위 측정 결과 피검 전좌 회 샘플링이 적용.
뿐만 아니라 평균 제타 전위 값을 획득하는 등, 샘플은 모든 예를 들어, 샘플 인구 분포를 통해 주어진 샘플에 대한 자세한 정보를 나타내는 입자에 의해 입자의 관점을 사용하여 측정하고 있습니다. 이러한 가운데,이 방법은 모두 의료 및 환경 분야에 대한 감지 애플리케이션 내에서 가능성을 보여줍니다.
서문
기능화 나노 입자는 의료 및 환경 분야 모두에서 바이오 센서로 점점 더 인기를 끌고있다. 능력은 예를 들어 표적 약물 전달 시스템 (1) 및 감시 DNA 단백질 상호 작용 2-4 유용 증명, DNA와 나노 입자의 표면 화학을 변경한다. 점점 일반적인 나노 입자의 특성은 생물 검정에서 활용 및 치료제의 전달에 초상 자성 5된다. 초상 자성 입자 (SPPS)를 식별하고 복잡한 혼합물에서 특정 분석을 제거하는데 매우 유용하며, 하나의 자석의 간단한 사용하여 수행 할 수 있습니다. 일단 제거 된 분석 결합 된 입자는 특징과 목적에 맞는 분석 할 수 있습니다.
나노 입자의 검출 및 특성화에 사용되는 이전의 방법은 달리 광자 상관 분광법으로 알려진 동적 광산란 (DLS) 등의 광학 기법을 포함한다. 안녕하세요 있지만GH 처리량 기술, DLS이 평균을 기반으로 기술되고 그리고 전문 소프트웨어의 추가없이 복합 시료를 분석하는 경우에 한정되어, 더 큰 입자는 -6,7- 완전히 알려지지 작은 입자의 일부를 남겨, 훨씬 더 우세 신호를 생성한다. 입자가 입자의 특성화 기술은 따라서 더욱 바람직한 나노 입자 및 나노 입자의 작용 화 시스템을 분석한다.
RPS 기반 기술은 시료에 전기장을인가하고, 합성 또는 생물학적 나노 기공을 통해 입자의 반송기구를 감시를 기반으로한다. RPS에 기초한 비교적 최근 나노 검출 및 특성화 기법은 가변 저항 펄스 센서 (TRPS) 8-16이다. TRPS는 엘라스토머, 가변 기공 막에 의해 분리 된 두 개의 전극 시스템이다. 파장 가변 세공 방법은 트랜스를 통해 측정되는 도형 (17)의 크기의 범위의 분석을 허용기공을 통해 포트 메커니즘. 동조 기공 종전에는 투과형 전자 분광법 (TEM) (10)과 같은 다른 기술들에 비교 결과를 생성하는 작은 입자의 검출 (70 내지 95 nm의 직경)에 사용되어왔다. 전기장이인가되면, 이온 전류가 관찰되는 입자 / 분자가 공극을 통과 할 때, 이들은 일시적 '봉쇄 이벤트'로 정의 될 수있는 전류의 감소를 일으키는 원인이되는 기공을 차단. 샘플 내의 각각의 입자 특성을 개별적으로 봉쇄 진폭, Δ에 기초 할 수 있도록 각 차단 이벤트는 하나의 입자의 대표 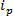 및 반값 폭, FWHM뿐만 아니라 다른 차단 특성. 그들은 나노 기공을 통과 할 때 개개의 입자를 분석하는 것은 입자 아몬 크기의 TRPS가 성공적으로 효과적으로 범위를 구별 할 수있는 복합 샘플에 유리하다하나의 샘플을 GST. 조정 저항 펄스 감지 크기 10, 단일 실행에서 동시에 제타 전위 12, 18, 20, 22 및 농도 (15) 측정을 완료하고 여전히 비슷한 샘플을 차별화 따라서 할 수있는 경우에 그 표면 전하 (19)에 의해하지 같은 크기; 대안 사이징 기술을 통해 장점.
및 반값 폭, FWHM뿐만 아니라 다른 차단 특성. 그들은 나노 기공을 통과 할 때 개개의 입자를 분석하는 것은 입자 아몬 크기의 TRPS가 성공적으로 효과적으로 범위를 구별 할 수있는 복합 샘플에 유리하다하나의 샘플을 GST. 조정 저항 펄스 감지 크기 10, 단일 실행에서 동시에 제타 전위 12, 18, 20, 22 및 농도 (15) 측정을 완료하고 여전히 비슷한 샘플을 차별화 따라서 할 수있는 경우에 그 표면 전하 (19)에 의해하지 같은 크기; 대안 사이징 기술을 통해 장점.
제타 전위는 전단 (20)의면에 정전 전위로 정의되며, 그들은 기공 (19)로 이동할 때 입자 속도로부터 계산된다. 개별 입자의 제타 전위 측정 따라서 전위기구 및 솔루션의 나노 입자 시스템, 응용 프로그램의 범위에 대한 나노 입자 분석 디자인의 미래를위한 가치있는 정보의 행동에 대한 통찰력을 제공합니다. 이러한 자연의 입자에 의해 입자 분석은 또한 오 자세한 내용은 허용 표본 집단 사이에 확산 및 제타 전위 값의 분포를 탐험 할 수 있습니다용액 N의 반응 속도 (예를 들어, 이중 가닥 DNA를 단일 가닥) 및 입자 안정성이 달성된다.
여기서 우리는 감지하고 수정되지 않은 및 DNA 변성 SPP 표면 모두를 특징 짓는 기술을 설명합니다. 여기에 기술 된 프로토콜은 무기 나노 입자와 생체의 범위에 적용 할 수 있지만,이 때문에 애플리케이션들은 광범위한 DNA 변성 표면을 사용하는 절차를 보여준다. 이 기술은 사용자에 따라서 입자 전좌 기공 시스템을 통해 속도 및 제타 전위에 기초하여, 나노 입자 표면 상에 단일 가닥 및 이중 가닥 DNA 표적을 구별 할 수있다.
프로토콜
1. 트윈 20 (PBST) 완충액으로 포스페이트 완충 염수 만들기
- 200 ml의 탈 이온수 (18.2 MΩ cm)을 하나의 정제 PBS (0.01 M 인산염 완충액, 0.0027 M 염화칼륨, 0.137 M 염화나트륨, pH 7.4의)을 녹인다.
- 계면 활성제로 200 ㎖의 완충 용액 100 μL (0.05 (v / v)의 %) 트윈 (20)를 추가합니다.
2. 카르 복실 폴리스티렌 입자 표준을 준비
- 단 분산 입자를 만들 80w에서 2 분 동안 초음파 처리 전 30 초 동안 교정 입자 소용돌이.
- 30 초 동안 PBST 버퍼 소용돌이에 1 × 10 입자 / ml의 농도로 조정 입자 (100)에 제 1 희석.
3. 준비 스트렙 타비 딘 코팅 입자
- 단 분산을 보장하기 위해 80w에서 2 분간 초음파 전에 30 초 동안 입자를 소용돌이.
- AC에 PBST 버퍼 (100)에서 스트렙 타비 딘 코팅 입자를 1 희석30 초에 대한 결과 1 × 9 입자 / ml의 농도와 소용돌이를 hieve.
참고 : 일반적인 샘플 볼륨이 200 μL입니다. 예를 들면, 조사하는 경우 다섯 DNA 농도는 희석 된 스트렙 타비 딘 코팅 입자를 1 ㎖를 준비한다.
올리고 뉴클레오티드 4. 제조
- 100 μM의 결과 농도로 탈 이온수로 올리고 뉴클레오티드를 복원합니다.
스트렙 타비 딘 코팅 입자에 캡처 프로브 (CP) DNA 5. 추가
- DNA 결합 이전에, 와류 80w에서 2 분간 초음파 처리 한 다음 30 초 동안 스트렙 타비 딘 코팅 된 입자 (200 μL 샘플 량).
- 보조 장비 (4352 pmol의 ㎎ /)에 의해 제공되는 결합 용량에 기초하여, 10, 20, 30, 40, 47, 95, 140, 210 나노 DNA의 얻어진 농도에 대한 입자에 DNA의 적절한 농도를 추가한다.
- 실온에서 회전 바퀴에 10 초와 장소에 대한 샘플을 와동DNA를가 스트렙 타비 딘 - 바이오틴 상호 작용을 통해 입자 표면에 결합하는 30 분을 허용하기 위해.
- 캡처 DNA를 첨가하고, 스트렙 타비 딘 코팅 된 입자와 함께 배양 한 후, 30 분 동안 자기 랙 상에 샘플을 배치하여 자기 분리를 통해 용액에 과량의 DNA를 제거한다.
- 자석에 가장 가까운 입자의 새로 형성된 클러스터를 방해하지 않도록주의하면서 상층 액을 제거하고 새로운 PBST 버퍼의 동일한 볼륨으로 교체합니다.
6. CP 입자 상보 DNA 혼성화
- 도달 한 결합 가능한 최대 목표를 위해 (500 nm에서 초과) 대상 DNA의 필요한 양을 추가합니다.
- 볼텍스 30 분 동안 실온에서 회전 바퀴 10 초 및 장소 샘플.
- 혼성화가 완료된 후 30 분 동안 자기 랙 상에 샘플을 배치하여 자기 분리를 통해 과량의 표적 DNA를 제거한다.
- 상층 액을 제거주의하면서 자석에 가장 가까운 입자의 새로 형성된 클러스터를 방해하고, 새로운 PBST 버퍼의 동일한 볼륨으로 대체 할 수 없습니다.
- 반복 중복 샘플 6.1 6.4 단계 및 DNA 혼성화 회 조사 실온에서 16 시간 동안 회전 휠이 샘플을 놓는다.
7. TRPS 설치
- 대신에 소프트웨어를 컴퓨터 시스템에 기기를 연결합니다.
- 캘리퍼스를 사용하여 초기 스트레칭을 보정합니다.
- 두 개의 평행 한 턱의 외측 사이의 거리를 측정한다.
- '장비 설정'탭에서 '스트레칭'필드에서 스트레칭을 입력하고 탭 아래 '스트레칭 교정'을 클릭하여 소프트웨어에 입력.
- 옆으로 나노 기공의 ID 번호가 위로 향하게하여 턱에 분석을 위해 적절한 크기의 폴리 우레탄 나노 기공 막에 맞게. 그 후, 분석은 사용에 필요한 신장에 조우 스트레칭악기의 측면에 스트레치 조정 핸들입니다. (43)와 48mm 사이의 턱을 스트레칭.
참고 : 스트레칭의 정확한 값은인가 전압과 함께 결정된다 교정 입자 봉쇄의 크기가 적어도 0.3 nA의를 그래서. 스트레칭은 이미 단계 7.2 소프트웨어에 입력하고 턱이 신장 될 때 자동으로 조정됩니다. - 보장, 나노 기공 아래, 낮은 유체 셀에 PBST 버퍼의 80 μl를 놓고 측정에 영향을 미칠 수있는 기포가 없습니다. 거품이 볼 수있는 경우 제거하고 버퍼를 교체합니다.
- 제자리에 상부 유체 셀을 클릭하고 그것으로 버퍼의 40 μl를 놓고 다시 보장 기포가 존재가 없습니다. 기포가 상부 유체 세포에 존재하는 경우, 액체를 교체하여이를 제거한다.
- 재현성 기준 전류 버퍼 상부 유체 셀 교체로부터 도달하면, ST '를 클릭하여 상부 유체 셀 측정하는 시료의 40 μL를 추가소프트웨어 화면에서 데이터 수집 '탭'에 '예술.
참고 :이이 '분석한다 데이터'탭을 통해 소프트웨어를 사용하여 변경 될 수 있지만 데이터 수집이 ( '분석 설정'과 '저항 봉쇄'아래), 0.05 nA의의 봉쇄 크기 하한 50 kHz의 주파수에서 완료 . - 측정에 전기적 배경 잡음을 줄이기 위해 상기 유체 전지 시스템의 맨 위에 패러데이 케이지를 놓는다.
- 샘플에 압력 또는 진공을 적용 할 변수 압력 모듈 (VPM)를 사용합니다.
- 외부 압력이 상부 유체 셀에 노즐을 연결 적용하려면 다음 압력 팔을 회전 (양압 (PRE) 또는 진공 (VAC)이 적용됩니다 여부에 따라) 위치에 클릭합니다.
- VPM의 상단에 위치한 압력 단계 노브를 사용하여 'cm'또는 'mm'규모에 압력을 적용합니다. t 'cm'규모에 압력을 위쪽으로 당겨 아래로 노브를 누르면O를 'mm'규모에 압력을 적용합니다.
TRPS 분석 8. 준비 샘플
- 이전 TRPS 분석에 80w에서 2 분 30 초와 초음파 처리를위한 소용돌이 샘플.
9. 제타 분석을위한 나노 기공 보정
- 상부 유체 세포 내로 40 μL 교정 입자 (1 × 10 입자 / ㎖)를 배치 한 후, (3)이인가 전압에 (7에서와 같이 셋업)을 TRPS 측정을 완료. '-'버튼을 전압 규모에 소프트웨어의 '장비 설정'탭에서 '+'를 클릭하여 전압을 변경합니다.
- nA의를 3 전압이 약 (140), (110)의 배경 전류를 반환 할 것을 확인하고 80. 중간 전압 교정 입자가 적어도 0.3은 Na 평균 봉쇄 크기를 생산하고 있는지 확인합니다.
- 교정 입자의 평균 전체 폭 절반 최대 값 (FWHM) 기간 적어도 그래서 압력을 적용0.15 밀리 초. 수동 변압 모듈에 연결된 압력 아암을 이용하여 이렇게. 가 원하는 위치에 클릭하고 그에 따라 단계 7.8.2에서 지침을 설정, 다음이 적용됩니다 때까지 팔을 회전하여 선택 압력 (PRE) 또는 진공 (VAC). 이러한 조건이 달성 된 후에는 '정보 수집'탭에서 소프트웨어의 '시작'을 클릭하여 실행을 시작합니다.
- 최소 500 입자 (측정하는 동안 소프트웨어 화면 하단의 '입자 수를'참조)로 측정되었으며 실행이 30 초를 초과 할 때 '(참조'데이터 수집 '탭에서'정지 '를 눌러 실행을 완료 또한 화면의 아래쪽으로 실행 시간 ').
- 새로운 나노 기공이 도입 될 때마다 설명 또는 단계 9.1-9.4를 완료하여 분석의 각각의 새로운 하루로 보정 실행을 완료하여 시스템을 보정합니다.
(10) 샘플을 실행
- 최고에서 샘플을 실행하거나비슷한 (± 10 nA의)를 보장에서 교정 샘플로 두 번째로 높은 전압, 그렇지 않은 경우 동일 기준 전류.
- 적절한 기준 전류가 달성되면, 시료 40 μL와 상부 유체 셀에 전해질을 대체. 시료가 도입되는 경우, 봉쇄는 신호 트레이스 알 수있을 것이다. '데이터 수집'탭에서 '시작'을 클릭하여 실행 샘플을 시작하고 500 입자의 최소 기록 (신호 트레이스 아래에 위치한 '입자 개수'를 점검) 및 동작 시간을 보장하는 30 초 최소이다 ( '실행을 참조하십시오 또한 신호 트레이스 아래에 위치 시간 ').
- 측정을 완료하려면 '데이터 수집 탭'에서 '정지'를 클릭하고 데이터 파일을 저장합니다.
- 파일, 입력 다음과 같은 형식의 파일 정보를 저장하려면; '조사'는 파일에 저장 될 폴더, '나노 기공 ID'는 기공의 일련 번호가 나는, '부품 번호'를 사용하고있다샘플을 희석 한 경우 '희석'사용이 교정 또는 샘플 측정,인지 '교정 또는 샘플'세부 기공의 유형 (즉, NP150 / NP200)은, "샘플 ID '는 샘플의 이름 S ( 샘플을 희석 한 경우 (100)를 입력 100 배) '압력'는 cm의 샘플에 가해진 압력 (인 - 섹션 7.8 참조), '전해질 ID'는 상기 샘플에서 만든 버퍼의 이름이고, 그리고 ' 참고 '샘플 또는 실행에 대한 개인 노트입니다.
- 각 샘플의 실행 사이까지 (-5 cm (진공), 5, 10 cm (양압) -10- 통상) 상부 유체 세포로 수회 PBST 40 ㎕의 버퍼를 배치하고 다양한 압력을 적용하여 시스템을 씻어 더 이상 봉쇄 이벤트가 시스템에 남아있는 잔여 입자와 샘플 사이 따라서없이 교차 오염이 없을 보장 존재한다. 각각의 반복 샘플 사이에 완성 된이 세척 단계와 세중의 실행 샘플을 아로 실행다른 샘플 사이와 같은 리터.
결과
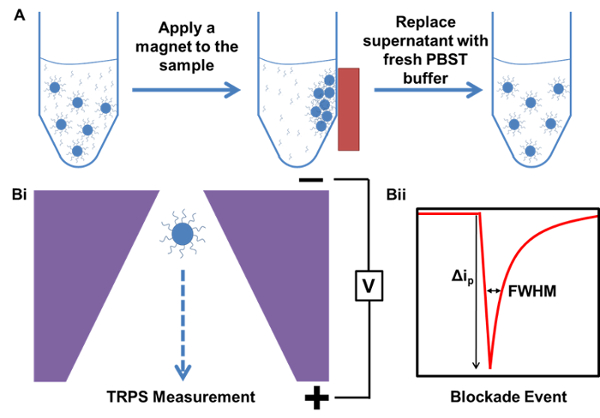
자기 정화 및 TRPS 측정 공정의 도식 표현도. 샘플을 함유하는 과량의 비 결합 캡쳐 프로브 DNA. B)로 시작 샘플 자기 정제) 실시 예는 측정 예를 TRPS I) 입자 일시적인 감소를 일으키는 나노 기공을 통과 II) 봉쇄 이벤트 세공의 입자를 일시적으로 폐색 이온으로부터 제조 ...
토론
제타 전위의 계산 Arjmandi 외. 21 일에 관련된 보정 기반 방법을 사용 하였다. 입자의 전위의 길이가 나노 기공이 규칙적 원추형 구멍의 전체에 걸쳐 평균 전계 입자의 속도를 이용하여,인가 전압의 함수로서 측정된다 이송있다. 전기 영동 이동성 감지 영역 길이의 제곱 L 곱한 전압에 대한 (T는 봉쇄 기간 임) 1 / T의 유도체이다. 감지 영역을 통해 다수의 기준 포인트의 평균...
공개
ELCJB는 Izon 과학 (주)에 의해 지원됩니다
감사의 말
저자는 그들의 지원을 위해 Izon 과학 (주) 감사합니다. 이 연구는 연구 (PCIG11-GA-2012-321836 Nano4Bio)에 대한 유럽위원회 (European Commission)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 ml deionized water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1 x 1012 particles/ml, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2 x 1019 C/nm2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4,352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1 x 1011 particles/ml. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCACTAC GCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGA GGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 100 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
참고문헌
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유