このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
調整可能なナノ細孔を介してナノ粒子の転ベロシティを経由してゼータ電位の決意:例として、DNA修飾された粒子を用いました
要約
ここでは、個々のナノ粒子のゼータ電位を決定するために用いることができる粒子転速度の測定を介してナノ粒子表面化学を特徴づけるために、抵抗パルスセンシング技術に一体化ポリウレタン可変ナノポアを使用します。
要約
抵抗パルスセンサ(RPS)と総称ナノポア技術は、検出、定量化、およびタンパク質分子とナノ粒子を特徴付けるために使用されています。調整可能な抵抗パルスセンシング(TRPS)がリアルタイムに変化させることができる調整可能な細孔を組み込んRPSへの比較的最近の適応です。それらは、DNA濃度および構造の関数として調整可能なポアメンブレンを横切るようにここでは、DNA修飾ナノ粒子の移動時間を監視するためにTRPSを使用する( すなわち 、一本鎖、二本鎖DNAに)。
TRPSは、印加された電界に応じて安定したイオン電流を確立エラストマー細孔膜で分離された2つのAg / AgCl電極、に基づいています。様々な光学ベースの粒子特性評価技術とは異なり、TRPSは、マルチモーダルサンプルを容易に分析することを可能にする、サンプル集団の中で個々の粒子を特徴づけることができます。ここでは、ゼータ電位測定を実証します既知の標準粒子転速度を介して、したがって、それらの分析物のゼータ電位を測定し、その結果、検体転時間をサンプリングするためにこれらを適用します。
同様に、平均ゼータ電位の値を取得するなど、サンプルが全て例えば、サンプル母集団の分布を介して与えられたサンプルについての詳細を示す粒子ごとの粒子の視点を用いて測定されます。そのような中で、この方法は、医療や環境分野の両方のためのセンシングアプリケーション内で可能性を示しています。
概要
官能化ナノ粒子は、両方の医療や環境分野におけるバイオセンサーとしてますます人気が高まっています。 DNAと、ナノ粒子の表面の化学的性質を変化させる能力は、例えば、標的化薬物送達システム1のために有用な証明及びDNAタンパク質相互作用2-4を監視しています。バイオアッセイおよび治療薬の送達に利用されてますます一般的ナノ粒子の宿泊施設には、超常5です。超常磁性粒子(のSPP)は、複雑な混合物から特定の検体を識別し、除去するのに非常に有用であり、単一の磁石の簡単な使用して行うことができます。一旦除去、分析物結合粒子の特徴及び目的に適合して分析することができます。
ナノ粒子の検出および特徴付けのために使用される従来の方法は、そうでなければ、光子相関分光法として知られているような、動的光散乱(DLS)のような光学技術を含みます。ハイテクが、GHスループット技術は、DLSは、平均に基づく技術であることに制限され、専門のソフトウェアを追加することなくマルチモーダルサンプルを分析する場合、より大きな粒子が6,7完全に気づか小さな粒子の一部を残して、はるかに支配的な信号を生成します。粒子によって粒子特性評価技術は、ナノ粒子と、官能化ナノ粒子システムを解析することがはるかに有利です。
RPSベースの技術は、試料に電界を印加し、合成または生物学的ナノポアを通って粒子の輸送機構を監視周りに基づいています。 RPSに基づいて、比較的最近のナノ粒子検出および特性評価技術は、波長可変抵抗パルスセンシング(TRPS)8-16です。 TRPSは、エラストマー、調整可能な細孔膜によって分離された2つの電極システムです。形状17と大きさの範囲の検体は、それらのトランスを介して測定するための調整可能なポア方法が可能に細孔を通してポートメカニズム。調整可能な細孔は、以前に、このような透過電子分光法(TEM)10のような他の技術に匹敵する結果を生成する小さい粒子(70〜95 nmの直径)の検出のために使用されてきました。電界が印加されると、イオン電流が観測された粒子/分子が細孔を通過するように、それらは、一時的に「遮断事象」と定義することができる電流の減少を引き起こし、細孔をブロックします。試料中の各粒子が封鎖振幅、Δに基づいて個別に特徴づけることができるように、それぞれの遮断イベントは、単一粒子の代表であります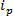 、および全幅半値、FWHM、ならびに他の封鎖特性。 TRPSとしてマルチモーダルサンプルが正常にかつ効果的にアモンのサイズの粒子の範囲を識別することができるために、彼らはナノ細孔を通過する個々の粒子を分析することが有利です単一のサンプルをGST。調整可能な抵抗パルスセンシングは、単一の実行で同時にサイズ10、ゼータ電位12,18と濃度15測定を完了し、したがって、依然として同様のサンプルを区別、そうでない場合は、それらの表面電荷19によって同じサイズすることができます。代替サイジング技術に勝る利点。
、および全幅半値、FWHM、ならびに他の封鎖特性。 TRPSとしてマルチモーダルサンプルが正常にかつ効果的にアモンのサイズの粒子の範囲を識別することができるために、彼らはナノ細孔を通過する個々の粒子を分析することが有利です単一のサンプルをGST。調整可能な抵抗パルスセンシングは、単一の実行で同時にサイズ10、ゼータ電位12,18と濃度15測定を完了し、したがって、依然として同様のサンプルを区別、そうでない場合は、それらの表面電荷19によって同じサイズすることができます。代替サイジング技術に勝る利点。
ゼータ電位は、剪断20の面に静電電位として定義され、そしてそれらは、細孔19を通過するように粒子速度から算出されます。個々の粒子のゼータ電位測定は、このように転座のメカニズムと溶液中のナノ粒子系、応用範囲のためのナノ粒子アッセイ設計の未来のための貴重な情報の挙動への洞察を提供します。このような性質の粒子によって粒子分析はまた、より多くの情報oを可能にする、探求するサンプル集団の中でゼータ電位値の普及と流通を可能にします溶液中のn個の反応速度論(例えば、二本鎖DNAを一本鎖)と粒子安定性が達成されます。
ここでは、非修飾およびDNA修飾両方SPP面を検出し特徴付ける技術が記載されています。本明細書に記載されたプロトコルは、無機および生物学的ナノ粒子の範囲に適用可能であるが、我々はアプリケーションの彼らの広い範囲のためにDNA修飾された表面を使用して手順を示しています。技術は、ユーザは、このように粒子転位細孔系を介して速度およびそれらのゼータ電位に基づいて、ナノ粒子表面上に一本鎖および二本鎖DNA標的を区別することを可能にします。
プロトコル
1.のTween-20(PBST)緩衝液でリン酸緩衝生理食塩水を作ります
- 200ml中に脱イオン水(18.2MΩセンチ)を一度PBS錠(0.01 Mリン酸緩衝液、0.0027 M塩化カリウム、0.137 M塩化ナトリウム、pH7.4)に溶解します。
- 界面活性剤として200ミリリットルの緩衝溶液に100μlの(0.05(v / v)の%)のTween-20を追加します。
2.カルボキシルポリスチレン粒子基準の準備
- 粒子の単分散性を作り出す80ワットで2分間超音波処理の前に30秒間の較正粒子を渦。
- 30秒間PBST緩衝ボルテックスで1×10 10粒子/ mlの濃度に校正粒子100 1を希釈。
3.準備ストレプトアビジン被覆粒子
- 単分散性を確保するため、80ワットで2分間超音波処理の前に30秒間の粒子を渦。
- 交流のPBST緩衝液中に100でストレプトアビジン被覆粒子1を希釈30秒間得1×10 9粒子/ mlの濃度と渦をhieve。
注:典型的なサンプルの容量は200μlです。例えば、調査している場合5 DNA濃度は、希釈したストレプトアビジンでコーティングされた粒子の1ミリリットルを用意します。
オリゴヌクレオチドの4準備
- 100μMの結果の濃度になるように脱イオン水を有するオリゴヌクレオチドを再構成します。
ストレプトアビジン被覆粒子に捕捉プローブ(CP)DNAの5追加
- DNA結合に先立って、渦80ワットで2分間の超音波処理に続いて30秒間、ストレプトアビジンでコーティングされた粒子(200μlのサンプル容量)。
- 供給業者によって提供される結合能力(4,352ピコモル/ mgで)に基づいて、10、20、30、40、47、95、140、および210 nmのDNAの濃度を生じるために粒子にDNAの適切な濃度を加えます。
- 室温で回転ホイール上で10秒と場所のためのサンプルをボルテックス30分には、ストレプトアビジン - ビオチン相互作用を介して粒子表面に結合するDNAを可能にするため。
- キャプチャDNAは、ストレプトアビジンでコーティングされた粒子を添加してインキュベートした後、30分間磁気ラック上にサンプルを置くことにより、磁気分離を介して、溶液中の余分なDNAを除去。
- 磁石に最も近い粒子の新たに形成されたクラスタを乱さないように注意しながら、上清を除去し、新しいPBST緩衝液の同量と交換してください。
前記CP粒子に相補的なDNAにハイブリダイズ
- 到達した最大結合可能な標的を確実にするために(500 nmでの過剰で)標的DNAの必要量を加えます。
- ボルテックス室温で30分間回転ホイール上で10秒と場所のためのサンプル。
- ハイブリダイゼーションが完了すると、30分間磁気ラック上にサンプルを置くことにより、磁気分離を介して過剰の標的DNAを除去。
- 上清を除去、磁石に最も近い粒子の新たに形成されたクラスタを乱し、そして新しいPBST緩衝液の同量と交換しないように注意して。
- 繰り返しは6.1二連のサンプル6.4に段階的に説明し、DNAハイブリダイゼーション時間を調査するために16時間室温で回転ホイール上でこれらのサンプルを配置します。
7. TRPSのセットアップ
- 代わりにソフトウェアを備えたコンピュータシステムに楽器を接続します。
- キャリパーを使用して初期ストレッチを調整します。
- 二つの平行な顎の外側との間の距離を測定します。
- 「機器の設定」タブで「ストレッチ」フィールドにストレッチを入力し、タブの下に「ストレッチをキャリブレーション」をクリックして、ソフトウェアに入力します。
- 横方向に上向きにナノ細孔のID番号を持つ顎に分析するための適切なサイジングのポリウレタンナノ細孔膜にフィット。次に、使用して分析に必要なストレッチに顎を伸ばします楽器側のストレッチ調整ハンドル。 43と48ミリメートルの間に顎を伸ばします。
注意:その校正粒封鎖のサイズは、少なくとも0.3 nAにあるので、ストレッチの正確な値は、印加電圧と一緒に決定されます。ストレッチは既にステップ7.2でソフトウェアに入力され、ジョーが引き伸ばされるように自動的に調整されます。 - 確実に、ナノ細孔の下に、下の流体セルにPBST緩衝液の80μLを置き、測定に影響を与える可能性が存在する気泡はありません。見ての気泡がある場合は、バッファを取り外して交換。
- 所定の位置に上部流体セルをクリックして、そこにバッファ40μlのを置き、再び確保気泡が存在はありません。気泡が上部流体セル内に存在する場合、液体を交換することによってそれらを除去します。
- 再現性のあるベースライン電流は緩衝液で上部流体セルを交換するから到達したときに、「目をクリックすることで、上部流体セルと対策への試料の40μlを添加しますソフトウェア画面上のデータ収集」タブ」の「アート。
注:これは( '解析設定」と「抵抗封鎖」の下で)「Analyseをデータ」タブを介してソフトウェアを使用して変更することができるが、データの取得は、0.05 nAのの封鎖の大きさの下限値と周波数50kHzで完了する。 - 測定上の電気バックグラウンドノイズを低減するために、流体セルシステムの上にファラデーケージを置きます。
- サンプルに圧力または真空を適用するために可変圧力モジュール(VPM)を使用します。
- 外部圧力が上位流体セルにノズルを接続し適用するには、その後、圧力アームを回転させ、(正圧(PRE)または真空(VAC)が適用されるかどうかに応じて)所定の位置にクリックします。
- VPMの上に位置する圧力ステージノブを使用して、「センチ」や「ミリメートル」のスケールに圧力を適用します。 T 'センチ'規模で圧力を適用し、上方向に引っ張ってダウンノブを押しO 'ミリメートル'規模で圧力をかけます。
TRPS解析のための8の準備のサンプル
- 80ワットで2分間30秒、超音波処理のための渦サンプルTRPS分析の前に。
9.ゼータ分析のためのナノ細孔のキャリブレーション
- 上部流体セルに40μlの校正粒子(1×10 10粒子/ ml)を配置した後、3は印加電圧で(セクション7のようにセットアップ)TRPSの測定を完了。 「+」をクリックすることで、電圧を変化させ、 ' - 'ソフトウェアの「機器の設定」タブ内の電圧スケール上のボタン。
- NAは3電圧は約140、110のバックグラウンド電流を返すことを確認し、80。中電圧で校正粒子は少なくとも0.3 nAの平均封鎖の大きさを生成することを確認してください。
- 校正粒子の平均半値全幅(FWHM)の期間は、少なくともあるように圧力を適用します0.15ミリ秒。可変圧力モジュールに取り付けられた圧力アームを使用して手動でこれを行います。それが所望の位置にクリックし、ステップ7.8.2での設定の指示に従って、それに応じて適用するまで、アームを回転させることにより、選択圧(PRE)または真空(VAC)。これらの条件が達成されたら、「データ収集」タブにソフトウェア上の「スタート」をクリックして実行を開始します。
- 少なくとも500個の粒子を測定した(測定時のソフトウェア画面の下部にある「粒子数」を参照)、ランが30秒を超えた場合に「データ収集」タブで「停止」を押すことで実行を完了します(参照 'また、画面の下に向かって実行時間」)。
- 新しいナノ細孔は、ステップ9.1から9.4を完了することによって導入されるか、または分析の各新しい一日のためにされるたびに説明したように、キャリブレーションの実行を完了することによって、システムのキャリブレーションを行います。
10.サンプルの実行
- 最高でサンプルを実行しますか、同様の(±10 NA)を確保することで、キャリブレーションサンプルとしての第2の最大電圧、そうでない場合と同じ、ベースラインの電流。
- 適切なベースライン電流が達成されると、サンプルの40μlの上部流体セル内の電解液を交換してください。試料が導入されると、封鎖は、信号トレースに見られるであろう。 「ファイル名を指定して実行を参照してください(「データ収集」タブで「開始」および500個の粒子の最小値を記録(信号トレースの下に位置する「粒子数」を確認してください)と実行時間を確保クリックして実行したサンプルは、30秒の最小値です開始また、信号トレースの下に位置する時間 ')。
- 測定を完了するためには、「データ収集タブ」で「停止」をクリックして、データファイルを保存します。
- ファイル、次の形式で入力ファイル情報を保存するには、 「調査」は、ファイルが保存されるフォルダで、「ナノポアID」は、使用されている細孔のシリアル番号である「パーツ# 'Iそれはキャリブレーションやサンプル測定であるかどうかを「キャリブレーションまたはサンプル」の詳細、気孔のタイプ( すなわち 、NP150 / NP200)、「サンプルID」は、サンプルの名前です。■サンプルを希釈した場合、「希釈は'(使用されています(cm単位でサンプルを100倍に希釈した場合は100を入力し)、「圧力」は、サンプルに加えられた圧力である - セクション7.8を参照)、「電解IDが ''バッファサンプルがで構成されているの名前であり、注意事項は、「サンプルまたは実行に関する個人的なメモです。
- 各サンプル実行の間に、上部流体セルに数回PBST緩衝液の40μLを配置し、様々な圧力を適用することによって、システムを洗浄(通常、-10 -5センチ(真空)、および5〜10センチ(正圧))までこれ以上の封鎖イベントがシステム内に残っていない残留粒子とサンプル間のためノークロスコンタミネーションがない確実に、存在しています。 WELとして実行する各繰り返し試料の間に完成し、この洗浄工程を三連で実行したサンプル異なるサンプル間としてリットル。
結果
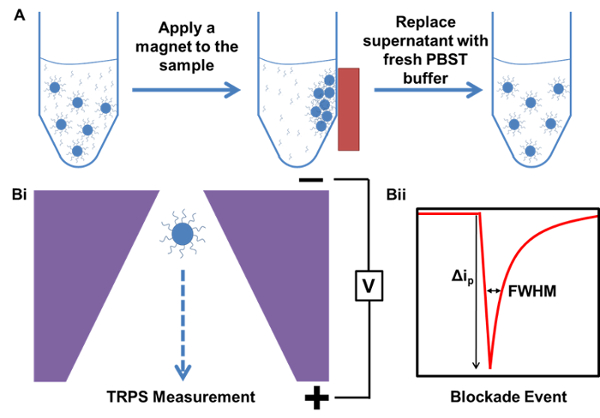
磁気精製およびTRPS測定の方法の 1 模式図を 図 。 A)過剰な、未結合の捕捉プローブDNAを含む試料で開始サンプルの磁気精製の例。B)TRPS測定例をi)は、粒子がナノポアを通過すると、ii)粒子から製造遮断イベントが一時的に一時的な低下...
ディスカッション
ゼータ電位の計算はArjmandi らが仕事に関連するキャリブレーションに基づく方法を使用する。21。それらはナノ細孔を横切るように、粒子の移動の持続時間は、通常、円錐形細孔の全体にわたる平均電界及び粒子速度を使用し、印加電圧の関数として測定されます。電気泳動移動度は、検知ゾーンの長さの二乗、Lを乗じた電圧に対して1 / Tの誘導体(Tは遮断?...
開示事項
ELCJBはIZONサイエンス社によってサポートされています
謝辞
著者は彼らのサポートのためにIZONサイエンス株式会社に感謝します。仕事は研究(PCIG11-GA-2012から321836 Nano4Bio)のために欧州委員会によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 ml deionized water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1 x 1012 particles/ml, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2 x 1019 C/nm2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4,352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1 x 1011 particles/ml. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCACTAC GCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGA GGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 100 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
参考文献
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved