Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение дзета-потенциала через наночастицу транслокации через скоростей перестраиваемого нанопор: Использование ДНК-модифицированных частиц, как в примере
В этой статье
Резюме
Здесь мы используем полиуретановые перестраиваемого нанопор интегрированный в резистивном метод импульсного зондирования для характеристики наночастиц химию поверхности с помощью измерения скоростей транслокации частиц, которые могут быть использованы для определения дзета-потенциала отдельных наночастиц.
Аннотация
Нанопор технологии, известные под общим названием резистивные датчики импульсов (RPS), используются для обнаружения, количественного определения и характеристики белков, молекул и наночастиц. Настраиваемый резистивный импульса зондирования (TRPS) является относительно недавним адаптации к ПСТ, который включает в себя перестраиваемый поры, который может быть изменен в режиме реального времени. Здесь мы используем TRPS для контроля времени транслокации наночастиц ДНК-модифицированного , как они проходят перестраиваемый пор мембраны в зависимости от концентрации и структуры ДНК (то есть, одноцепочечную к двухцепочечной ДНК).
TRPS основана на двух электродов Ag / AgCl, разделенных эластомерного порами мембраны, устанавливающей стабильный ионный ток при приложенного электрического поля. В отличие от различных оптических технологий на основе определения свойств частиц, TRPS могут характеризовать отдельные частицы среди выборочной совокупности, что позволяет мультимодальные образцы для анализа с легкостью. Здесь мы покажем, дзета-потенциал измеренияс помощью транслокации частиц скоростей известных стандартов и применить их к образцу аналитов раз транслокация, таким образом, в результате чего измерения дзета-потенциала этих аналитов.
А также приобретение средних значений дзета-потенциал, образцы все измеряют с помощью частиц по-частицы перспективу, проявляющего больше информации о данном образце посредством распределения выборки населения, например. Из таких, этот метод демонстрирует потенциал внутри приложений зондирования для медицинских и экологических областях.
Введение
Функционализированные наночастицы становятся все более популярными в качестве биосенсоров в медицинских и экологических областях. Способность изменять химию поверхности наночастицу, в ДНК, например, оказывается полезным для целевых систем доставки лекарственных средств 1 и мониторинга ДНК-белковых взаимодействий 2-4. Все более и более общее свойство наночастиц быть использованы в биопроб и в доставке терапевтических средств является Суперпарамагнетизм 5. Суперпарамагнитных частиц (SppS) являются чрезвычайно полезными для выявления и устранения конкретных аналитов из сложных смесей и может сделать это с помощью простого использования одного магнита. После удаления, анализируемые переплете частицы могут быть охарактеризованы и проанализированы соответствует своему назначению.
Предыдущие методы, используемые для обнаружения и определения характеристик наночастиц включают в себя оптические методы, такие как динамического рассеяния света (DLS), иначе известный как фотонной корреляционной спектроскопии. Несмотря на то, приветГ.Х. техника пропускная способность , СДО ограничивается будучи метод на основе усреднения и при анализе мультимодальные образцов без добавления специализированного программного обеспечения, более крупные частицы будут производить гораздо более доминирующего сигнала, в результате чего некоторые из более мелких частиц , совершенно незаметно 6,7. Частица за частицей методы определения характеристик, следовательно, гораздо более благоприятными для анализа наночастиц и функционализованных систем наночастиц.
технологии, основанные RPS основаны вокруг приложения электрического поля к образцу и мониторинга транспортного механизма частиц через синтетического или биологического нанопоры. Относительно недавно обнаружения наночастиц и характеристика методика , основанная на RPS перестраивалось резистивный импульса зондирования (TRPS) 8-16. TRPS представляет собой систему из двух электродов, разделенных эластомерного перестраиваемые пор мембраны. Метод перестраиваемый пор позволяет аналитов диапазона формы 17 и размера , чтобы измерить с помощью их трансмеханизмы портов через поры. Перестраиваемые поры использовались ранее для выявления мелких частиц (70-95 нм в диаметре) , производящее сопоставимые результаты с другими методами , например, трансмиссионной электронной спектроскопии (ПЭМ) 10. При приложении электрического поля, наблюдается ионный ток и, как частицы / молекулы проходят через поры, они временно блокировать поры, что вызывает уменьшение тока, который может быть определен как '' блокада события ». Каждое событие блокада является представителем одной частицы таким образом , что каждая частица в образце можно охарактеризовать по отдельности на основании величины блокаде, А 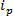 , А полная ширина полувысоте, FWHM, а также другие свойства блокады. Анализируя отдельные частицы, поскольку они проходят через нанопоры выгодно для мультимодальных образцов, как TRPS может успешно и эффективно различать диапазон частиц размером АмонGST одного образца. Настраиваемый чувствительный резистивный импульс завершается размер 10, дзета - потенциал 12,18 и концентрации 15 измерений одновременно в один проход , и поэтому все еще может дифференцировать образцы аналогичных, если не тот же размер , их поверхностным зарядом 19; преимущество по сравнению с альтернативными методами проклейки.
, А полная ширина полувысоте, FWHM, а также другие свойства блокады. Анализируя отдельные частицы, поскольку они проходят через нанопоры выгодно для мультимодальных образцов, как TRPS может успешно и эффективно различать диапазон частиц размером АмонGST одного образца. Настраиваемый чувствительный резистивный импульс завершается размер 10, дзета - потенциал 12,18 и концентрации 15 измерений одновременно в один проход , и поэтому все еще может дифференцировать образцы аналогичных, если не тот же размер , их поверхностным зарядом 19; преимущество по сравнению с альтернативными методами проклейки.
Дзета - потенциал определяется как электростатический потенциал в плоскости сдвига 20, и вычисляется из скоростей частиц , когда они проходят поры 19. Дзета-потенциал измерения отдельных частиц, таким образом, дает понимание механизмов транслокации и поведения систем наночастиц в растворе, ценную информацию для будущего анализа наночастиц конструкций для целого ряда применений. Частица за частицей анализ такой природы позволяет также распространение и распределение дзета-потенциала ценностей среди населения выборки, чтобы изучить, что позволяет получить дополнительную информацию OКинетика реакции N (Однонитевый с двухцепочечной ДНК, например) и стабиль- частиц в растворе, который необходимо достичь.
Здесь мы описываем технику, которая обнаруживает и характеризует как немодифицированные и ДНК-модифицированных поверхностей SPP. Протокол, описанный в настоящем документе, относится к ряду неорганических и биологических наночастиц, но мы продемонстрировать процедуру с использованием ДНК-модифицированных поверхностей из-за их широкого круга применений. Методика позволяет пользователю различать мишени одноцепочечных и двухцепочечной ДНК на поверхности наночастиц, основанный на скорости транслокации частицы через систему пор и таким образом их дзета-потенциалы.
протокол
1. Создание фосфатно-солевом буферном с Tween-20 (PBST), буфер
- Растворите PBS таблетку (0,01 М фосфатный буфер, 0,0027 М хлорид калия, 0,137 М хлорида натрия, рН 7,4) в 200 мл деионизированной воды (18,2 МОм).
- Добавляют 100 мкл (0,05 (об / об)%) Tween-20 до 200 мл буферного раствора в качестве поверхностно-активного вещества.
2. Подготовка карбоксильной Полистирол Стандарты Particle
- Vortex калибровочные частицы в течение 30 секунд перед обработкой ультразвуком в течение 2 мин при 80 Вт, чтобы создать монодисперсность частиц.
- Развести калибровка частиц 1 в 100 до концентрации 1x10 10 частиц / мл в буфере PBST и вихре в течение 30 сек.
3. Подготовка покрытых стрептавидином частицы
- Вихре частицы в течение 30 сек до обработки ультразвуком в течение 2 мин при 80 Вт для обеспечения монодисперсность.
- Развести стрептавидина частицы 1 в 100 в буфере PBST к сети переменногоhieve результирующую концентрацию 1х10 9 частиц / мл и вихрь в течение 30 сек.
Примечание: Типичный объем образца составляет 200 мкл. Например, если исследовать пять концентрации ДНК готовят 1 мл разведенной частиц, покрытых стрептавидином.
4. Подготовка Олигонуклеотиды
- Развести олигонуклеотиды с деионизированной водой до результирующей концентрации 100 мкМ.
5. Добавление захвата зонда (CP) ДНК с покрытыми стрептавидином частиц
- До связывания ДНК, воронка стрептавидина частиц (200 мкл объем пробы) в течение 30 секунд, а затем 2 мин при обработке ультразвуком в 80 Вт.
- На основании связывающей способности, предоставленной поставщиком (4352 пмоль / мг), добавьте соответствующую концентрацию ДНК частиц для полученных концентраций 10, 20, 30, 40, 47, 95, 140 и 210 ДНК нМ.
- Vortex образцы в течение 10 сек и место на роторном колесе при комнатной температурев течение 30 мин, чтобы позволить ДНК связываться с поверхностью частиц посредством взаимодействия стрептавидин-биотин.
- После того, как была добавлена ДНК захвата и инкубировали с частицами, покрытых стрептавидином, удалить избыток ДНК в растворе с помощью магнитной сепарации путем размещения образцов на магнитную стойку в течение 30 мин.
- Удалить супернатант, следя за тем, чтобы не нарушить новообразованный кластер частиц, наиболее близких к магниту, и заменить с тем же объемом новой порцией буфера PBST.
6. гибридизации комплементарных ДНК для СР-частиц
- Добавьте необходимое количество ДНК-мишени (более при 500 нм), чтобы обеспечить максимально возможную мишень-связывающем была достигнута.
- Вихревой образцы в течение 10 сек и место на вращающемся колесе при комнатной температуре в течение 30 мин.
- После того, как гибридизация завершена, удалить избыток ДНК-мишени с помощью магнитной сепарации путем размещения образцов на магнитную стойку в течение 30 мин.
- Удалить супернатантТак, чтобы не мешать новообразованной скопление частиц, наиболее близких к магниту, и заменить с тем же объемом новой порцией буфера PBST.
- Повторите шаги 6.1 до 6.4 для двух повторностей и поместить эти образцы на роторном колесе при комнатной температуре в течение 16 часов, чтобы исследовать раз ДНК-гибридизации.
Установка 7. TRPS
- Подключите прибор в компьютерную систему с программным обеспечением на месте.
- Калибровка начального растяжения с помощью циркуля.
- Измерьте расстояние между наружной двумя параллельными губками.
- Ввод в программное обеспечение, введя растяжение в поле "растягиваться" на вкладке "Настройки инструмента" и нажав "Калибруйте растягиваться" под вкладкой.
- Сбоку соответствовать полиуретановый нанопор мембраны соответствующего размера для анализа на челюсти с нанопор идентификационный номер вверх. Затем растянуть челюсти на участке, необходимого для анализа с помощьюстрейч регулировка ручки на боковой панели прибора. Stretch челюсти от 43 до 48 мм.
Примечание: Точное значение перегоне определяется наряду с приложенным напряжением, так что блокад калибровки частиц по меньшей мере, 0,3 нА в размере. Отрезок уже вводится в программу на этапе 7.2 и автоматически отрегулирует как челюсти вытянуты. - Поместите 80 мкл буфера PBST в камере ниже жидкости, под нанопор, обеспечивая нет настоящего пузыри, которые могут повлиять на точность измерения. Если есть пузырьки видно, удалить и заменить буфер.
- Нажмите на верхнюю ячейку жидкости на место и поместите 40 мкл буфера в него, снова обеспечивая нет пузырьков присутствуют. Если имеются пузырьки в верхней камере жидкости, удалите их путем замены жидкости.
- Когда воспроизводимый базовый ток был достигнут от замены верхней ячейки жидкости с буфером, добавляют 40 мкл образца к верхней ячейке жидкости и измерения, нажав кнопку "улискусство 'в закладке' Сбор данных 'на экране программного обеспечения.
Примечание: Сбор данных завершается при частоте 50 кГц с блокадой величина нижнего предела 0,05 нА, хотя это может быть изменено с помощью программного обеспечения с помощью вкладки "Проанализировать Data '(в разделе' Настройки Analysis 'и' резистивный блокад ') , - Поместите клетку Фарадея поверх клеточной системы для текучей среды для уменьшения электрического фонового шума на измерения.
- Используйте модуль переменного давления (VPM) для применения давления или вакуума к образцам.
- Чтобы применить внешнее давление, подключите сопло к верхней ячейке жидкости, а затем поверните рычаг давления и нажмите на место (в зависимости от того, будет ли применяться положительное давление (PRE) или вакуум (VAC)).
- Подайте давление в "см" или "мм" шкалы с помощью ручки ступени давления, расположенный на верхней части ВПМ. Нажмите ручку вниз, чтобы оказать давление на шкале "см" и потяните его вверх тO оказать давление на шкале "мм".
8. Подготовка Образцы для анализа TRPS
- Образцы вортексе в течение 30 сек и разрушать ультразвуком в течение 2 мин при 80 Вт до анализа TRPS.
9. Калибровка нанопор для анализа Зета
- После размещения 40 мкл калибровочных частиц (1x10 10 частиц / мл) в верхнюю ячейку жидкости, выполнить измерение TRPS (установка , как и в разделе 7) при 3 приложенных напряжений. Alter напряжение, нажав на кнопку "+" и "-" кнопки на шкале напряжения на вкладке "Настройки инструмента" на программном обеспечении.
- Проверьте, что 3 напряжения возвращают фоновые токи около 140, 110 и 80 нА. Убедитесь в том, что при среднем напряжении калибровочные частицы создают среднюю величину блокады, по меньшей мере, 0,3 нА.
- Примените давление таким образом, средняя максимальная полная ширина половины (FWHM) длительности калибровки частиц по меньшей мере,0,15 мс. Делайте это вручную с помощью рычага давления, прикрепленную к модулю переменного давления. Выбор давления (PRE) или вакуум (VAC), повернув рычаг до щелчка в нужном положении и применяются соответственно следующие настройки инструкции на этапе 7.8.2. После того, как эти условия были достигнуты, запустить прогон, нажав кнопку «Пуск» на программном обеспечении на вкладке "Сбор данных".
- Выполните прогон, нажав "стоп" на вкладке "Сбор данных", когда по меньшей мере, 500 частиц были измерены (см 'количество частиц "в нижней части экрана программного обеспечения во время измерения) и пробег превысил 30 сек (см' Run Time 'также к нижней части экрана).
- Калибровка системы путем заполнения калибровочного процесса, как описано каждый раз, когда новый нанопор вводится или для каждого нового дня анализа, выполнив шаг 9.1-9.4.
10. Запуск образца
- Запуск образцов на самом высоком иливторое самое высокое напряжение в качестве калибровочных образцов при обеспечении аналогичной (± 10 нА), если не то же самое, базовый ток.
- После того, как соответствующий базовый ток достигается, заменить электролит в верхней камере жидкости с 40 мкл образца. Когда образец вводится, блокад будет видно на трассе сигнала. Запустить пример запуска, нажав кнопку "Пуск" на вкладке "Сбор данных" и записать минимум 500 частиц (проверить 'количество частиц', расположенный под след сигнала) и обеспечивает время работы составляет минимум 30 секунд (см 'Run Время 'также расположена ниже сигнальной дорожки).
- Для завершения измерения нажмите кнопку "стоп" в "закладке Сбор данных" и сохраните файл данных.
- Чтобы сохранить файл, ввод сведений о файле в следующем формате; "Исследование" папка-файл будет сохранен в 'нанопористых ID' это порядковый номер поры используется I, 'Part #'S тип поры (т.е. NP150 / NP200), 'образец ID' это имя образца, "Калибровка или образец 'детали , является ли это калибровка или образец для измерения," разбавление "используется , если проба была разбавлена ( тип 100, если образец разводили в 100 раз), «давление» равно приложенное давление на образец (в см - см раздел 7.8), 'Электролит ID' это имя буфера образца состоит в, и ' Примечания "являются любые личные заметки о образце или бега.
- Между каждым образцом перспективе, промывать систему не помещая 40 мкл PBST буфера в верхней камере жидкости в несколько раз, и применяя различные давления (как правило, при температуре от -10, -5 см (вакуум), а также 5 и 10 см (положительное давление)) до тех пор, больше нет блокады событий присутствуют, обеспечивая нет остаточные частицы, остающиеся в системе и, следовательно, нет перекрестного загрязнения между образцами. Запуск образцов в трех экземплярах с этой стадии промывки между завершенного каждого образца повторного запуска, как вэйл, как между различными образцами.
Результаты
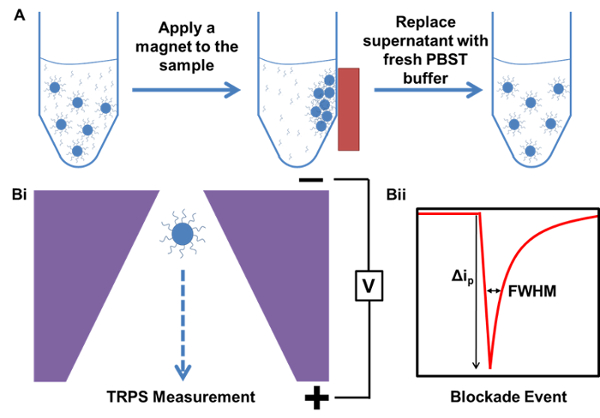
Рисунок 1. Схематическое изображение процессов магнитной очистки и измерения TRPS. А) Пример магнитной очистки образца , начиная с образцом , содержащим избыток, несвязанный ДНК захвата зонда. B) TRPS из?...
Обсуждение
Расчет для дзета - потенциал был использован метод , основанный калибровки связано с работой по Arjmandi и др. 21. Продолжительность транслокацию частиц при их прохода по нанопор измеряется в зависимости от приложенного напряжения, используя среднее электрическое поле и части...
Раскрытие информации
ELCJB поддерживается Izon Science Ltd.
Благодарности
Авторы благодарят Izon Science Ltd за их поддержку. Работа выполнена при финансовой поддержке Европейской комиссии по научным исследованиям (PCIG11-GA-2012-321836 Nano4Bio).
Материалы
| Name | Company | Catalog Number | Comments |
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 ml deionized water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1 x 1012 particles/ml, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2 x 1019 C/nm2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4,352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1 x 1011 particles/ml. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCACTAC GCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilized powders reconstituted to 100 µM using deionized water, and diluted as required. Sequences of DNA targets: Fully complementary - 5'GCCACGCGTAGTGA GGTTTAACCAT3', Middle binding - 5'GTAGTGAGGT3', End binding - 5'GTTTAACCAT3', Partially complementary overhanging - 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 100 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
Ссылки
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены