A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس صلابة من
In This Article
Summary
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Abstract
تشنج الشرايين هو عامل خطر كبير والعلامات البيولوجية لمرض القلب والأوعية الدموية والسمة المميزة للشيخوخة. مجهر القوة الذرية (AFM) هو أداة تحليلية متعددة لوصف الخواص الميكانيكية اللزجة لمجموعة متنوعة من المواد تتراوح ما بين الصلب (البلاستيك والزجاج والمعادن، الخ) السطوح إلى خلايا في أي الركيزة. وقد استخدم على نطاق واسع لقياس صلابة من الخلايا، ولكنها أقل استخداما لقياس صلابة من aortas. في هذه الورقة، فإننا سوف تصف إجراءات استخدام AFM في وضع الاتصال لقياس خارج الجسم الحي معامل مرونة الشرايين الماوس المفرغة. وصفنا إجراءاتنا لعزل aortas الماوس، ثم تقديم معلومات مفصلة لتحليل فؤاد. وهذا يشمل إرشادات خطوة بخطوة لمحاذاة شعاع الليزر، معايرة ثابت الربيع وحساسية انحراف لجنة التحقيق AFM، والحصول على منحنيات القوة. ونحن نقدم أيضا بروتوكول مفصلة لanaly البياناتجهاز الأمن والمخابرات من منحنيات القوة.
Introduction
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد وافق العمل حيوان في هذه الدراسة من قبل لجان رعاية واستخدام الحيوان المؤسسي من جامعة ولاية بنسلفانيا. نفذت الطرق وفقا للمبادئ التوجيهية المعتمدة.
1. إعداد الماوس وعزل الشريان الأورطي
- تخدير ماوس مع الكيتامين (80-100 ملغ / كلغ)، زيلازين (8-10 ملغ / كلغ) وآسيبرومازين (1-2 ملغ / كلغ) البريتونى. تأكيد التخدير مع اختبار قرصة الذيل. مرة واحدة يتم تخدير الماوس بشكل كامل، الموت ببطء الماوس عن طريق خلع عنق الرحم.
- ضع الماوس على ظهرها ويعلقون الماوس إلى لوحة تشريح. تنظيف منطقة البطن مع 70٪ (ت / ت) مناديل الايثانول.
- قرصة الجلد في خط منتصف وجعل شق الأولي صغير مع مقص المجهرية متوسطة الحجم في البطن. في حين الضغط على الجلد بالملقط، استخدم مقص المجهرية متوسطة الحجم لقطع الجلد والغشاء البريتوني من البطن إلى القص.
- قطع الأضلاع على بالجانبين أوراسكوم تليكوم القابضة مع مقص المجهرية متوسطة الحجم. إزالة بعناية الرئتين والكبد مع مقص المجهرية صغيرة الحجم، وترك القلب والشريان الأورطي. نقل الماوس ولوحة تشريح لمجهر تشريح.
- فهم الدهون المحيطة الشريان الأورطي مع ملقط صغير واستخدام مقص صغير لقطع بعناية بعيدا الدهون حول الشريان الأورطي.
- انتزاع بلطف الشريان الأورطي مع ملقط، وجعل واحد قطع مع مقص المجهرية صغيرة الحجم في بداية الأبهر الصاعد وخفض آخر في نهاية الشريان الأورطي النازل، وذلك فوق الشريان الأورطي البطني.
- نقل الشريان الأورطي تشريح على طبق 60 ملم تحتوي على 1X الفوسفات مخزنة المالحة (PBS، وبدون الكالسيوم والمغنيسيوم).
- مواصلة لتشريح بعيدا أي نوع من الأنسجة الدهنية المتبقية من الشريان الأورطي باستخدام مقص صغيرة مجهرية الحجم. استخدام مقص صغير لفتح الشريان الأورطي طوليا.
- استخدام صغيرة مقص المجهرية الحجم لقطع قطعة صغيرة (~ 2 × 4 مم) من الشريان الأورطي النازل وaortiج القوس لتحليل AFM (الشكل 1). وضع الأنسجة في طبق من البلاستيك 60 ملم وإبقائها رطبة في قطرة من برنامج تلفزيوني.
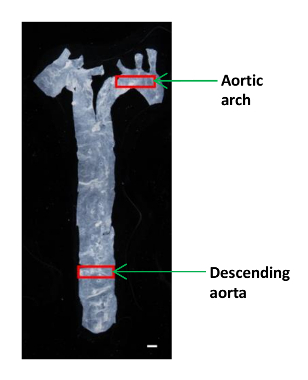
الشكل 1: صورة توضح الموقع من قطاعات مختلفة الأبهري في ماوس تم عزل الشريان الأورطي من القلب إلى الحجاب الحاجز، وكانت تستخدم جزء صغير من الشريان الأورطي النازل وقوس الأبهر لتحديد الرجوعية المرنة. شريط الحجم، 1 مم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. إعداد عينات الأنسجة لقياسات AFM
- بعناية إزالة PBS باستخدام مختبر مسح دون لمس الشريان الأورطي. تكون على يقين من أن الجانب اللمعية من الأنسجة يكون مواجها لها.
- الغراء بلطف نهاية كل من الشريان الأورطي فتح لوحة من قبل الإضافة جي 5-10 ميكرولتر من مادة لاصقة cyanoacrylate مع طرف جل التحميل (الشكل 2).
ملاحظة: يجب أن تحدد كمية من الغراء اللازم لنعلق بحزم الأنسجة في نهاية كل تجريبيا. ومن الأهمية بمكان أن الشريان الأورطي لا امتدت خلال هذه العملية. - تحقق الشريان الأورطي لاصق للتأكد من أنه ليس مطوية أو العائمة. بعد تجفيف الهواء الغراء على الشريان الأبهر (30-60 ثانية)، إضافة بلطف برنامج تلفزيوني وغمر العينة.
ملاحظة: إعداد وAFM (الخطوات 3-5) يمكن القيام بها أثناء إعداد الأنسجة لتحليلها.

الشكل 2: كارتون من شريحة الأبهر لصقها على ثقافة صحن 60 مم باستخدام Cyanoacrylate لاصق يتم تطبيقها لاصقة cyanoacrylate إلى حافة عينة الأورطي استعدادا لقياسات AFM.كوم / ملفات / ftp_upload / 54630 / 54630fig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تحميل والتحقيق
- جبل حامل التحقيق السوائل على موقف الحمل التحقيق.
- باستخدام الملقط، مرر نيتريد السيليكون AFM التحقيق (0.06 N / م ناتئ) مع طرف كروية (لقد استخدمت قطر 1-ميكرون شافي 2 الجسيمات ولكن يمكن استخدام أحجام أكبر أيضا) على حامل التحقيق. تأكد من أن لجنة التحقيق AFM بشدة أمنت لصاحب التحقيق.
- حرك حامل التحقيق على Z-الماسح الضوئي جبل الرأس AFM، والتأكد من أن حامل المسبار بإحكام.
4. محاذاة الليزر على التحقيق
- فتح البرنامج AFM. اختر نوع التجربة على البرنامج؛ تجربة الفئة في الاتصال واسطة، وتجربة المجموعة إلى الاتصال الوضع في السوائل وتجربة في الاتصال الوضع في السائل. انقر فوق تحميل إكسبeriment في البرنامج؛ سوف يتحول على الليزر.
- إضافة 3 مل من الماء المقطر إلى 50 ملم طبق أسفل الزجاج ووضع الطبق على مرحلة وحدة محاذاة الليزر. هذه الوحدة يبسط عملية تركيز شعاع الليزر على الجزء الخلفي من ناتئ.
- جبل رئيس فؤاد في وضع رأسي على وحدة محاذاة الليزر والطاقة على وحدة ليزر محاذاة. إضافة حوالي 50 ميكرولتر من الماء المقطر لتشكيل قطرات على الطرف فؤاد.
- باستخدام عصا التحكم، وانخفاض رئيس AFM ذلك الطرف فؤاد يجعل الاتصال مع الماء في الطبق. إذا لم يتم الاتصال بين طرف فؤاد والماء في طبق، ورفع بلطف الطبق حتى يتم الاتصال. ضبط التركيز والسطوع وموقف XY ذلك الطرف فؤاد في عرض على شاشة LCD وحدة المحاذاة.
- ضع بقعة الليزر على طرف لجنة التحقيق AFM عن طريق ضبط المقابض المواقع ليزر للرئيس فؤاد. استخدام المقابض للكشف عن المواقع على رأسه فؤاد، وضبط طرحويتم الحصول على أيون من الثنائي الضوئي حتى القيم بين 0 و -1 الخامس للانحراف الرأسي ويتم الحصول عليها ~ 0 V للانحراف الأفقي.
- تحقق للتأكد من يتم تكبير إشارة مبلغ الليزر. إذا لزم الأمر، كرر الخطوة 4.5 لإعادة ضبط الموقف من شعاع الليزر على الطرف فؤاد وموقف الضوئي للحصول على أقصى قدر من إشارة المبلغ.
ملاحظة: قد يكون من الضروري إعادة التحقيق AFM على حامل مسبار للحصول على أقصى إشارة مبلغ حتى لو تكرر الخطوة 4.5.
5. معايرة انحراف الحساسية والربيع ثابت من AFM التحقيق
- جعل الصفر على طبق ثقافة 60 ملم مع forcep وملء الطبق مع الماء المقطر. مكان الطبق الثقافة على لوحة صاحب العينة. في هذه الحالة، تركيب الطبق على XY بمحركات مرحلة المسح الضوئي للمجهر مقلوب.
- وضع حامل لوحة المغناطيسي على الجزء العلوي من لوحة لإبقائها آمنة أثناء التصوير.
- انقر الأسهم 'حتى' في القائمة الإنتقال على برنامج لتحريك رأسه فؤاد تصل إلى ما يقرب من أعلى موقفها لضمان تحقيق AFM لن تلمس طبق.
ملاحظة: هذه الخطوة مهمة جدا لأنها تتجنب كسر الطرف فؤاد. - وضع رئيس فؤاد على المسرح المجهر.
- استخدام المجهر التركيز على نقطة الصفر على لوحة. استخدم عصا التحكم، أو انقر فوق السهم "داون" في القائمة ملاحة، لببطء وبعناية خفض التحقيق AFM في برنامج تلفزيوني. موقف رئيس أعلى قليلا من الصفر في اللوحة.
ملاحظة: إذا كان الموقف المبدئي للرئيس فؤاد أقرب إلى العينة، وهي المرة الانخراط ستنخفض بشكل كبير. - قبل الدخول، وإعادة ضبط الموقف من شعاع الليزر على الطرف فؤاد وموقف الضوئي للحصول على أقصى قدر من إشارة SUM عند الضرورة.
- اختر نوع طرف بالنقر على تغيير التحقيق في القائمة الإعداد.
- انقر فوق التحقق من معلمات وتعيين المعلمات: مسح الحجم إلى 0، معدل المسح إلى 1 هرتز، عينة / خط 256 وانحراف SETPOINT إلى 20 نانومتر. انقر الانخراط. ستبقى نافذة الحالة الانخراط مفتوح حتى تحقيق يجعل الاتصال مع سطح اللوحة. بعد إشراك التحقيق، انقر فوق التعلية.
- انقر فوق الموسع الوضع في القائمة مسح شريط أدوات وتعيين المعلمات: التعلية الحجم الى ما بين 500 نانومتر و 1 ميكرون، تعلية السعر في 2 هرتز، عدد العينات إلى 256، نصيحة نصف قطرها إلى 500 نانومتر، ونسبة عينة بواسون إلى 0.5 (تفترض المواد غير أن تقاس ينضغط تماما)، نصيحة نصف زاوية إلى 0، وضع الزناد إلى عتبة النسبية والزناد إلى ما بين 20 و 100 نانومتر.
- انقر المنحدر المستمر في القائمة تعلية شريط الأدوات لobtaفي منحنى القوة على لوحة (الشكل 3A). في هذا المنحنى قوة، تعيين القناة 1 إلى خطأ انحراف.
ملاحظة: سيسمح هذا البرنامج لرسم بياني النتائج على النحو انحراف العمودي مقابل موقف ض.- انقر في نهايات اليسار أو اليمين من منحنى القوة واسحب المؤشر لتشمل المنطقة خطية من منحنى القوة (الشكل 3A، متقطع الخطوط الحمراء). استخدام هذين الخطين للاحتفال حدود المنطقة منحدر أن يكون لائقا مع خط مستقيم.
- اختر التعلية في شريط الأدوات ثم انقر فوق تحديث الحساسية. تسجيل القيمة وكرر هذه الخطوة أربع مرات أكثر. اختر معايرة في شريط الأدوات ثم انقر الكاشف. مساهمة قيمة متوسط من القياسات خمسة في مربع انحراف الحساسية.
- انقر سحب 2-3 مرات لرفع رأسه فؤاد. هذه الخطوة مهمة لمنعالتفاعل بين طرف فؤاد ولوحة أثناء عملية ضبط الحرارية. انقر اللحن الحرارية في شريط الأدوات.
- تعيين الحراري المدى اللحن من 1-100 كيلو هرتز (يمكن الحصول على هذه المعلومات من كتالوج الشركة المصنعة) وانحراف الحساسية تصحيح إلى 1،144 لالكابولي على شكل حرف V و1،106 لالكابولي مستطيلة.
- في القائمة اللحن الحرارية، انقر فوق الحصول على البيانات للحصول على منحنى لحن الحراري (الشكل 3B). باستخدام برنامج AFM، تحطمت مكان خطوط حمراء على أي من جانبي منحنى (كما هو موضح في الشكل 3B) عن طريق سحب الماوس في من على حافة الرسم البياني لتحديد حدود للتركيب. حدد إما Lorentzian (الهواء) أو نموذج بسيط المذبذب متناسق (السائل) اعتمادا على أفضل يناسب البيانات.
- انقر صالح البيانات، ثم احسب الربيع K وحفظ هذه القيمة. إعادة الجفت ربيع المعايرة المستمرة عدة مرات، واستخدام متوسط قيمة. انقر سحب عدة مرات.
- إزالة الرأس AFM من مرحلة المجهر ووضعه على وحدة المحاذاة. إزالة طبق من المرحلة المجهر.
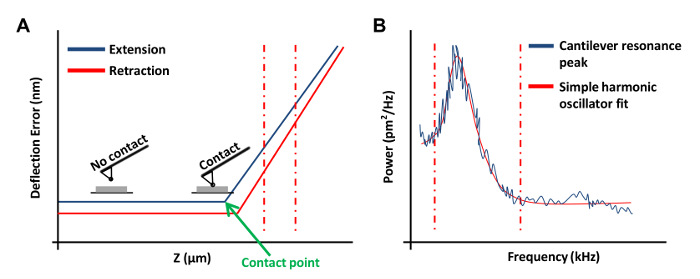
الشكل 3: منحنيات القوة AFM المستخدمة في معايرة AFM تحقيقات. (أ) منحنى القوة AFM التمثيلي (منحنى المعايرة). الجزء تمديد منحنى القوة بين الأحمر العمودي متقطع تم استخدام خطوط لتحديد حساسية ناتئ انحراف. (ب) بسيطة مذبذب التوافقي مناسبا الرسم البياني المستخدمة لحساب ثابت ربيع ناتئ كما هو موضح سابقا (20). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الحمار = "jove_title"> 6. قياس مرونة معامل على الشرايين الفأر فيفو السابقين
- ضع صحن الثقافة 60 ملم تحتوي على أنسجة الأبهري على المسرح المجهر، وتأمين لوحة مع حامل لوحة المغناطيسي.
- وضع رئيس فؤاد على المسرح المجهر. تأكد من أن لجنة التحقيق AFM لا يجعل الاتصال مع الشريان الأورطي ولكن بلطف يجعل الاتصال مع برنامج تلفزيوني، وتشكل الغضروف المفصلي. إذا لزم الأمر، وضع رئيس فؤاد على وحدة التنسيق وانقر تسحب حتى يكون هناك ما يكفي من إزالة لمنع الاتصال، ثم وضع رأسه فؤاد على المسرح المجهر.
- فوق التنقل. باستخدام عصا التحكم أو النقر على 'داون السهم، وانخفاض ببطء التحقيق AFM لتحديد موقع ناتئ فوق الشريان الأورطي. ضبط الموقف الضوئي باستخدام المقابض للكشف عن المواقع على رأسه فؤاد إذا لزم الأمر.
- انقر فوق إشراك السماح للتعزية لاجراء اتصالات مع الشريان الأورطي.
- مرة واحدة فيوتشارك الشريان الأورطي، وضمان أن مركز بيزو مستقر وفوق المنحدر. إذا كان مركز بيزو يتذبذب، وهذا قد يكون نتيجة لمشاركة كاذبة. سحب التحقيق وزيادة إزاحة رأسية من الليزر على الثنائي الضوئي بزيادات صغيرة (~ 0.5 V) وإعادة الانخراط.
- أيضا، إذا كان التحقيق هو أعلى بكثير من سطح العينة، يدويا خفض التحقيق أقرب إلى سطح العينة قبل إعادة المشاركة. إذا كانت الخطوات السابقة لا تقضي على التقلبات، حاول تبادل التحقيق.
- تعيين تعلية الحجم إلى 3 ميكرون، ووضع الزناد لنسبي وعتبة الزناد إلى 100 نانومتر، وفوق التعلية مستمر. نلاحظ أن نقطة الاتصال بين التحقيق والعينة يحدث في حوالي المركز إلى أقل ¾ من دورة Z المنحدر. إن لم يكن لوحظ هذا، فك الارتباط من العينة، وضبط حجم التعلية حسب الحاجة، وإعادة الانخراط العينة.
- انقر مجهر في شريط القوائم ومن ثم الانخراط إعدادات. تغيير SPM سحب إلى 30 ميكرون. انقر المنحدر المستمر في القائمة تعلية شريط الأدوات.
- بعد مراقبة منحنى القوة، انقر فوق التقاط في شريط القوائم ومن ثم التقاط اسم الملف. أدخل اسم الملف المطلوب مع نهاية "0.000" (وهذا سوف يسمح الملفات التي استولت إضافية لزيادة في عدد أقصاه 1). اختر-مجلد معين وحفظ البيانات.
- انقر فوق التقاط في القائمة التقاط شريط الأدوات. انقر سحب ثم انتقل. استخدام المقود أو ضوابط البرمجيات لوضع ناتئ على منطقة أخرى من الشريان الأبهر (بجانب نقطة قياس في البداية، وانظر الشكل 4).
- انقر الانخراط، التعلية، والمنحدر مستمر، على التوالي. بعد مراقبة منحنى القوة، انقر فوق إيقاف ومن ثم القبض.
- كرر الخطوات من 6،9-6،10. القبض على 5 على الأقل القياسات في منطقة كما هو مبين في الشكل (4) ملاحظة: نحن عادة جمع 15-25 منحنيات القوة 3-5 مواقع مختلفة في كل الأنسجة كما هو مبين في الشكل (4)، على التوالي.
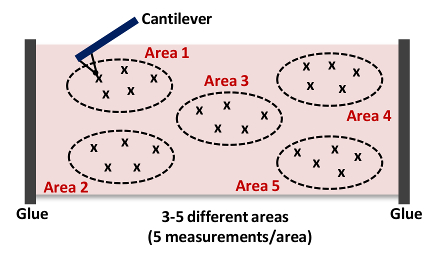
. الشكل 4: كارتون من الكابولي الاقتراب والطعج الأنسجة (منطقة 1) ويتكرر هذا قياس AFM تصل إلى 15-25 مرة 3-5 مواقع مختلفة (مناطق 1-5) في كل شريان للحصول على صلابة من مجمل عينة الأنسجة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تحليل 7. البيانات
- فتح قوة برمجيات تحليل منحنى.
- CLإك البحث والمفتوحة في شريط القوائم، وانقر مرتين على الملف المراد تحليلها.
- انقر فوق تعديل معلمات القوة في القائمة أدوات للتحقق من حساسية انحراف، ونسبة الربيع المستمر، نصيحة الشعاع، وتلميح نصف زاوية وبواسون. لتغيير الاختيار المعلمات في المربع المجاور له وأدخل القيم الصحيحة في العمود قيمة جديدة. ثم انقر فوق تنفيذ.
- إذا منحنيات القوة صاخبة، انقر فوق عربة النقل تصفية وتحديد مدخلات للاتجاه لتمديد، متوسط نقاط إلى 3 وبحث الترتيب ل0 عشر. انقر فوق تنفيذ لضمان سلاسة البيانات.
- انقر الأساس تصحيح في شريط القوائم وتحديد مدخلات للاتجاه لتمديد، وحدات مؤامرة لقوة، نوع من الانفصال، تصحيح بالدفع إلى 1 الحادي وتوسيع الأساس المصدر لتوسيع. ضبط خطوط زرقاء منقطة الرأسية ليشمل الجزء المسطح من منحنى القوة وثم انقر فوق تنفيذ.
- انقر المسافة البادئة في القائمة شريط الأدوات وتحديد المدخلات لالمنحنى النشط لمدد، أسلوب صالح إلى نقطة الاتصال القائم، نقطة الاتصال خوارزمية لعلاج متغير صالح كما، وتشمل قوة الالتصاق لا، قوة ماكس صالح الحدود إلى 30٪، القوة مين صالح الحدود ل 0٪ وتناسب نموذج لالهرتزية (كروية).
ملاحظة: في قياساتنا، التصاق كبير بين طرف وعينة (أ انحراف سلبي للتعزية في منحنى التراجع) ونادرا ما لوحظ. في الحالات التي لوحظ هذا الالتصاق، والنموذج المناسب (DMT أو JKR) يجب أن تستخدم لتحليل 18،19. - حفظ قيم معامل يونغ. تحليل (مطاط) معامل يونغ من كل من 3- 5 مناطق (منحنيات 5 القوة في المنطقة) التي اتخذت على مسافة صغيرة من بعضها البعض كما هو مبين في الشكل (4).
ملاحظة: لإزالة القطع الأثرية، واستبعاد الرجوعية يونغ> 100 كيلو باسكال (عادة ~ 10٪ من إجمالي القياسات) من التحليل. - حساب قيمة متوسط معامل يونغ لكل من 3-5 المناطق (التي تم قياسها) واستخدام هذه القيم لحساب معامل المرونة يعني لالشريان الأورطي ككل.
ملاحظة: لا يقل عن 3 وأكثر من ذلك في كثير من الأحيان 4 - تستخدم 6 aortas الفردية للحصول على تقييم دقيق لتصلب الشرايين. يتم رسم النتائج النهائية كما يعني + ووزارة شؤون المرأة من "ن" تجارب مستقلة. فإن العدد الدقيق للaortas لزم الأمر، بالطبع، يعتمد على مستوى من الدقة اللازمة.
Access restricted. Please log in or start a trial to view this content.
النتائج
ويبين الشكل 5A صورة النقيض مرحلة من الشريان الأورطي النازل (الصدر) من العمر 6 أشهر، الذكور C57BL / 6 الماوس. ناتئ فؤاد في مكان مباشرة فوق الأنسجة وجاهزة للتسنن. الأرقام 5B و5C تظهر منحنيات القوة التمثيلية التي حصلت عليها AFM المسافة البادئة في وض...
Access restricted. Please log in or start a trial to view this content.
Discussion
فؤاد المسافة البادئة يمكن استخدامها لتوصيف صلابة (معامل المرونة) من الخلايا والأنسجة. في هذه الورقة، ونحن نقدم تفصيلا بروتوكولات خطوة بخطوة لعزل الشريان الأورطي النازل وقوس الأبهر في الماوس وتحديد الرجوعية المرنة من هذه المناطق الشرايين خارج الحي. نحن الآن تلخ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
References
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved