Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение Жесткость
В этой статье
Резюме
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Аннотация
Артериальная жесткость является существенным фактором риска и биомаркеров для сердечно-сосудистых заболеваний и признаком старения. Методами атомно - силовой микроскопии (AFM) является универсальным аналитическим инструментом для определения характеристик вязкоупругих механических свойств для различных материалов , начиная от жестких (пластик, стекло, металл и т.д.) поверхности для ячеек на любой подложке. Он широко используется для измерения жесткости клеток, но реже используются для измерения жесткости аорте. В этой статье мы опишем процедуры использования AFM в режиме контакта для измерения ех естественных условиях модуль упругости незагруженных артерий мыши. Мы опишем нашу процедуру для изоляции аорте мыши, а затем предоставить подробную информацию для анализа AFM. Это включает в себя шаг за шагом инструкции для выравнивания лазерного луча, калибровка жесткость пружины и чувствительности отклонения зонда АСМ, и приобретение кривых силы. Мы также предоставляем подробный протокол для Analy данныхлиз кривых силы.
Введение
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
протокол
Работа для животных в этом исследовании была одобрена Institutional животных по уходу и использованию комитетов Университета Пенсильвании. Методы были проведены в соответствии с утвержденными руководящими принципами.
1. Подготовка мыши и выделение аорте
- Обезболить мышь с кетамином (80 - 100 мг / кг), ксилазина (8 - 10 мг / кг) и ацепромазина (1 - 2 мг / кг) внутрибрюшинно. Подтвердите наркоз с помощью теста хвоста пинч. После того, как мышь полностью под наркозом, эвтаназии мышь шейки дислокации.
- Поместите мышь на его спине и прикрепить мышь к рассечение борту. Очистите область живота с 70% (об / об) этанола салфетки.
- Сожмите кожу в средней линии и сделать небольшой первоначальный надрез среднего размера микрохирургических ножницами в животе. Удерживая кожу щипцами, используйте среднего размера микрохирургические ножницы, чтобы разрезать кожу и брюшину от живота к грудине.
- Срежьте ребра на бПр стороны с средними микрохирургических ножницами. Осторожно удалите легкие и печень с небольшими размерами микрохирургических ножницами, и оставить сердце и аорту. Перенесите мышь и рассечение доску рассекает микроскопом.
- Возьмитесь жир, окружающий аорту с мелкими пинцетом и использовать маленькие ножницы, чтобы тщательно срезать жир вокруг аорты.
- Осторожно захватить аорту пинцетом, разрезайте с небольшими размерами микрохирургических ножницами в начале восходящей аорты и другой разрез в конце нисходящей аорты, как раз над брюшной аорты.
- Передача расчлененный аорту на 60-мм чашку, содержащую 1x фосфатно-солевой буфер (PBS, без кальция и магния).
- Продолжайте отсечь все оставшиеся жировой ткани от аорты с использованием небольших размеров микрохирургические ножницы. Используйте маленькие ножницы, чтобы открыть аорту в продольном направлении.
- Использование небольших размеров микрохирургические ножницы, чтобы вырезать небольшой кусочек (~ 2 х 4 мм) нисходящей аорты и aortiс аркой для анализа AFM (Рисунок 1). Поместите ткань в пластиковую чашку 60 мм и держать его влажным в капле PBS.
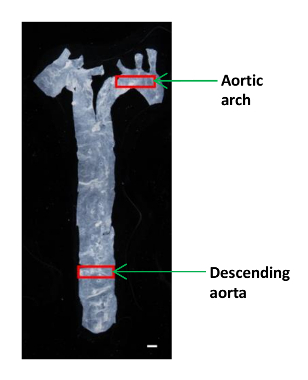
Рисунок 1:. Изображение , показывая на расположение различных сегментов в аорты Мыши Аорта была изолирована от сердца к диафрагме, и небольшая часть нисходящей аорты и дуги аорты были использованы для определения модулей упругости. Масштаб бар, 1 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
2. Подготовка ткани Образцы для АСМ измерений
- Осторожно удалите PBS с помощью лабораторного протирать, не касаясь аорту. Будьте уверены, что полостную сторона ткани лицевой стороной вверх.
- Аккуратно приклеить каждый конец открытой аорте к пластине с помощью стандартного Инг 5 - 10 мкл цианакриловым клея с гелем-наливного наконечника (рисунок 2).
Примечание: Количество клея необходимо , чтобы прочно прикрепить ткань на каждом конце должны быть определены эмпирически. Очень важно, что аорта не растягивается во время этого процесса. - Проверьте приклеенную аорту, чтобы убедиться, что она не сложена или плавающая. После воздушной сушки клея на аорте (30 - 60 сек), осторожно добавить PBS и погрузить образец.
Примечание: Подготовка АФМ (шаги 3 - 5) может быть осуществлено в то время как ткань подготавливается для анализа.

Рисунок 2: Мультфильм аортального сегмента наклеенных на блюдо культуры 60-мм с использованием Цианакрилатный клей Клей цианакриловый прикладывается к краю образца аорты в рамках подготовки к АСМ измерений..COM / файлы / ftp_upload / 54630 / 54630fig2large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
3. Загрузка Probe
- Установите держатель зонда жидкости на подставку датчика нагрузки.
- С помощью пинцета, слайд из нитрида кремния зонда АСМ (0,06 Н / м) зондовым с шаровым наконечником (мы использовали диаметр 1 мкм SiO 2 чэстиц но более крупные размеры также могут быть использованы) на держателе зонда. Убедитесь, что AFM зонд прочно прикреплен к держателю зонда.
- Сдвиньте держатель зонда на Z-сканера крепление головки AFM, и убедитесь, что держатель зонда надежно закреплен.
4. Выравнивание лазера на зонд
- Откройте программу AFM. Выберите тип эксперимента на программное обеспечение; Эксперимент Категория для контакта, режим экспериментальной группы в контактном режиме в жидкости и эксперимента в контактном режиме в жидкости. Нажмите Load ехрeriment в программном обеспечении; это включит лазер.
- Добавьте 3 мл дистиллированной воды до 50 мм со стеклянным дном тарелки и поместить в блюдо на стадии блока выравнивания лазера. Это устройство упрощает процесс фокусировки лазерного луча на обратной стороне кантилевера.
- Закрепите головку AFM в вертикальном положении на блок выравнивания лазера и мощности на блоке выравнивания лазера. Добавить приблизительно 50 мкл дистиллированной воды с образованием капли на кончике АФМ.
- С помощью джойстика, опустите голову AFM, таким образом наконечник AFM вступает в контакт с водой в чашке. Если контакт не сделан между наконечником и АФМ воды в блюдо, осторожно поднимите тарелку до контакта не предпринималась. Отрегулируйте фокус, яркость и положение XY, так что наконечник AFM в поле зрения на ЖК-дисплее устройства выравнивания.
- Установите лазерное пятно на кончик зонда АСМ, регулируя лазерное позиционирование ручки головки AFM. С помощью ручки позиционирования детектора на головке AFM, отрегулируйте Постулироватьиона фотодиода до значений между 0 и -1 V получены для вертикального отклонения и ~ 0 V получается для горизонтального отклонения.
- Проверьте, чтобы обеспечить сигнал лазера сумма максимальна. При необходимости, повторите шаг 4,5, чтобы повторно отрегулировать положение лазерного луча на кончике AFM и положением на фотодиод для получения максимального суммарного сигнала.
Примечание: Может возникнуть необходимость изменить положение зонда АСМ на держателе зонда , чтобы получить максимальный суммарный сигнал , даже если шаг 4,5 повторяется.
5. Калибровка Прогиб чувствительности и жесткости пружины зонда АСМ
- Сделайте царапину на культуральной чашке 60 мм с и заполнить силы р блюдо с дистиллированной водой. Место культуры блюдо на держателе образца пластины. В этом случае, установите блюдо на стадии инвертированного микроскопа моторизованный XY сканирования.
- Поместите магнитный держатель пластин на верхней части пластины, чтобы держать его безопасным во время съемки.
- Нажмите Стрелка "вверх" в меню навигации на программное обеспечение для перемещения головки AFM почти до самого высокого положения , чтобы гарантировать , что AFM зонд не будет касаться блюдо.
Примечание: Этот шаг очень важен , поскольку он позволяет избежать разрушения наконечника AFM. - Установите головку AFM на столике микроскопа.
- Используйте микроскоп, чтобы сосредоточиться на пустом месте на пластине. С помощью джойстика или нажмите стрелку "вниз" в меню навигации, медленно и осторожно опустите AFM зонд в PBS. Расположите голову чуть выше нуля в пластине.
Примечание: Если начальное положение головки AFM ближе к образцу, то время заниматься будет значительно сокращен. - Перед включением, повторно отрегулировать положение лазерного луча на кончике AFM и положением на фотодиод для получения максимального суммарного сигнала по мере необходимости.
- Выберите тип наконечника, нажав кнопку Изменить зонд в меню настройки.
- Нажмите кнопку Проверить параметры и установить параметры: Размер сканирования 0, скорость сканирования до 1 Гц, частота дискретизации / линии 256 и Прогиб заданного значения до 20 нм. Нажмите Engage. Engage Окно статуса будет оставаться открытым до тех пор, пока зонд вступает в контакт с поверхностью пластины. После привлечения зонда, нажмите Ramp.
- Нажмите кнопку Расширенный режим в меню панели инструментов сканирования и установить параметры: пандус Размер в диапазоне от 500 нм до 1 мкм, Ramp Rate 2 Гц, количество образцов 256, Совет радиус до 500 нм, коэффициент отбора проб Пуассона 0.5 (принимает материал чтобы измерить совершенно несжимаема), Совет Половина угла 0, режим триггера для относительного и порог срабатывания до от 20 до 100 нм.
- Нажмите Ramp Непрерывный в меню Ramp панели инструментов для obtaв силовой кривой на плате (фиг.3А). В этой силовой кривой, установите канал 1 для ошибки отклонения.
Примечание: Это позволит программное обеспечение для графического результаты в виде вертикального отклонения против позиции г.- Нажмите на левой или правой концах кривой силы и перетащите курсор , чтобы охватить линейную область силовой кривой (рис 3А, пунктирные красные линии). Используйте эти две линии, чтобы отметить границы наклонного региона быть в хорошей форме с прямой линией.
- Выберите Ramp в панели инструментов и нажмите кнопку Обновить чувствительность. Запишите значение и повторить этот шаг еще четыре раза. Выберите Калибровать на панели инструментов , а затем нажмите Detector. Входное среднее значение из пяти измерений в поле Прогиб чувствительности.
- Нажмите Вывод 2 - 3 раза , чтобы поднять голову AFM. Этот шаг важен для предотвращениявзаимодействие между зондом AFM и пластины во время процесса термического мелодией. Нажмите Термическое Настройтесь на панели инструментов.
- Установить Thermal Tune диапазоне 1 - 100 кГц (Эта информация может быть получена из каталога изготовителя) и величина отклонения чувствительности к коррекции 1.144 для V-образных кантилеверов и 1.106 для прямоугольных кантилеверов.
- В меню Thermal Tune, нажмите кнопку получения данных для получения тепловой кривой мелодия (рис 3B). С помощью программного обеспечения AFM, место красная пунктирные линии по обе стороны от кривой (как показано на фигуре 3В), перемещая мышь от края графика , чтобы определить границы для установки. Выберите либо Лоренцевы (Air) или простого гармонического осциллятора (Fluid) модель в зависимости от которой лучше соответствует данным.
- Нажмите Fit Data, а затем Вычислить Spring K и сохранить это значение. реторфа пружины калибровок несколько раз и использовать среднее значение. Нажмите Вывести несколько раз.
- Снимите головку AFM со сцены микроскопа и поместите его на блок выравнивания. Снимите блюдо из столика микроскопа.
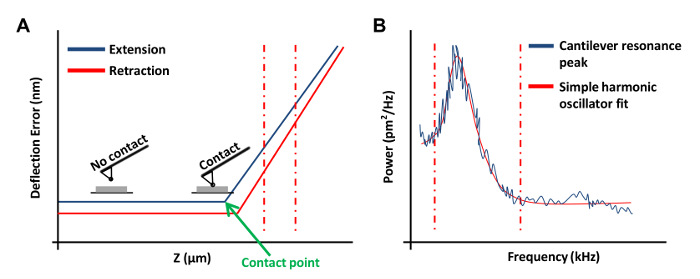
Рисунок 3: Кривые AFM сила , используемая при калибровке AFM Probes. (А) представитель AFM силовой кривой (калибровочная кривая). Расширение часть силовой кривой между вертикальной красной пунктирной линии был использован для определения чувствительности кантилевера. (B) простой гармонической осциллятора подходят график , используемый для расчета жесткости пружины кантилевера , как описано выше 20. Пожалуйста , нажмите здесь , чтобы просмотреть увеличенная версия этой фигуры.
6. Измерение модуля упругости на автомагистралях Mouse Ex Vivo
- Поместите 60-мм культуры блюдо, содержащий аортальный ткани на столике микроскопа, и закрепите пластину с держателем магнитной пластины.
- Установите головку AFM на столике микроскопа. Убедитесь, что АФМ зонд не соприкасается с аортой, но осторожно, вступает в контакт с PBS и образует мениск. При необходимости, поместите головку AFM на блоке выравнивания и нажмите кнопку Вывод , пока не будет достаточно свободного пространства , чтобы предотвратить контакт, а затем поместите голову AFM на столике микроскопа.
- Нажмите Navigate. С помощью джойстика или нажав "вниз" стрелку, медленно опустите AFM зонд , чтобы определить местонахождение кантилевера над аортой. Отрегулируйте положение фотодиод с помощью позиционирования детектора ручки на головке AFM в случае необходимости.
- Нажмите Engage , чтобы кантилевер , чтобы вступить в контакт с аортой.
- Однаждыаорта занимается, убедитесь , что пьезоэлектрический центр является стабильным и нажмите Ramp. Если пьезоэлектрический центр колеблется, это может быть результатом ложного зацепления. Вытащите щуп и увеличить вертикальное смещение лазера на фотодиод малыми приращениями (~ 0,5 В) и вновь вступить в бой.
- Кроме того, если зонд находится далеко над поверхностью образца, вручную опустить зонд ближе к поверхности образца до повторного зацепления. Если предыдущие шаги не устраняют колебания, попробуйте замены зонда.
- Установите Ramp размер до 3 мкм, триггерный режим с относительными и порога срабатывания до 100 нм и нажмите Ramp Непрерывный. Заметим, что точка контакта между зондом и образцом происходит приблизительно в центре к нижнему ¾ цикла Z рампы. Если этого не наблюдается, абстрагироваться от образца, регулировать размер Ramp по мере необходимости, и повторно включите образец.
- Нажмите Микроскоп в строке меню , а затем Engage Settings. Изменение SPM Вывод до 30 мкм. Нажмите Ramp Непрерывный в меню Ramp панели инструментов.
- После наблюдения за силовой кривой, нажмите кнопку Захват в строке меню , а затем захват файла. Введите нужное имя файла с окончанием ".000" (это позволит дополнительно захваченные файлы к увеличению числа на 1). Выберите обозначенную-папку и сохранить данные.
- Нажмите Capture в меню панели инструментов Capture. Нажмите Вывод и затем Navigate. С помощью джойстика или управления программного обеспечения для позиционирования кантилевера над другой участок аорты (рядом с первоначально измеренной точки, см рисунок 4).
- Нажмите Engage, Ramp и Ramp Непрерывный, соответственно. После наблюдения за силовой кривой, нажмите кнопку Остановить , а затем Capture.
- Повторите шаги 6.9 - 6.10. Захват по меньшей мере , 5 измерений в области , как показано на рисунке 4 Примечание: Как правило , мы собираем 15 - 25 кривых силу с 3 - 5 разных местах в каждой ткани , как показано на рисунке 4, соответственно..
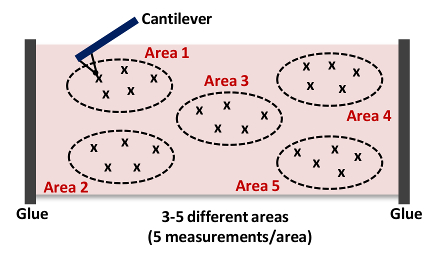
. Рисунок 4: Мультфильм кантилевера Приближаясь и отступов ткани (область 1) Это измерение AFM повторяется до 15 - 25 раз от 3 - 5 разных местах (зоны 1 - 5) в каждой артерии , чтобы получить жесткость общая образец ткани. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
7. Анализ данных
- Открытая сила анализ кривой программного обеспечения.
- ClИк Найдите и откройте в строке меню, и дважды щелкните на файле для анализа.
- Нажмите Изменить параметры Force в меню панели инструментов , чтобы проверить чувствительность отклонения, пружины, кончик радиуса, кончик половинный угол и коэффициент Пуассона. Для изменения параметров установите флажок рядом с ним и введите правильные значения в новом столбце значений. Затем нажмите кнопку Выполнить.
- Если силовые кривые шумные, нажмите Boxcar фильтр и установить входы для направления Продлить Средние очки 3 и порядок фильтров до 0 - го. Нажмите Выполнить для сглаживания данных.
- Нажмите коррекции базовой линии в строке меню и установить входы для направления для того чтобы расширить, участок земли единиц к силе, Тип для разделения, коррекция для того , чтобы 1 - го и расширение основной источник для того чтобы расширить. Отрегулируйте вертикальные пунктирные синие линии , чтобы охватить плоскую часть силовой кривой , а затем нажмите кнопку Выполнить.
- Нажмите отступа в меню панели инструментов и установите входы для активной кривой до Extended, подходящего метода для контакта координаты точки, координаты контактного алгоритма для лечения , как Fit переменной, Включить силы адгезии к Нет, Макс Force Fit границы до 30%, Min Force Fit границы до 0% и Fit Модель для Герца (сферическая).
Примечание: В наших измерениях, редко наблюдается значительное сцепление между зондом и образцом (отрицательное отклонение кантилевера на кривой обратного хода). В тех случаях , когда наблюдается такая адгезия, соответствующая модель (DMT или ДКР) следует использовать для анализа 18,19. - Сохраните значения модуля Юнга. Анализировать (эластичный) модуль Юнга каждого из 3- 5 областей (5 силовых кривых на единицу площади) , принятые в пределах небольшого расстояния друг от друга , как показано на рисунке 4.
Примечание: Чтобы удалить артефакты, исключить модули Юнга> 100 кПа (обычно ~ 10% от общего числа измерений) из анализа. - Вычислить среднее значение модуля Юнга для каждого из 3 - 5 областей (которые были измерены) и использовать эти значения для вычисления среднего значения модуля упругости для аорты в целом.
Примечание: По крайней мере , 3 и чаще 4 - 6 используются отдельные Аорты для получения точной оценки артериальной жесткости. Окончательные результаты представлены в виде среднего значения + SEM из "п" независимых экспериментов. Точное количество необходимых аорте будет, конечно, зависеть от уровня требуемой точности.
Access restricted. Please log in or start a trial to view this content.
Результаты
На фиг.5А показан фазовый контраст изображения нисходящей (грудной) аорты от 6 месяцев, самцы C57BL / 6 мыши. Консольная AFM находится в месте непосредственно над тканью и готовы к выемке. На рисунках 5В и 5С демонстрируют типичные кривые силы , полученные с помощь...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
АФМ отступа может быть использован для характеристики жесткости (модуль упругости) клеток и тканей. В этой статье мы приводим подробные шаг за шагом протоколов для изоляции нисходящей аорты и дуги аорты у мышей и определяют модули упругости этих артериальных регионов бывших естеств...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Ссылки
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены