Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La medición de la rigidez de
En este artículo
Resumen
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Resumen
la rigidez arterial es un importante factor de riesgo y biomarcadores para la enfermedad cardiovascular y un sello de envejecimiento. Microscopía de fuerza atómica (AFM) es una herramienta analítica versátil para la caracterización de propiedades mecánicas viscoelásticas para una variedad de materiales que van desde el disco (plástico, vidrio, metal, etc.) las superficies a las células sobre cualquier sustrato. Ha sido ampliamente utilizado para medir la rigidez de las células, sino que se utiliza con menos frecuencia para medir la rigidez de aortas. En este artículo, vamos a describir los procedimientos para el uso de AFM en modo de contacto para medir el módulo elástico ex vivo de las arterias de ratones sin carga. Describimos nuestro procedimiento para el aislamiento de las aortas de ratón y, a continuación ofrecemos información detallada para el análisis AFM. Esto incluye instrucciones paso a paso para la alineación del haz de láser, la calibración de la constante de elasticidad y sensibilidad de desviación de la sonda de AFM, y la adquisición de curvas de fuerza. También proporcionamos un protocolo detallado para Analy datossis de las curvas de fuerza.
Introducción
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocolo
el trabajo con animales en este estudio fue aprobado por los Comités de Cuidado y Uso de Animales Institucional de la Universidad de Pennsylvania. Los métodos se llevaron a cabo de acuerdo con las directrices aprobadas.
1. Preparación del ratón y aislamiento de la aorta
- Anestesiar un ratón con ketamina (80 - 100 mg / kg), xilazina (8-10 mg / kg) y acepromazina (1 - 2 mg / kg) por vía intraperitoneal. Confirmar la anestesia con una prueba de pinzamiento del rabo. Una vez que el ratón está totalmente anestesiado, la eutanasia el ratón por dislocación cervical.
- Coloca el ratón sobre su espalda y el pin con el ratón a una placa de disección. Limpiar la zona del abdomen con un 70% (v / v) de etanol toallitas.
- Pellizcar la piel en la línea media y hacer una pequeña incisión inicial con tijeras de microcirugía de tamaño medio en el abdomen. Mientras mantiene la piel con pinzas, tijeras de microcirugía utilizar de tamaño medio para cortar la piel y el peritoneo desde el abdomen hasta el esternón.
- Cortar las costillas en bOTH lados con unas tijeras de microcirugía de tamaño medio. Retirar con cuidado los pulmones y el hígado con pequeñas tijeras de microcirugía de tamaño, y dejar el corazón y la aorta. Transferir el ratón y el tablero de la disección de un microscopio de disección.
- Agarre la grasa que rodea la aorta con pequeñas pinzas y utilizar pequeñas tijeras para cortar cuidadosamente la grasa alrededor de la aorta.
- agarrar suavemente el pinzamiento aórtico, hacer un corte con tijeras de microcirugía pequeñas de tamaño al comienzo de la aorta ascendente y otro corte al final de la aorta descendente, justo por encima de la aorta abdominal.
- La transferencia de la aorta disecada de un plato de 60 mm que contiene solución salina tamponada con fosfato 1x (PBS; sin calcio y magnesio).
- Continuar como para diseccionar cualquier tejido graso restante de la aorta utilizando pequeñas tijeras de microcirugía tamaño. Utilice pequeñas tijeras para abrir la aorta longitudinalmente.
- Utilice pequeñas tijeras de microcirugía tamaño para cortar un pedazo pequeño (~ 2 x 4 mm) de la aorta descendente y aortic arco para el análisis AFM (Figura 1). Coloque el tejido en un plato de plástico de 60 mm y mantenerlo húmedo en una gota de PBS.
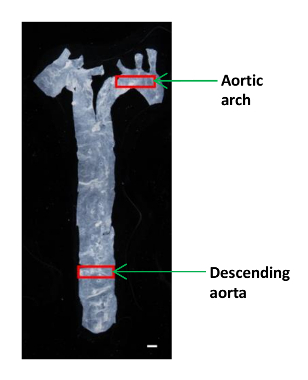
Figura 1:. Una imagen que muestra la ubicación de los segmentos aórticos diferentes en un ratón La aorta fue aislado del corazón para el diafragma, y una pequeña porción de la aorta descendente y el arco aórtico se utilizaron para determinar los módulos de elasticidad. Barra de escala, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación de muestras de tejido para las mediciones de AFM
- Retirar con cuidado el PBS utilizando un laboratorio-limpie sin tocar la aorta. Asegúrese de que el lado luminal del tejido quede hacia arriba.
- pegar suavemente cada extremo de la aorta abierto a la placa por complemento ing 5 - 10 l de adhesivo de cianoacrilato con una punta de carga de gel (Figura 2).
NOTA: La cantidad de pegamento necesario para unir firmemente el tejido en cada extremo debe ser determinada empíricamente. Es crítico que la aorta no se estira durante este proceso. - Compruebe la aorta pegada para asegurarse de que no se dobla o flotante. Después de secado al aire, el pegamento en la aorta (30 - 60 seg), añadir con cuidado PBS y sumergir la muestra.
NOTA: Preparación del AFM (los pasos 3 - 5) se puede llevar a cabo mientras que el tejido se está preparando para su análisis.

Figura 2: la historieta de un segmento aórtico pega sobre una placa de cultivo de 60 mm utilizando cianoacrilato adhesivo se aplica el adhesivo de cianoacrilato con el borde de una muestra de la aorta en la preparación para mediciones de AFM..com / archivos / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
3. Colocación de la sonda
- Montar un soporte de la sonda de líquido en el soporte de carga de la sonda.
- Con unas pinzas, deslizar una sonda AFM nitruro de silicio (0,06 N / m voladizo) con una punta esférica (hemos utilizado un diámetro de 1 m de partículas de SiO2 pero tamaños más grandes también se pueden utilizar) en el soporte de la sonda. Asegúrese de que la sonda de AFM está firmemente fijado al soporte de la sonda.
- Deslice el soporte de la sonda en el Z-escáner de montaje de la cabeza AFM, y asegúrese de que el soporte de la sonda está bien conectado.
4. Alineación del láser en la punta de prueba
- Abra el software de AFM. Elija el tipo experimento en el software; Experimento Categoría contactar modo, Experimento Grupo de Contacto Modo en el líquido y Experimento contactar a modo de fluido. Haga clic en Cargar experiment en el software; esto va a encender el láser.
- Añadir 3 ml de agua destilada a una placa de fondo de cristal 50-mm y colocar el plato en la etapa de la unidad de alineación laser. Esta unidad simplifica el proceso de enfocar el haz de láser sobre la parte posterior de voladizo.
- Montar la cabeza AFM en una posición vertical sobre la unidad de ajuste láser y de alimentación de la unidad de alineación láser. Añadir aproximadamente 50 l de agua destilada para formar una gota en la punta del AFM.
- Uso de la palanca de mando, bajar la cabeza AFM de modo que la punta de AFM hace contacto con el agua en el plato. Si el contacto no se hace entre la punta del AFM y el agua en el plato, levante suavemente el plato hasta que se tome contacto. Ajustar el enfoque, el brillo y la posición XY de modo que la punta del AFM está a la vista en la pantalla LCD de la unidad de alineación.
- Coloque el punto de láser en la punta de la sonda AFM mediante el ajuste de los mandos de posicionamiento láser de la cabeza AFM. El uso de los mandos de posicionamiento del detector en la cabeza AFM, ajustar el position del fotodiodo hasta valores entre 0 y -1 V se obtienen para la deflexión vertical y ~ 0 V se obtiene para la desviación horizontal.
- Compruebe que la señal de suma láser se maximiza. Si es necesario, repita el paso 4.5 para volver a ajustar la posición del rayo láser en la punta del AFM y la posición del fotodiodo para obtener la máxima señal suma.
NOTA: Puede que sea necesario cambiar la posición de la sonda de AFM en el soporte de la sonda para obtener una señal suma máxima, incluso si el paso 4.5 se repite.
5. Calibración de la constante de sensibilidad de deflexión y la primavera de la sonda AFM
- Hacer un rasguño en una placa de cultivo de 60 mm con una pinza y llenar el recipiente con agua destilada. Coloque la placa de cultivo en la placa de soporte de la muestra. En este caso, montar el plato en la etapa de exploración XY motorizado de un microscopio invertido.
- Coloque un soporte de la placa magnética en la parte superior de la placa para mantenerla segura durante la exploración.
- Hacer clic Flecha "arriba" en el menú de navegación en el software para mover la cabeza AFM hasta casi su posición más alta para asegurarse de que la sonda AFM no va a tocar el plato.
NOTA: Este paso es muy importante ya que evita romper la punta del AFM. - Coloque la cabeza AFM sobre la platina del microscopio.
- Utilizar el microscopio para centrarse en el cero en el plato. Utilice el joystick, o haga clic en la flecha "abajo" en el menú de navegación, para bajar lenta y cuidadosamente la sonda de AFM en el PBS. Coloque la cabeza ligeramente por encima del cero en la placa.
NOTA: Si la posición inicial de la cabeza AFM está más cerca de la muestra, el tiempo de participar se reducirá significativamente. - Antes de participar, re-ajustar la posición del haz de láser en la punta del AFM y la posición del fotodiodo para obtener la señal máxima SUM como sea necesario.
- Seleccione un tipo de punta pulsando Cambiar la sonda en el menú de configuración.
- Haga clic en Comprobar los parámetros y establecer los parámetros: tamaño de escaneado en 0, Velocidad de lectura de 1 Hz, Muestra / línea 256 y la desviación de consigna a 20 nm. Haga clic Engage. La ventana de estado Engage permanecerá abierta hasta que la sonda hace contacto con la superficie de la placa. Después de acoplar la sonda, haga clic en rampa.
- Haga clic en modo expandido en el menú de la barra de herramientas de exploración y establecer los parámetros: Rampa tamaño de entre 500 nm y 1 micra, frecuencia de la rampa de 2 Hz, número de muestras a 256, punta de radio a 500 nm, relación muestra de Poisson de 0,5 (se supone que el material a medir es perfectamente incompresible), Media ángulo de punta a 0, modo de disparo al umbral relativo y el gatillo de entre 20 y 100 nm.
- Haga clic en rampa continua en el menú de la barra de herramientas de rampa a obtaen una curva de fuerza en la placa (Figura 3A). En esta curva de fuerza, ajuste el canal 1 al error de desviación.
NOTA: Esto permitirá que el software para representar gráficamente los resultados como desviación vertical frente a la posición z.- Haga clic en los extremos izquierdo o derecho de la curva de fuerza y arrastre el cursor para abarcar una región lineal de la curva de fuerza (Figura 3A, líneas rojas discontinuas). Utilice estas dos líneas para marcar los límites de la región inclinada para estar en forma con una línea recta.
- Seleccionar rampa en la barra de herramientas y haga clic en Actualizar sensibilidad. Registrar el valor y repetir este paso cuatro veces más. Seleccione Calibrar en la barra de herramientas y haga clic en el detector. Introducir un valor promedio de las cinco mediciones en el cuadro de Desviación de sensibilidad.
- Haga clic en Retirar 2 - 3 veces para levantar la cabeza AFM. Este paso es importante para evitarinteracción entre la punta del AFM y la placa durante el proceso de ajustar las características térmicas. Haga clic en ajustar las características térmicas de la barra de herramientas.
- Establecer térmica Rango Tune sobre 1 - 100 kHz (Esta información se puede obtener de catálogo del fabricante) y la deflexión de corrección de sensibilidad a 1.144 para los voladizos en forma de V y 1.106 para los voladizos rectangulares.
- En el menú Tune térmica, haga clic en Adquirir datos para obtener una curva ajustar las características térmicas (Figura 3B). Usando el software de AFM, lugar rojo líneas punteadas en cualquier lado de la curva (como se muestra en la Figura 3B) arrastrando el ratón desde el borde de la gráfica para definir los límites para el montaje. Seleccione ya sea el de Lorentz (Aire) o el modelo de oscilador armónico simple (Fluido) en función de la mejor ajuste a los datos.
- Haga clic en Ajustar datos, a continuación, calcular la primavera K y guardar este valor. Returba la constante de resorte calibraciones varias veces y usar el valor medio. Haga clic en Retirar varias veces.
- Retire el cabezal AFM de la platina del microscopio y colocarlo en la unidad de alineación. Retirar la cápsula de la platina del microscopio.
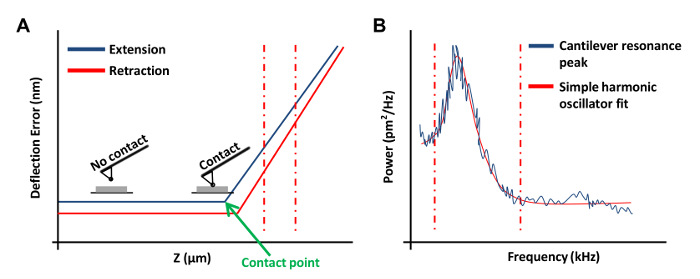
Figura 3: Curvas AFM fuerza utilizada en la calibración de sondas de AFM. (A) Una curva de fuerza AFM representante (una curva de calibración). La porción de extensión de la curva de fuerza entre la vertical roja líneas discontinuas se utilizó para determinar la sensibilidad voladizo de deflexión. (B) Un gráfico simple ajuste oscilador armónico se utiliza para calcular la constante elástica del voladizo a lo descrito previamente 20. Haga clic aquí para ver una versión más grande de esta figura.
6. La medición de la Módulo Elástico en arterias de ratón ex vivo
- Coloque la placa de cultivo de 60 mm que contiene el tejido aórtico en la platina del microscopio, y asegurar la placa con el soporte de la placa magnética.
- Coloque la cabeza AFM sobre la platina del microscopio. Asegúrese de que la sonda AFM no hace contacto con la aorta, pero lo hace con suavidad contacto con PBS y se forma un menisco. Si es necesario, colocar la cabeza AFM en la unidad de alineación y haga clic en Retirar hasta que haya suficiente espacio libre para evitar el contacto, a continuación, colocar la cabeza AFM sobre la platina del microscopio.
- Haga clic en Navegar. Con el joystick o haciendo clic en "abajo" flecha, baje lentamente la sonda de AFM para localizar el voladizo por encima de la aorta. Ajustar la posición fotodiodo con los mandos de posicionamiento del detector en la cabeza AFM, si es necesario.
- Haga clic en Engage para permitir que el voladizo para hacer contacto con la aorta.
- Una vez elaorta se dedica, asegúrese de que el centro piezoeléctrico es estable y haga clic en rampa. Si el centro de piezo es fluctuante, esto puede ser el resultado de un compromiso falso. Retirar la sonda y aumentar la distancia al eje vertical del láser sobre el fotodiodo en pequeños incrementos (~ 0,5 V) y volver a participar.
- Además, si la sonda está muy por encima de la superficie de la muestra, bajar manualmente la sonda más cerca de la superficie de la muestra antes de volver a la participación. Si los pasos anteriores no eliminan la fluctuación, trate de intercambio de la sonda.
- Ajuste el tamaño de rampa a 3 micras, el modo de disparo en relativa y el umbral de disparo a 100 nm y haga clic en rampa continua. Observe que el punto de contacto entre la sonda y la muestra se produce aproximadamente en el centro de la parte inferior de ¾ del ciclo Z rampa. Si esto no se observa, desenganche de la muestra, ajustar el tamaño de rampa según sea necesario, y volver a enganchar la muestra.
- Haga clic Microscopio en la barra de menú y luego Ajustes Engage. Cambiar el SPM se retiran a 30 micras. Haga clic en rampa continua en el menú de la barra de herramientas de rampa.
- Después de observar la curva de fuerza, haga clic en Capturar en la barra de menú y luego capturar Nombre de archivo. Introduzca un nombre de archivo deseado con el final ".000" (esto permitirá que los archivos capturados adicionales para aumentar en número por 1). Seleccione una carpeta designada y guardar los datos.
- Haga clic en Capturar en el menú Captura Barra de herramientas. Haga clic en Retirar y luego Navegar. Utilice el joystick o controles de software para posicionar el voladizo sobre otra área de la aorta (al lado del punto de medida inicialmente; véase la Figura 4).
- Haga clic Engage, rampa y rampa continua, respectivamente. Después de observar la curva de fuerza, haga clic en Detener luego capturar.
- Repita los pasos 6.9 a 6.10. Captura de al menos 5 mediciones por zona, como se muestra en la Figura 4 NOTA: normalmente Recopilamos 15 - 25 curvas de fuerza a partir de 3 - 5 lugares diferentes en cada tejido, como se muestra en la Figura 4, respectivamente..
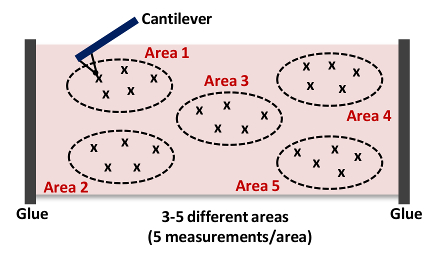
. Figura 4: dibujos animados de un voladizo de Aproximación y de sangría de Tejidos (Zona 1) Esta medición AFM se repite hasta 15 - 25 veces a partir de 3 - 5 lugares diferentes (Zonas 1 - 5) en cada arteria para adquirir la rigidez del conjunto muestra de tejido. Haga clic aquí para ver una versión más grande de esta figura.
Análisis 7. Datos
- software de análisis de curva de fuerza abierta.
- click encontrar y abrir en la barra de menú, y haga doble clic en un archivo para ser analizada.
- Haga clic en Modificar parámetros de fuerza en el menú de la barra de herramientas para comprobar la sensibilidad de deflexión, la relación de Constant Spring, punta de radio, Media ángulo de la punta y de Poisson. Para cambiar los parámetros de verificación en la casilla junto a él y entre los valores correctos en la columna el nuevo valor. A continuación, haga clic en Ejecutar.
- Si curvas de fuerza son ruidosos, haga clic furgón del filtro y fijar las entradas de dirección para extender, Promedio de puntos a 3 y Filtro Orden de 0 º. Haga clic en Ejecutar para suavizar los datos.
- Haga clic en Corrección de línea de base en la barra de menú y ajustar los insumos para la dirección de Extend, unidades de trazado para fuerza y tipo de separación, con el fin de Corrección 1ª y Extender línea de base Fuente extender. Ajuste las líneas azules discontinuas verticales para abarcar la parte plana de la curva de la fuerza y luego haga clic en Ejecutar.
- Haga clic sangría en el menú de la barra de herramientas y establecer las entradas de curva activa en Extended, Método de ajuste de contactar a punto en función, Punto de Contacto Algoritmo para tratar la variable como Ajustar, Incluir fuerza de adherencia en No, Max Inserción de Límites al 30%, la fuerza mínima de ajuste del límite de 0% y el ajuste del modelo a hertziana (esférica).
NOTA: En nuestras mediciones, la adhesión significativa entre la punta y la muestra (una desviación negativa del voladizo de la curva de retracción) se observa raramente. En los casos en que se observa como la adhesión, el modelo apropiado (DMT o JKR) se debe utilizar para el análisis 18,19. - Guarde los valores del módulo de Young. Analizar el módulo de Young (elástico) de cada uno de los 3- 5 áreas (curvas 5 fuerza por área) tomados dentro de una pequeña distancia una de la otra como se muestra en la Figura 4.
NOTA: Para eliminar artefactos, excluir módulos de Young> 100 kPa (normalmente ~ 10% de las mediciones totales) del análisis. - Calcular un valor de módulo medio de Young para cada uno de los 3 - 5 áreas (que se han medido) y utilizar estos valores para calcular un módulo de elasticidad media de la aorta en su conjunto.
NOTA: Al menos 3 y más a menudo 4 - 6 aortas individuales se utilizan para obtener una evaluación precisa de la rigidez arterial. Los resultados finales se representan como media + SEM de "n" experimentos independientes. El número exacto de aortas necesarios será, por supuesto, dependerá del nivel de precisión requerido.
Access restricted. Please log in or start a trial to view this content.
Resultados
La Figura 5A muestra una imagen de contraste de fase de la aorta descendente (torácica) de un 6-meses de edad, macho C57BL / 6 de ratón. El voladizo AFM está en su lugar directamente sobre el tejido y listo para el sangrado. Figuras 5B y 5C muestran curvas de fuerza representativos obtenidos por AFM indentación en el modo de contacto. Las líneas verdes se muestran en las figuras 5B y 5C representan las mejores curvas de ajust...
Access restricted. Please log in or start a trial to view this content.
Discusión
AFM indentación puede ser utilizado para caracterizar la rigidez (módulo elástico) de las células y tejidos. En este trabajo, ofrecemos protocolos detallados paso a paso para aislar la aorta descendente y arco aórtico en el ratón y determinar los módulos de elasticidad de estas regiones arteriales ex vivo. Ahora tenemos resumir y discutir las cuestiones técnicas y las limitaciones del método descrito en este documento.
Varios problemas técnicos pueden surgir en el aislamie...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Referencias
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados