A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת הקשיחות של
In This Article
Summary
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Abstract
ההתקשות עורקת היא גורם סיכון משמעותי סמן למחלות לב וכלי דם סימן היכר של הזדקנות. מיקרוסקופ כוח אטומי (AFM) הוא כלי אנליטי צדדי לאפיון תכונות מכאניות viscoelastic עבור מגוון רחב של חומרים, החל קשה (פלסטיק, זכוכית, מתכת, וכו ') משטחים לתאים על מצע כלשהו. זה כבר נעשה שימוש נרחב על מנת למדוד את הנוקשות של תאים, אך בתדירות נמוכה יותר משמש כדי למדוד את הנוקשות של aortas. במאמר זה, נתאר את ההליכים באמצעות AFM במצב מגע, מודדי מודולוס vivo לשעבר אלסטי של עורקי עכבר טעונים. אנו מתארים הליך שלנו לבידוד תרמי של aortas עכבר, ולאחר מכן לספק מידע מפורט לניתוח AFM. זה כולל הוראות שלב-אחר-שלב עבור יישור של קרן לייזר, כיול של קבוע הקפיץ ורגישות סטיה של החללית AFM, ורכישת עקומות כוח. כמו כן אנו מספקים פרוטוקול מפורט analy נתוניםאחותי של עקומות כוח.
Introduction
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocol
עבודה בעלי חיים במחקר זה אושר על ידי ועדות טיפול בבעלי חיים מוסדיים השתמש מאוניברסיטת פנסילבניה. השיטות בוצעו בהתאם להנחיות שאושרו.
1. הכנת העכבר והבידוד של אב העורקים
- להרדים עכבר עם קטמין (80 - 100 מ"ג / ק"ג), xylazine (8 - 10 מ"ג / ק"ג) ו acepromazine (1 - 2 מ"ג / ק"ג) intraperitoneally. אשר הרדמה עם מבחן זנב קמצוץ. לאחר העכבר הוא בהרדמה מלאה, להרדים את העכבר על ידי נקע בצוואר הרחם.
- מניחים את העכבר על גבו ואת הסיכה בעכבר כדי קרש החיתוך. נקו את אזור הבטן עם 70% (v / v) מגבונים אתנול.
- לצבוט את העור על קו האמצע ולעשות חתך ראשוני קטן עם מספרי microsurgery בינוניים על הבטן. תוך כדי לחיצה על העור עם מלקחיים, להשתמש במספריים microsurgery בגודל בינוני לחתוך את העור הצפק מהבטן אל עצם החזה.
- לחתוך את הצלעות על bהצדדים oth במספריים microsurgery בינוניים. מוציאים בזהירות את הריאות והכבד במספריים microsurgery בגודל קטן, ולהשאיר את הלב ואבי העורקים. מעבירים את העכבר ולוח לנתיחה כדי מיקרוסקופ לנתח.
- אחוז השומן סביב האאורטה עם מלקחיים קטנים ולהשתמש מספריים קטנים לחתוך בזהירות את שומן סביב האאורטה.
- בעדינות לתפוס את אבי העורקים עם מלקחיים, לעשות חתך אחד עם מספריים microsurgery בגודל קטן בתחילת האאורטה עולה ואת להורדת ריבית נוספת בסוף האאורטה יורד, ממש מעל אבי העורקים בבטן.
- מעבירים את אבי העורקים גזור בצלחת 60 מ"מ המכיל שנאגרו מלוחים פוספט 1x (PBS; ללא סידן ומגנזיום).
- המשך לנתח משם את כל רקמת שומן שנותרו מן האאורטה באמצעות מספריים microsurgery בגודל קטן. השתמש במספריים קטנים כדי לפתוח את אבי העורקים longitudinally.
- השתמש במספריים microsurgery בגודל קטן כדי לחתוך חתיכה קטנה (~ 2 x 4 מ"מ) של אבי העורקים היורד ו aortiקשת ג לניתוח AFM (איור 1). הנח את רקמת בצלחת פלסטיק 60 מ"מ ולשמור אותו לח בטיפת PBS.
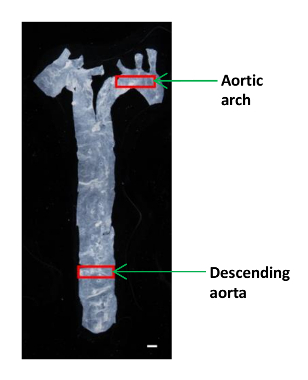
איור 1:. תמונה המראה את המיקום של מגזרי אבי העורקים שונים עכבר אבי העורקים היה מבודד מן הלב אל הסרעפת, וחלק קטן של אבי העורקים היורד ואל קשת אבי העורקים שימשו כדי לקבוע את moduli אלסטי. סרגל קנה מידה, 1 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
2. דגימות רקמה הכנות לקראת מדידות AFM
- מוציאים בזהירות את PBS באמצעות מעבדה לנגב בלי לגעת האאורטה. להיות בטוח שהצד luminal של הרקמה הוא פונה כלפי מעלה.
- בעדינות להדביק בכל קצה של האאורטה נפתח את הצלחת על ידי הוספה ing 5 - 10 μl של דבק cyanoacrylate עם קצה ג'ל טעינה (איור 2).
הערה: כמות דבק צורך לצרף את הרקמה בתקיפות בכל קצה צריכה להיקבע באופן אמפירי. זה קריטי, כי אבי העורקים אינו נמתח במהלך תהליך זה. - בדוק את אב העורקים המודבקים כדי לוודא שזה לא מקופל או צף. לאחר אוויר ייבוש הדבק על אבי העורקים (30 - 60 שניות), בעדינות להוסיף PBS לצלול המדגם.
הערה: הכנת ה- AFM (שלבים 3 - 5) יכול להתבצע תוך הרקמה נמצאת בהכנה לניתוח.

איור 2: קריקטורה של פלח אבי העורקים מודבקות על צלחת תרבות 60 מ"מ באמצעות Cyanoacrylate דבק דבק cyanoacrylate מוחל קצה מדגם אבי העורקים כהכנה מדידות AFM..com / קבצים / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. טעינת Probe
- הר בעל חללית הנוזל על דוכן עומס בדיקה.
- בעזרת פינצטה, חלק בדיקת AFM סיליקון ניטריד (0.06 N / שלוחה מ ') עם קצה כדורי (השתמשנו חלקיק 1 מיקרומטר בקוטר SiO 2 אבל גדלים גדול יותר עשוי לשמש גם) על מחזיק בדיקה. ודא כי חללית AFM מאובטחת בחוזקה אל מחזיק הבדיקה.
- חלק את מחזיק בדיקה על הסורק-Z הר של ראש AFM, ולהבטיח כי מחזיק הבדיקה מחוברת היטב.
4. יישור לייזר על Probe
- פתח את תוכנת AFM. בחר את סוג הניסוי על התוכנה; קטגורית ניסוי לפנות מצב, קבוצת ניסוי לפנות מצב בנוזל ואת הניסוי לפנות מצב בנוזל. לחץ על 'טען experiment של התוכנה; זה יהפוך את הלייזר.
- הוסף 3 מ"ל של מים מזוקקים כדי בצלחת תחתית זכוכית 50 מ"מ ומניחים את התבנית על הבמה של יחידת יישור לייזר. יחידה זו מפשטת את התהליך של התמקדות את קרן הלייזר על חלקו האחורי של שלוחה.
- הר הראש AFM בתנוחה זקופה על יחידת יישור לייזר וכוח על יחידת יישור לייזר. להוסיף כ 50 μl של מים מזוקקים כדי ליצור אגל על קצה AFM.
- באמצעות ג'ויסטיק, מנמיכים את הראש AFM כך קצה AFM עושה במגע עם מים בצלחת. אם איש הקשר אינו בין קצה AFM ומים בצלחת, בעדינות להרים את המנה עד שייוצר מגע. התאם את המיקוד, בהירות ומצב XY כך קצה AFM נמצא בתצוגה במסך LCD של יחידת היישור.
- מקם את מקום הליזר על הקצה של חללית AFM על ידי התאמת ידיות מיצוב ליזר של ראש AFM. באמצעות ידיות מיצוב גלאי על ראש AFM, להתאים את המניחיםיון של פוטודיודה עד ערכים בין 0 ל -1 V מתקבל על ההטיה האנכית ו ~ 0 V מתקבל עבור הסטייה האופקית.
- בדוק כדי לוודא את אות סכום ליזר מוגדלת. במידת הצורך, חזור על שלב 4.5 להתאים מחדש את עמדת קרן הלייזר על קצה AFM ואת המיקום של פוטודיודה להשיג את האות הסכום המרבי.
הערה: ייתכן ותהיה צורך במיקום מחדש את חללית AFM על מחזיק בדיקה כדי לקבל אות סכום מרבית גם אם צעד 4.5 חוזר על עצמו.
5. כיול קונסטנט רגישות ההסטה והאביב של חללית AFM
- הפוך שריטה על צלחת תרבות 60 מ"מ עם המלקחיים ולמלא את המנה עם מים מזוקקים. מניחים את צלחת תרבות על הצלחת בעל המדגם. במקרה זה, לעגן את המנה על במת סריקת XY הממונע של מיקרוסקופ הפוכה.
- מניח בעל צלחת מגנטית על גבי הצלחת על מנת להגן עליהם במהלך הדמיה.
- נְקִישָׁה חץ'למעלה' בתפריט הניווט בתוכנה כדי להזיז את ראש AFM עד כמעט המיקום הגבוה ביותר שלה על מנת להבטיח כי חללית AFM לא תיגע המנה.
הערה: שלב זה הוא מאוד חשוב כמו זה ימנע שבירת קצה AFM. - מניחים את הראש AFM על הבמה מיקרוסקופ.
- השתמש במיקרוסקופ כדי להתמקד השריטה על הצלחת. השתמש בג'ויסטיק, או לחץ על החץ "למטה" בתפריט הניווט, להנמיך את החללית AFM לאט ובזהירות לתוך PBS. מקם את הראש מעט מעל השריטה בצלחת.
הערה: אם העמדה הראשונית של ראש AFM היא קרובה המדגם, לעסוק זמן יופחת באופן משמעותי. - לפני העוסקים, מחדש להתאים את המיקום של קרן לייזר על קצה AFM ואת המיקום של פוטודיודה להשיג את האות הסכום המירבי לפי הצורך.
- בחר סוג טיפ ידי לחיצת Probe השינוי בתפריט Setup.
- לחץ על בדוק פרמטרים וכן להגדיר את הפרמטרים: סריקת גודל 0, קצב סריקה עד 1 רץ, לדוגמא / קו 256 הסטייה setpoint 20 ננומטר. לחץ Engage. חלון סטטוס Engage יישאר פתוח עד החללית יוצרת קשר עם פני השטח של הצלחת. לאחר שהפעיל את החללית, לחץ רמפה.
- לחץ מורחב מצב בתפריט סרגל כלי סריקה וכן להגדיר את הפרמטרים: גודל רמפה כדי בין 500 ננומטר ו -1 מיקרומטר, שיעור רמפה עד 2 הרץ, מספר דוגמאות ל -256, טיפ רדיוס 500 ננומטר, יחס סאמפל פואסון 0.5 (מניח את החומר כדי להימדד הוא בלתי דחיס באופן מושלם), זווית חצי עצה 0, טריגר מצב לסף יחסית וטריגר כדי ננומטר בין 20 ל -100.
- לחץ כבש רציף בתפריט סרגל הכלים הרמפה כדי obtaבעיקול כוח על (איור 3 א) הצלחת. ב עקומת הכוח הזה, להגדיר ערוץ 1 טעות סטיה.
הערה: זה יאפשר את התוכנה כדי גרפה את התוצאות כפי הטיה אנכית כפונקציה של מיקום z.- לחץ בקצות שמאלה או ימינה של עקומת כוח וגרור את הסמן על מנת להקיף באזור הליניארי של עקומת כוח (איור 3 א, קווים אדומים מקווקו). השתמש בשתי שורות אלה כדי לסמן את גבולות האזור המשופע להיות בכושר עם קו ישר.
- בחר Ramp בסרגל הכלים ולחץ רגישות Update. רשום את הערך וחזור על שלב זה עוד ארבע פעמים. בחר כיול בסרגל הכלים ולאחר מכן לחץ על גלאי. קלט ערך ממוצע של חמש מדידות בתיבת רגישות הסטה.
- לחץ על בטל 2 - 3 פעמים כדי להעלות את ראש AFM. שלב זה חשוב כדי למנועאינטראקציה בין קצה AFM ואת הצלחת במהלך תהליך המנגינה התרמי. לחץ Tune תרמי בסרגל הכלים.
- הגדר טווח Tune תרמי של 1 - 100 kHz (מידע זה ניתן לקבל את הקטלוג של היצרן) ו תיקון רגישות הסטה כדי 1.144 עבור cantilevers בצורת V ו 1.106 עבור cantilevers מלבני.
- בתפריט Tune התרמי, לחץ רוכשים את הנתונים כדי לקבל עקומת מנגינת תרמית (איור 3 ב). שימוש בתוכנת AFM, אדום במקום קווים מקווקווים משני צדים העקומים (כפי שמוצג באיור 3 ב) על ידי גרירת העכבר מקצה הגרף להגדיר את הגבולות עבור הולם. בחר באחת האפשרויות הלורנצי (מיזוג) או מתנד הרמוני פשוט (נוזל) מודל תלוי באיזה שיתאים יותר נתונים.
- לחץ נתוני Fit, ואז לחשב האביב K ולשמור על ערך זה. מִחָדָשׁ כבול כיולים באביב קבוע מספר פעמים ולהשתמש הערך הממוצע. לחץ על בטל כמה פעמים.
- הסר את ראש AFM משלב מיקרוסקופ ומניח אותו על יחידת היישור. מוציאים את המאפה משלב מיקרוסקופ.
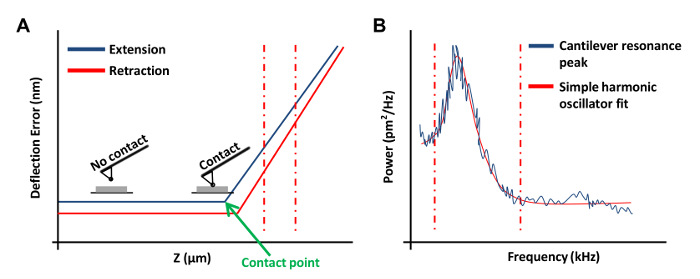
איור 3: עקומות חיל AFM ששימשו כיול של בדיקות AFM. (א) עקומת כוח AFM נציג (עקומת כיול). החלק הרחב של עקומת הכח בין אדום האנך קווים מהקווקווים שמשו כדי לקבוע את רגישות סטיית שלוחה. (ב) גרף בכושר מתנד ההרמוני פשוט להשתמש כדי לחשב את קבוע הקפיץ של השלוחה כפי שתואר לעיל 20. אנא לחץ כאן לצפייה גרסה גדולה יותר של דמות זו.
התחת = "jove_title"> 6. מדידת מודולוס האלסטיות על עורקי עכבר Ex Vivo
- מניח את צלחת תרבות 60 מ"מ המכילה את הרקמות העורקים על במת מיקרוסקופ, ולאבטח את הצלחת עם בעל צלחת המגנטי.
- מניחים את הראש AFM על הבמה מיקרוסקופ. ודא כי חללית AFM לא ליצור קשר עם אב העורקים אך בעדינות יוצרת קשר עם PBS ויוצרת המניסקוס. במידת הצורך, מקום ראש AFM על יחידת יישור ולחץ משיכה עד שיש מספיק אישור כדי למנוע מגע, ולאחר מכן למקם את הראש AFM על הבמה מיקרוסקופ.
- לחץ נווט. באמצעות ג'ויסטיק או לחיצה 'Down' חץ, לאט לאט להוריד את החללית AFM לאתר שלוחה מעל אבי העורקים. לשנות את מיקום פוטודיודה באמצעות ידיות מיצוב גלאי על הראש AFM במידת הצורך.
- לחץ Engage לאפשר שלוחה ליצור קשר עם אבי העורקים.
- פעם האב עורקים עוסקים, להבטיח שמרכז פייזו יציב ולחץ רמפה. אם מרכז piezo הוא משתנה, זה עשוי להיות התוצאה של מעורבות שווא. למשוך את החללית ולהגדיל את ההיסט האנכי של הלייזר על פוטודיודה בתוספות קטנות (~ 0.5 V) ושלב מחדש.
- כמו כן, אם החללית היא הרבה מעל פני השטח המדגמים, באופן ידני להוריד את החללית קרובה לפני השטח המדגם לפני מחדש ומרתק. אם השלבים הקודמים לא מבטלים את התנודות, נסה להחליף את החללית.
- הגדר את גודל הרמפה עד 3 מיקרומטר, על הדק המצב כדי יחסית ועל סף טריגר ל -100 ננומטר ולחץ כבש רציף. שים לב כי נקודת המגע בין החללית לבין המדגם מתרחשת בערך במרכז לנמוך ¾ של מחזור רמפת Z. אם זה לא הוא ציין, להתנתק מן המדגם, להתאים את גודל Ramp לפי הצורך, מחדש לעסוק המדגם.
- לחץ מיקרוסקופ בשורת התפריטים ולאחר מכן לעסוק הגדרות. שנה את SPM משיכה ל -30 מיקרומטר. לחץ כבש רציף בתפריט סרגל כלי רמפה.
- לאחר התבוננות עקומת כוח, לחץ לכידת בשורת התפריטים ולאחר מכן ללכוד שם הקובץ. זן שם קובץ רצוי עם הסיומת ".000" (זה יאפשר קבצים שנתפסו נוספים להגדלת המספר ב -1). בחר תיקייה מיועדת ולשמור את הנתונים.
- לחץ לכיד בתפריט סרגל הכלים הלכידים. לחץ על בטל ולאחר מכן נווט. השתמש בפקדים ג'ויסטיק או תוכנה כדי למקם השלוחה מעל לאזור אחר של אב העורקים (ליד הנקודה נמדדה לראשונה, ראה איור 4).
- לחץ Engage, רמפה, ואת הכבש רציף, בהתאמה. לאחר התבוננות עקומת כוח, לחץ על הפסק ולכוד.
- חזור על שלבים 6.9 - 6.10. לכידת לפחות 5 מדידות לכל אזור כפי שמוצג באיור 4 הערה: אנחנו בדרך כלל לאסוף 15 - 25 עקומות בתוקף מיום 3 - 5 מיקומים שונים בכל רקמות כפי שמוצג באיור 4, בהתאמה..
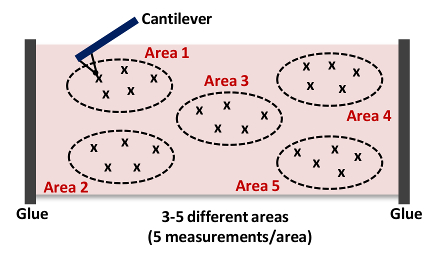
. איור 4: קריקטורה של שלוחה מתקרב הפנמה לכל הרקמות (אזור 1) זה מדידת AFM חוזרת עד 15 - 25 פעמים מ 3 - 5 מיקומים שונים (תחומים 1 - 5) בכל עורק לרכוש את הנוקשות של כללי דגימת רקמה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ניתוח 7. נתונים
- תוכנת ניתוח עקומת כוח להרחיב.
- Clמצא להרחיב איכס בשורת התפריטים, ולחץ לחיצה כפולה על קובץ להיות מנותחת.
- לחץ על פרמטרי חיל שינוי בתפריט הכלים כדי לבדוק את רגישות הסטייה, קבוע קפיץ, טיפ רדיוס, טיפ חצי זווית ו Poisson של היחס. כדי לשנות את הפרמטרים סמנו את התיבה לצד זה ומזינים את הערכים הנכונים בעמודת הערך החדשה. לאחר מכן לחץ על ביצוע.
- אם עקומות כוח הם רועשים, לחץ על מסנן Boxcar ולהגדיר תשומות כיוון להאריך, נקודות ממוצעות כדי להזמין 3 ומסנן ל -0 ה. לחץ על בצע כדי להחליק את הנתונים.
- לחץ תיקון בסיס בשורת התפריטים ולהגדיר תשומות כיוון להאריך, יחידות מזימת החיל, סוג כדי הפרדה, להזמין תיקון ל -1 st ולהרחיב מקור Baseline כדי להרחיב. התאם את הקווים הכחולים המקווקוים האנכיים להקיף את החלק הקבוע של עקומת כוח ולאחר מכן לחץ על ביצוע.
- לחץ הזחה בתפריט הכלים ולהגדיר תשומות Curve פעילים Extended, שיטת Fit to נקודת מגע מבוסס, אלגוריתם נקודת קשר לטיפול משתנה כמו Fit, כלול חיל הידבקות לא, מקס חיל Fit גבול עד 30%, מינימום חיל Fit גבול 0% ו דגם Fit to Hertzian (שסתומים).
הערה: המדידות שלנו, הדבקה משמעותית בין העצה לבין המדגם (סטייה שלילית של השלוחה בעקום ההכחשה) לעתים רחוקות נצפתה. במקרים בהם הידבקות כזה הוא ציין, המודל המתאים (DMT או JKR) אמור לשמש לניתוח 18,19. - שמור את הערכים של מודולוס של יאנג. נתח את מודולוס (אלסטי) של יאנג של כל אחת 3- 5 אזורים (5 עקומות כוח ליחידת שטח) נלקחו במרחק קטן זה מזה כפי שמוצג באיור 4.
הערה: כדי להסיר חפצים, לכלול moduli של יאנג> 100 kPa (בדרך כלל ~ 10% של מדידות סה"כ) מניתוח. - חישוב ערך מודול יאנג ממוצע עבור כל אחד 3 - 5 האזורים (אשר נמדדים בהתאם) ולהשתמש ערכים אלה כדי לחשב מודולוס אלסטיות ממוצעים האאורטה בכללותה.
הערה: לפחות 3 ויותר פעמים 4 - 6 aortas הפרט משמשים כדי להשיג הערכה מדויקת של קשיות העורקים. התוצאות הסופיות הם זממו כמו ממוצע + SEM של "n" ניסויים בלתי תלויים. המספר המדויק של aortas הדרוש יהיה, כמובן, תלוי ברמת דיוק הנדרשת.
Access restricted. Please log in or start a trial to view this content.
תוצאות
איור 5 א מראה תמונה בניגוד שלב של אב העורקים היורד (חזה) מילדה בת 6 חודשים, עכבר C57BL / 6 גברים. שלוחת AFM היא במקום ישירות מעל הרקמה ומוכנה זחה. 5B הדמוי ו -5 ג להפגין עקומות כוח נציג מתקבלות על ידי זחת AFM במצב מגע. קווים ירוקים שמוצגים איורי 5 ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
כניסת AFM יכול לשמש כדי לאפיין את הנוקשות (מודולוס אלסטיות) של תאים ורקמות. במאמר זה, אנו מספקים פרוטוקולים צעד-אחר-צעד מפורט לבודד את אבי העורקים היורד ואת קשת אבי העורקים בתוך העכבר ולקבוע את moduli אלסטי של אזורים עורקים אלה vivo לשעבר. אנחנו עכשיו לסכם ולדון בסוגיות ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
References
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved