È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurare la rigidità
In questo articolo
Riepilogo
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Abstract
irrigidimento arteriosa è un fattore di rischio significativo e biomarker per malattie cardiovascolari e un segno distintivo di invecchiamento. Microscopia a forza atomica (AFM) è uno strumento analitico versatile per la caratterizzazione viscoelastiche proprietà meccaniche per una varietà di materiali che vanno dal disco (plastica, vetro, metallo, ecc) le superfici di celle su qualsiasi substrato. È stato ampiamente utilizzato per misurare la rigidità delle cellule, ma usato meno frequentemente per misurare la rigidità di aorte. In questo articolo, descriveremo le procedure per l'utilizzo in modalità AFM contatto per misurare la ex vivo modulo elastico delle arterie scaricati mouse. Descriviamo la nostra procedura per l'isolamento di aorte del mouse, e quindi fornendo informazioni dettagliate per l'analisi AFM. Questo include le istruzioni passo-passo per l'allineamento del raggio laser, la taratura della costante della molla e la sensibilità deflessione della sonda AFM, e l'acquisizione di curve di forza. Forniamo anche un protocollo dettagliato per analy datisis delle curve di forza.
Introduzione
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocollo
lavori di animali in questo studio è stato approvato dai comitati cura e l'uso istituzionale animali della University of Pennsylvania. I metodi sono stati eseguiti in conformità con le linee guida approvate.
1. Preparare il mouse e isolamento dell'aorta
- Anestetizzare un mouse con ketamina (80 - 100 mg / kg), xilazina (8 - 10 mg / kg) e acepromazine (1 - 2 mg / kg) per via intraperitoneale. Confermare l'anestesia con un test coda pizzico. Una volta che il mouse è completamente anestetizzato, eutanasia il mouse dislocazione cervicale.
- Posizionare il mouse sul dorso e il pin il mouse in una tavola di dissezione. Pulire la zona addominale con il 70% (v / v) di etanolo salviette.
- Pizzicare la pelle a metà-line e fare una piccola incisione iniziale con le forbici microchirurgia medie dimensioni presso l'addome. Tenendo la pelle con una pinza, usare le forbici microchirurgia di medie dimensioni per tagliare la pelle e del peritoneo dall'addome allo sterno.
- Tagliare le costole di blati OTH con le forbici microchirurgia di medie dimensioni. Rimuovere con attenzione i polmoni e il fegato con piccole forbici microchirurgia dimensioni, e lasciare il cuore e l'aorta. Trasferire il mouse e tavola di dissezione di un microscopio da dissezione.
- Afferrare il grasso che circonda l'aorta con piccole pinze e usare piccole forbici per tagliare accuratamente il grasso intorno all'aorta.
- afferrare delicatamente l'aorta con una pinza, fare un'alzata con piccole forbici microchirurgia dimensioni all'inizio dell'aorta ascendente e un altro taglio alla fine dell'aorta discendente, appena sopra l'aorta addominale.
- Trasferire l'aorta dissecata ad un piatto di 60 mm contenente 1x tampone fosfato salino (PBS; senza calcio e magnesio).
- Continuare a sezionare via qualsiasi tessuto adiposo rimanente dall'aorta utilizzando piccole forbici microchirurgia dimensioni. Utilizzare piccole forbici per aprire l'aorta longitudinalmente.
- Utilizzare piccole forbici microchirurgia dimensioni per tagliare un piccolo pezzo (~ 2 x 4 mm) dell'aorta discendente e aortic arco per l'analisi AFM (Figura 1). Posizionare il tessuto in un piatto di plastica di 60 mm e mantenerlo umido in una goccia di PBS.
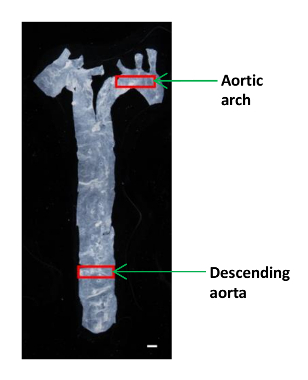
Figura 1:. Un'immagine che mostra la posizione dei diversi segmenti aortici in un mouse L'aorta è stato isolato dal cuore al diaframma, e una piccola porzione dell'aorta discendente e l'arco aortico sono stati usati per determinare i moduli elastici. Barra di scala, 1 mm. Clicca qui per vedere una versione più grande di questa figura.
2. Preparazione campioni di tessuto per le misurazioni AFM
- Rimuovere con attenzione il PBS con un laboratorio-wipe senza toccare l'aorta. Assicurarsi che il lato luminale del tessuto rivolto verso l'alto.
- colla delicatamente ogni estremità dell'aorta aperto alla piastra add ing 5 - 10 ml di cianoacrilato con una punta di gel-loading (Figura 2).
NOTA: La quantità di colla necessaria per fissare saldamente il tessuto a ciascuna estremità deve essere determinato empiricamente. E 'fondamentale che l'aorta non è allungata durante questo processo. - Controllare l'aorta incollato per accertarsi che non sia piegato o variabile. Dopo air-essiccamento della colla sulla dell'aorta (30 - 60 a sec), aggiungere delicatamente PBS e immergere il campione.
NOTA: Preparazione della AFM (passi 3-5) può essere effettuata mentre il tessuto è in fase di preparazione per l'analisi.

Figura 2: Fumetto di un segmento aortico incollati su un piatto di coltura di 60 mm utilizzando cianoacrilato L'adesivo cianoacrilato viene applicato sul bordo di un campione aortica in preparazione per misure AFM..com / file / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
3. Inserimento della sonda
- Montare un supporto sonda fluido sul supporto di carico della sonda.
- Con una pinzetta, far scorrere una sonda AFM nitruro di silicio (0,06 N / m cantilever) con una punta sferica (abbiamo usato un diametro di 1 micron SiO 2 particella, ma dimensioni maggiori possono essere utilizzati anche) sul supporto della sonda. Assicurarsi che la sonda AFM sia saldamente fissata al supporto sonda.
- Far scorrere il supporto della sonda sul Z-scanner montaggio della testa AFM, e assicurarsi che il supporto della sonda sia fissata saldamente.
4. Allineamento del laser sulla sonda
- Aprire il software AFM. Scegliere il tipo di esperimento sul software; Experiment Categoria di Contatto Mode, Esperimento Gruppo di Contatto Modalità nel liquido e prove per contattare la modalità nel liquido. Fare clic su Carica experiment nel software; questo si accende il laser.
- Aggiungere 3 ml di acqua distillata in un piatto fondo di vetro da 50 mm e posizionare il piatto sul palco dell'unità allineamento laser. Questa unità semplifica il processo di focalizzazione del fascio laser sul retro del cantilever.
- Montare la testa AFM in posizione verticale sul gruppo di allineamento laser e accendere l'unità di allineamento laser. Aggiungere circa 50 ml di acqua distillata per formare una gocciolina sulla punta AFM.
- Utilizzando il joystick, abbassare la testa AFM modo che la punta AFM fa contatto con l'acqua nel piatto. Se il contatto non è fatta tra la punta AFM e l'acqua nel piatto, sollevare leggermente il piatto fino a quando avviene il contatto. Regolare la messa a fuoco, la luminosità e la posizione XY in modo che la punta AFM è in vista sullo schermo LCD dell'unità di allineamento.
- Posizionare il punto laser sulla punta della sonda AFM regolando le manopole di posizionamento laser della testa AFM. Usando le manopole di posizionamento del rivelatore sulla testa AFM, regolare il positione del fotodiodo fino valori tra 0 e -1 V sono ottenuti per la deflessione verticale e ~ 0 V si ottiene per la deflessione orizzontale.
- Verificare il segnale di somma laser viene massimizzata. Se necessario, ripetere il punto 4.5 di ri-regolare la posizione del raggio laser sulla punta AFM e la posizione del fotodiodo per ottenere il massimo segnale somma.
NOTA: Può essere necessario riposizionare la sonda AFM sul supporto della sonda per ottenere un segnale somma massima anche se passo 4.5 si ripete.
5. Calibrare il flessione costante sensibilità e la primavera del AFM Probe
- Fare un graffio su un piatto di coltura di 60 mm con una pinza e riempire il piatto con acqua distillata. Porre la capsula cultura sulla piastra di supporto del campione. In questo caso, montare il piatto sul motorizzata XY scansione di un microscopio invertito.
- Posizionare un supporto piastra magnetica sulla parte superiore della piastra per mantenerlo sicuro durante l'imaging.
- Clic Freccia 'Up' nel menu di navigazione del software per spostare la testa AFM fino a quasi nella posizione più alta per garantire che la sonda AFM non toccherà il piatto.
NOTA: Questo passaggio è molto importante in quanto evita la rottura della punta AFM. - Mettere la testa AFM sul palco microscopio.
- Utilizzare il microscopio a concentrarsi sulla graffiatura sulla piastra. Utilizzare il joystick, oppure fare clic sulla freccia 'Down' nel menu di navigazione, a lentamente e con attenzione abbassare la sonda AFM in PBS. Posizionare la testa leggermente sopra il graffio nella piastra.
NOTA: Se la posizione iniziale della testa AFM è più vicino al campione, il tempo di impegnarsi sarà notevolmente ridotto. - Prima di inserire, ri-regolare la posizione del raggio laser sulla punta AFM e la posizione del fotodiodo per ottenere il massimo segnale SUM come necessario.
- Selezionare un tipo di punta facendo clic su Modifica sonda nel menu di configurazione.
- Fare clic su Verifica dei parametri e impostare i parametri: Scansione Dimensioni a 0, Velocità di scansione a 1 Hz, Campione / linea di 256 e deviazione setpoint a 20 nm. Clicca Engage. La finestra Engage Stato rimarrà aperta finché la sonda fa contatto con la superficie della piastra. Dopo coinvolgente la sonda, fare clic su rampa.
- Fare clic su Expanded Modalità nel menu di scansione Toolbar e impostare i parametri: Rampa dimensione compresa tra 500 nm e 1 micron, Ramp Rate a 2 Hz, numero di campioni da 256, Tip Raggio a 500 nm, rapporto campione di Poisson a 0,5 (assume il materiale da misurare è perfettamente incomprimibile), Tip Mezza angolo a 0, trigger Mode di relativa e Soglia di intervento a tra 20 e 100 nm.
- Fai clic su Rampa continuo nel menu Rampa Barra degli strumenti per obtain una curva forza sulla piastra (Figura 3A). In questa curva forza, impostare il canale 1 di un errore di deviazione.
NOTA: In questo modo il software per rappresentare graficamente i risultati come deflessione verticale vs posizione z.- Fare clic alle estremità sinistra o destra della curva di forza e trascinare il cursore per comprendere una regione lineare della curva di forza (Figura 3a, tratteggiate linee rosse). Utilizzare queste due linee per segnare i confini della regione inclinato di essere in forma di una linea retta.
- Selezionare Rampa nella barra degli strumenti e fare clic su Aggiorna sensibilità. Registrare il valore e ripetere questo passaggio altre quattro volte. Selezionare Calibra nella barra degli strumenti e quindi fare clic su Detector. Ingresso un valore medio dei cinque misurazioni nella casella di deflessione sensibilità.
- Fare clic su Ritira 2 - 3 volte a sollevare la testa AFM. Questo passo è importante per evitareinterazione tra la punta AFM e la piastra durante il processo di sintonia termica. Clicca Tune termica nella barra degli strumenti.
- Impostare termica Gamma Tune di 1 - 100 kHz (Queste informazioni possono essere ottenute dal catalogo del produttore) e deviazione di correzione sensibilità al 1,144 per cantilever a forma di V e 1.106 per cantilever rettangolari.
- Nel menu Tune termica, fare clic su Acquisire dati per ottenere una curva di sintonia termica (Figura 3B). Utilizzando il software AFM, posto rossa tratteggiata linee su entrambi i lati della curva (come mostrato in figura 3B) trascinando il mouse dal bordo del grafico per definire i limiti per il montaggio. Selezionare il Lorentziano (Air) o il modello semplice oscillatore armonico (fluido) a seconda di quale meglio si adatta ai dati.
- Fare clic su Adatta dati, quindi calcolare molla K e salvare questo valore. Ritorba primavera calibrazioni costante più volte e utilizzare il valore medio. Clicca Estrarre più volte.
- Rimuovere la testa AFM dal palco microscopio e posizionarlo sull'unità di allineamento. Togliere il piatto dal palco microscopio.
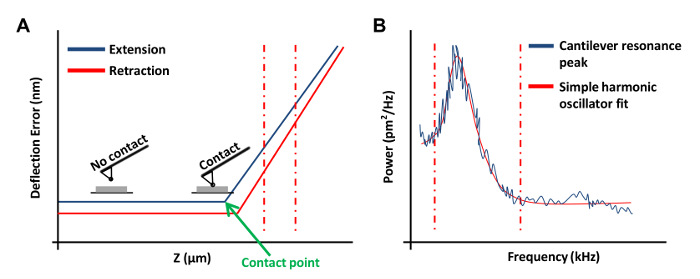
Figura 3: AFM Forza Curve utilizzati per la taratura di sonde AFM. (A) Una curva forza AFM rappresentante (curva di calibrazione). La porzione di estensione della curva di forza tra il rosso verticale linee tratteggiate è stato utilizzato per determinare la sensibilità a sbalzo flessione. (B) Un semplice oscillatore armonico grafico in forma usata per calcolare la costante elastica del cantilever come descritto in precedenza 20. Clicca qui per vedere una versione più grande di questa figura.
6. Misurare il modulo elastico sulle grandi strade mouse ex vivo
- Posizionare il piatto di coltura di 60 mm contenente il tessuto aortico sul palco microscopio, e fissare la piastra con il supporto piastra magnetica.
- Mettere la testa AFM sul palco microscopio. Assicurarsi che la sonda AFM non entrare in contatto con l'aorta ma delicatamente entra in contatto con PBS e forma un menisco. Se necessario, posizionare la testa AFM sull'unità allineamento e fare clic su Ritira fino a quando non vi è abbastanza spazio per evitare il contatto, quindi posizionare la testa AFM sul palco microscopio.
- Clicca Naviga. Utilizzando il joystick o cliccando 'Down' freccia, abbassare lentamente la sonda AFM per individuare la mensola sopra l'aorta. Regolare la posizione fotodiodo utilizzando le manopole di posizionamento del rivelatore sulla testa AFM, se necessario.
- Scegliere Engage per consentire il cantilever di entrare in contatto con l'aorta.
- Una volta che ilaorta è impegnato, in modo che il centro piezo è stabile e fare clic su rampa. Se il centro piezo è fluttuante, questo può essere il risultato di una falsa impegno. Estrarre la sonda e aumentare l'offset del laser verticale sul fotodiodo di piccoli incrementi (~ 0,5 V) e coinvolgere nuovamente.
- Inoltre, se la sonda è molto al di sopra della superficie del campione, abbassare manualmente la sonda più vicino alla superficie del campione prima di nuovo la marcia. Se i passaggi precedenti non eliminano la fluttuazione, provare a scambiare la sonda.
- Impostare la rampa dimensione di 3 micron, il Trigger Mode al relativo e la soglia di intervento a 100 nm e fare clic su rampa continua. Osservare che il punto di contatto tra la sonda e il campione avviene approssimativamente al centro al minore ¾ del ciclo Z rampa. Se questa non viene rispettata, disimpegnarsi dal campione, regolare le dimensioni di rampa, se necessario, e coinvolgere nuovamente il campione.
- Fare clic Microscopio nella barra dei menu e poi impegnarsi Impostazioni. Cambiare la SPM Prelievo di 30 micron. Fai clic su Rampa continuo nel menu rampa barra degli strumenti.
- Dopo aver osservato la curva di forza, fare clic su Cattura nella barra dei menu e quindi acquisire Nome file. Inserire un nome di file desiderato con il finale ".000" (questo permetterà file acquisiti aggiuntivi ad aumentare di numero da 1). Selezionare una cartella designata e salvare i dati.
- Fare clic Capture nel menu Cattura barra degli strumenti. Clicca Ritirare e quindi passare. Utilizzare il joystick o controlli software per posizionare il cantilever a un'altra area dell'aorta (vicino al punto inizialmente misurata; vedi Figura 4).
- Fare clic Engage, Rampa, e rampa continuo, rispettivamente. Dopo aver osservato la curva di forza, fare clic su Stop e quindi acquisire.
- Ripetere i passaggi 6,9-6,10. Cattura almeno 5 misurazioni al settore come mostrato in Figura 4 NOTA: tipicamente raccolte 15 - 25 curve di forza da 3 - 5 posizioni differenti in ogni tessuto come mostrato in Figura 4, rispettivamente..
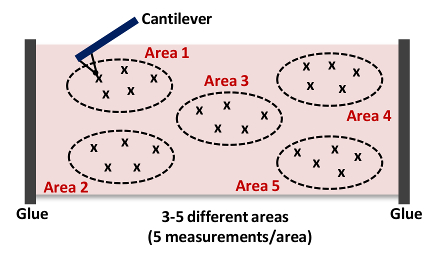
. Figura 4: Fumetto di un cantilever avvicina e Rientro del Tissue (Area 1) Questa misura AFM viene ripetuta fino a 15 - 25 volte da 3 - 5 luoghi diversi (Zone 1 - 5) in ogni arteria di acquisire la rigidità del complesso campione di tessuto. cliccate qui per vedere una versione più grande di questa figura.
Analisi 7. I dati
- Aprire forza software di analisi della curva.
- Click trovare e aprire nella barra dei menu, e fare doppio clic su un file da analizzare.
- Fai clic su Modifica Forza i parametri nel menu della barra degli strumenti per controllare la sensibilità di deviazione, di Costante molla, Tip Radius, Tip mezzo angolo e Poisson. Per modificare i parametri di controllare la casella accanto ad esso e inserire i valori corretti nella nuova colonna valore. Quindi fare clic su Esegui.
- Se curve di spinta sono rumorosi, clicca Boxcar filtro e impostare gli ingressi per la direzione per estendere, Media Punti a 3 e Ordine del filtro a 0 °. Fare clic su Esegui per lisciare i dati.
- Clicca correzione al basale nella barra dei menu e impostare gli ingressi per la direzione da estendere, Unità complotto per forza, tipo di separazione, la correzione al fine di 1 ° e Estendere Baseline Fonte estendere. Regolare le linee blu tratteggiate verticali fino a comprendere la parte piatta della curva di forza e quindi fare clic su Esegui.
- Fare clic rientro nel menu della barra degli strumenti e impostare ingressi per curva attiva Extended, metodo di adattamento al punto di contatto Based, Punto di contatto Algoritmo a trattare come Fit variabile, Includi Adesione Forza No, Max Forza Fit Boundary al 30%, min Forza Fit Boundary a 0% e Adatta modello di Hertz (sferica).
NOTA: Nelle nostre misurazioni, significativa adesione tra la punta e il campione (una deviazione negativa del cantilever nella curva retrazione) è stata raramente osservata. Nei casi in cui si osserva tale adesione, il modello appropriato (DMT o JKR) deve essere utilizzato per l'analisi 18,19. - Salvare i valori del modulo di Young. Analizzare (elastico) modulo di Young di ciascuno dei 3- 5 aree (curve 5 forza per area) adottate entro una piccola distanza l'uno dall'altro, come mostrato in figura 4.
NOTA: Per rimuovere gli artefatti, escludere di Young moduli> 100 kPa (normalmente ~ 10% delle misurazioni totali) dall'analisi. - Calcolare un valore del modulo di Young medio per ciascuno dei 3 - 5 aree (che sono stati misurati) e utilizzare questi valori per calcolare il modulo elastico medio per l'aorta nel suo complesso.
NOTA: Almeno 3 e più spesso 4 - 6 singoli aorte vengono utilizzati per ottenere una valutazione accurata della rigidità arteriosa. I risultati finali sono riportati come media + SEM di "n" esperimenti indipendenti. Il numero esatto di aorte necessari, ovviamente, dipende dal livello di accuratezza richiesto.
Access restricted. Please log in or start a trial to view this content.
Risultati
La figura 5A mostra un'immagine a contrasto di fase dell'aorta discendente (toracica) da un 6 mesi di età, di sesso maschile C57BL / 6 del mouse. Il cantilever AFM è posto direttamente sopra il tessuto e pronto per il rientro. Figure 5B e 5C mostrano curve rappresentative forza ottenuti mediante AFM rientranza in modalità contatto. Linee verdi mostrate nelle figure 5B e 5C rappresentano le migliori curve di adattamento ...
Access restricted. Please log in or start a trial to view this content.
Discussione
AFM indentazione può essere utilizzato per caratterizzare la rigidità (modulo elastico) di cellule e tessuti. In questo lavoro, forniamo dettagliate protocolli passo-passo per isolare l'aorta discendente e arco aortico nel topo e determinare il modulo elastico di queste regioni arteriosi ex vivo. Ora riassumere e discutere le questioni tecniche e le limitazioni del metodo descritto in questo articolo.
Diversi problemi tecnici possono sorgere in isolamento e l'analisi di to...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Riferimenti
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon