Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der Steifigkeit von
In diesem Artikel
Zusammenfassung
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Zusammenfassung
Arterielle Versteifung ist ein signifikanter Risikofaktor und Biomarker für Herz-Kreislauf-Erkrankungen und ein Markenzeichen des Alterns. Rasterkraftmikroskopie (AFM) ist ein vielseitiges Analysewerkzeug für viskoelastische mechanischen Eigenschaften für eine Vielzahl von Materialien zu charakterisieren die von harten (Kunststoff, Glas, Metall, etc.) Oberflächen auf Zellen , die auf jedem Untergrund. Es wurde in großem Umfang verwendet, um die Steifigkeit der Zellen zu messen, aber weniger häufig verwendet, um die Steifigkeit des Aorten messen. In diesem Beitrag werden wir die Verfahren für die Verwendung von AFM im Kontaktmodus beschreiben die ex vivo - Elastizitätsmodul von unbelastetem Maus Arterien zu messen. Wir beschreiben unsere Verfahren zur Isolierung von Maus Aorten und dann detaillierte Informationen für die AFM-Analyse liefern. Dazu gehören die Schritt-für-Schritt-Anleitungen für die Ausrichtung des Laserstrahls eine Kalibrierung der Federkonstante und Ablenkung Empfindlichkeit der AFM-Sonde, und den Erwerb von Kraftkurven. Wir bieten auch ein detailliertes Protokoll für die Daten Analysis der Kraftkurven.
Einleitung
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Tier Arbeit in dieser Studie wurde von den Institutional Animal Care und Verwenden Ausschüssen der University of Pennsylvania genehmigt. Die Verfahren wurden in Übereinstimmung mit den genehmigten Richtlinien durchgeführt.
1. Vorbereiten der Maus und Isolierung der Aorta
- Anästhesieren eine Maus mit Ketamin (80 - 100 mg / kg), Xylazin (8 - 10 mg / kg) und Acepromazin (1 - 2 mg / kg) intraperitoneal. Bestätigen Anästhesie mit einem Schwanz Kneiftest. Sobald die Maus vollständig betäubt, einschläfern die Maus durch Genickbruch.
- Platzieren Sie die Maus auf den Rücken und Pin mit der Maus auf eine Dissektion Bord. Reinigen Sie den Bauchbereich mit 70% (v / v) Ethanol wischt.
- Drücken Sie die Haut an der Mittellinie und machen einen kleinen anfänglichen Schnitt mit mittelgroßen Mikro Schere am Bauch. Während die Haut mit einer Pinzette halten, benutzen mittlere Schere Größe Mikrochirurgie die Haut und Bauchfell aus dem Bauch zum Brustbein zu schneiden.
- Schneiden Sie die Rippen auf b wegoth Seiten mit mittelgroßen Mikro Schere. Entfernen Sie vorsichtig die Lunge und Leber mit kleiner Größe Mikrochirurgie Schere, und das Herz und die Aorta verlassen. Übertragen Sie die Maus und Dissektion Bord zu einem Binokular.
- Fassen Sie das Fett, um die Aorta mit kleinen Zange umgibt und eine kleine Schere verwenden, um sorgfältig weggeschnitten Fett um die Aorta.
- greifen Sie vorsichtig die Aorta mit einer Pinzette, machen einen Schnitt mit kleiner Größe Mikrochirurgie Schere zu Beginn der Aorta ascendens und anderen Schnitt am Ende der absteigenden Aorta, direkt oberhalb der Bauchaorta.
- Übertragen die sezierten Aorta auf eine 60 mm-Schale mit 1x phosphatgepufferter Kochsalzlösung (PBS; ohne Calcium und Magnesium).
- Weiter alle verbleibenden Fettgewebe von der Aorta zu sezieren entfernt mit kleiner Größe Mikrochirurgie Schere. Verwenden Sie eine kleine Schere längs der Aorta zu öffnen.
- Verwenden Sie kleine Größe Mikrochirurgie Schere ein kleines Stück zu schneiden (ca. 2 x 4 mm) der absteigenden Aorta und aortic Bogen für AFM - Analyse (Abbildung 1). Legen Sie das Gewebe in einer 60-mm-Kunststoffschale und hält sie feucht in einem Tropfen PBS.
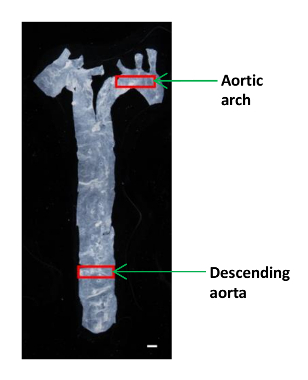
Abb . 1: Ein Bild zeigt den Standort der verschiedenen Aortic Segmente in einer Maus wurde die Aorta aus dem Herzen auf die Membran getrennt, und ein kleiner Teil der absteigenden Aorta und der Aortenbogen wurden verwendet , um die elastischen Module bestimmen. Maßstabsbalken, 1 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
2. Vorbereitung Gewebeproben für die AFM-Messungen
- Entfernen Sie vorsichtig die PBS ein Labor-wipe verwenden, ohne die Aorta zu berühren. Seien Sie sicher, dass die luminale Seite des Gewebes nach oben zeigt.
- kleben vorsichtig jedes Ende der geöffneten Aorta an der Platte durch Zusatz ing von 5 bis 10 & mgr; l Cyanacrylatkleber mit einem Gel-Ladespitze (Abbildung 2).
HINWEIS: Die Menge an Klebstoff benötigt , um fest in das Gewebe an jedem Ende anhängen muss empirisch ermittelt werden. Es ist wichtig, dass die Aorta während dieses Vorgangs nicht gedehnt wird. - Überprüfen Sie die geklebte Aorta, um sicherzustellen, dass es nicht gefaltet oder schwimmen. Nach dem Einschalten der Aorta den Leim Lufttrocknung (30 - 60 sec), sanft PBS hinzufügen und die Probe tauchen.
HINWEIS: Vorbereitung der AFM (Schritte 3-5) durchgeführt werden kann , während das Gewebe für die Analyse vorbereitet.

Abbildung 2: Karikatur eines Aorten - Segment Geklebt auf eine 60-mm - Kulturschale mit Cyanacrylatkleber Der Cyanacrylat - Klebstoff auf den Rand einer Aorten - Probe in Vorbereitung auf die AFM - Messungen angewendet wird..com / files / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
3. Laden der Probe
- Montieren Sie einen Flüssigkeitssondenhalter auf die Sonde Last Stand.
- Auf dem Sondenhalter mit Hilfe einer Pinzette, schieben Sie eine Siliziumnitrid AFM - Sonde (0,06 N / m Ausleger) mit einer kugelförmigen Spitze (eine 1 & mgr; m Durchmesser SiO 2 Partikel aber auch größere Größen können auch verwendet werden , haben wir verwendet). Stellen Sie sicher, dass die AFM-Sonde fest mit dem Sondenhalter befestigt ist.
- Schieben Sie den Sondenhalter auf der Z-Scanner Halterung des AFM Kopf, und sicherzustellen, dass die Sondenhalter sicher befestigt ist.
4. Ausrichten des Laser auf der Probe
- Öffnen Sie die AFM-Software. Wählen Sie das Experiment Typ auf der Software; Experiment Kategorie Kontakt - Modus, Experiment Gruppenmodus in Flüssigkeit und Experiment zu Kontaktmodus in Flüssigkeit in Verbindung zu treten. Klicken Sie auf Laden experiment in der Software; Dies wird auf dem Laser einzuschalten.
- 3 ml destilliertem Wasser auf eine 50-mm-Glasbodenschale und die Schale auf der Bühne des Laserausrichtungseinheit. Diese Einheit vereinfacht den Prozess, den Laserstrahl auf die Rückseite des Auslegers zu konzentrieren.
- Montieren Sie die AFM-Kopf in einer aufrechten Position auf der Laserausrichtung Einheit und Leistung auf der Laserausrichtung Einheit. Etwa 50 & mgr; l destilliertes Wasser ein Tröpfchen auf der AFM-Spitze zu bilden.
- Mit dem Joystick, senken Sie die AFM-Kopf, so dass die AFM-Spitze in der Schale Kontakt mit Wasser macht. Wenn der Kontakt zwischen der AFM-Spitze und Wasser in der Schale nicht gemacht wird, heben Sie vorsichtig die Schale, bis der Kontakt hergestellt ist. Stellen Sie den Fokus, Helligkeit und XY-Position, so dass die AFM-Spitze auf dem LCD-Bildschirm der Ausrichteinheit in Sicht ist.
- Positionieren Sie den Laserpunkt auf der Spitze des AFM-Sonde durch eine Anpassung der Laserpositionierung Knöpfe des AFM Kopf. Mit Hilfe der Detektorpositionierung Noppen auf der AFM-Kopf, stellen Sie die postulierenIonen der Photodiode, bis Werte zwischen 0 und -1 V für die vertikale Ablenkung erhalten und ~ 0 V für die Horizontalablenkung erhalten.
- Überprüfen Sie die Lasersummensignal maximiert wird, um sicherzustellen. Falls erforderlich, wiederholen Sie den Schritt 4.5 neu zu justieren die Position des Laserstrahls auf der AFM-Spitze und der Position der Photodiode die maximale Summensignal zu erhalten.
Hinweis: Es kann notwendig sein , die AFM - Sonde auf dem Sondenhalter zur Neupositionierung eine maximale Summensignal zu erhalten , selbst wenn Schritt 4.5 wiederholt.
5. Kalibrieren des Ablenkempfindlichkeit und Federkonstante der AFM-Sonde
- Machen Sie einen Kratzer auf einer 60-mm-Kulturschale mit einem forcep und füllen die Schale mit destilliertem Wasser. Legen Sie die Kulturschale auf dem Probenhalterplatte. In diesem Fall montieren Sie die Antenne auf dem motorisierten XY-Scan-Stufe eines inversen Mikroskops.
- Legen Sie eine Magnetplattenhalter auf der Oberseite der Platte zu halten, während der Bildgebung zu sichern.
- Klicken 'Up' Pfeil im Navigationsmenü auf der Software , um die AFM Kopf bis zu fast die höchste Position zu bewegen , um sicherzustellen , dass die AFM - Sonde nicht die Schale berühren.
Hinweis: Dieser Schritt ist sehr wichtig , da es vermeidet die AFM - Spitze zu brechen. - Legen Sie die AFM Kopf auf dem Mikroskoptisch.
- Verwenden Sie das Mikroskop auf die Kratzer auf der Platte zu fokussieren. Verwenden Sie den Joystick, oder klicken Sie auf den "Down" Pfeil im Navigationsmenü, zu langsam und vorsichtig die AFM - Sonde in das PBS senken. Positionieren Sie den Kopf leicht über dem Kratzer in der Platte.
HINWEIS: Wenn die Anfangsposition des AFM Kopf näher an der Probe vorhanden ist, wird die Eingriffszeit beträchtlich reduziert werden. - Vor dem Eingriff, korrigieren die Position des Laserstrahls auf der AFM-Spitze und der Position der Photodiode die maximale SUM-Signal wie erforderlich zu erhalten.
- Wählen Sie ein Spitzentyp durch Ändern Probe im Setup - Menü klicken.
- Klicken Sie auf Prüfparameter und die Parameter einstellen: Scannen Größe 0, Scanrate bis 1 Hz, Sample / Linie 256 und Ablenkung Setpoint bis 20 nm. Klicken Sie auf Engage. Das Fenster Status Engage bleibt geöffnet, bis die Sonde Kontakt mit der Oberfläche der Platte macht. Nachdem die Sonde eingreift, klicken Sie auf Rampe.
- Klicken Sie auf Erweiterter Modus im Scan - Toolbar - Menü und stellen Sie die Parameter: Rampe Größe zwischen 500 nm und 1 & mgr; m, Rampenrate bis 2 Hz, Anzahl der Proben auf 256, Spitze Radius bis 500 nm, Probe Poissonzahl bis 0,5 (nimmt das Material gemessen wird , ist vollkommen inkompressibel), Tip Halbwinkel auf 0, Trigger - Modus auf Relative und Triggerschwelle auf einen Wert zwischen 20 und 100 nm werden.
- Klicken Sie auf Rampe Stetig im Ramp Toolbar Menü OBTAin einer Kraftkurve auf der Platte (3A). In dieser Kraftkurve, Kanal 1 auf Ablenkfehlers.
HINWEIS: Dies ermöglicht die Software die Ergebnisse als vertikale Ablenkung gegen z - Position grafisch darzustellen.- Klicken Sie auf der linken oder rechten Enden der Kraftkurve und ziehen Sie den Cursor einen linearen Bereich der Kraftkurve (3A, gestrichelte rote Linien) zu umfassen. Verwenden Sie diese zwei Linien, die die Grenzen der geneigten Region zu markieren mit einer geraden Linie passen.
- Wählen Rampe in der Symbolleiste und Update - Empfindlichkeit klicken. Notieren Sie den Wert und wiederholen Sie diesen Schritt vier weitere Male. Wählen Sie Kalibrieren in der Symbolleiste und dann Detector klicken. Input ein Mittelwert aus den fünf Messungen im Ablenkempfindlichkeit Feld.
- Klicken Sie auf 2 zurückziehen - 3 mal die AFM Kopf zu heben. Dieser Schritt ist wichtig, zu verhindern,Wechselwirkung zwischen der AFM-Spitze und der Platte während des thermischen tune-Prozess. Klicken Sie Thermal Tune in der Symbolleiste.
- Set Thermal Tune Bereich von 1 bis 100 kHz (Diese Informationen können vom Katalog des Herstellers erhältlich) und Ablenkempfindlichkeit Korrektur zu 1,144 für V-förmige Auskragungen und 1,106 für rechteckigen Cantilever.
- Im Thermal Tune - Menü auf Daten erfassen eine thermische tune Kurve (3B) zu erhalten. Verwendung der AFM - Software, place rot gestrichelten Linien auf beiden Seiten der Kurve (wie in 3B gezeigt) durch Ziehen der Maus in von der Kante des Graphen , die Grenzen für die Montage zu definieren. Wählen Sie entweder die Lorentz (Luft) oder das Simple Harmonic Oszillator (Fluid) je nach Modell , auf dem die Daten besser passt.
- Klicken Sie auf Daten anpassen, dann Frühling K berechnen und diesen Wert zu speichern. ReTorf ist die Federkonstante Kalibrierungen mehrmals und verwenden Sie den Mittelwert. Klicken Sie mehrmals zurückziehen.
- Entfernen Sie die AFM-Kopf aus dem Mikroskoptisch und legen Sie es auf der Ausrichteeinheit. Entfernen Sie die Schale aus dem Mikroskoptisch.
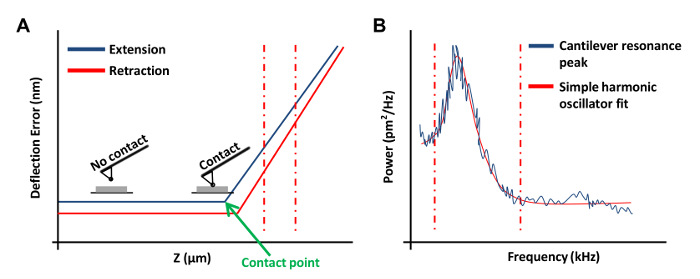
Abbildung 3: AFM Kraftkurven in der Kalibrierung von AFM - Sonden verwendet. (A) Eine repräsentative AFM - Kraftkurve (eine Kalibrierungskurve). Der Verlängerungsabschnitt der Kraftkurve zwischen der vertikalen rot gestrichelte Linien die Cantileverauslenkung Empfindlichkeit zu bestimmen , verwendet wurde. (B) einen einfachen harmonischen Oszillator fit Graph verwendet , um die Federkonstante des Auslegers zu berechnen , wie zuvor 20 beschrieben. Bitte klicken Sie hier um zu sehen eine größere Version dieser Figur.
6. Die Messung des Elastizitätsmoduls auf Maus Arterien Ex Vivo
- Legen Sie die 60-mm-Kulturschale die Aorten-Gewebe auf dem Mikroskoptisch enthält, und befestigen Sie die Platte mit dem Magnetplattenhalter.
- Legen Sie die AFM Kopf auf dem Mikroskoptisch. Stellen Sie sicher, dass die AFM-Sonde nicht mit der Aorta macht Kontakt aber sanft in Kontakt mit PBS und bildet einen Meniskus. Falls erforderlich, legen Sie die AFM - Kopf auf der Ausrichteeinheit und klicken Sie auf zurückziehen , bis es genügend Freiraum ist , den Kontakt zu vermeiden, legen Sie dann das AFM Kopf auf dem Mikroskoptisch.
- Klicken Sie auf Navigieren. Mit dem Joystick oder "Down" Pfeil klicken, langsam die AFM - Sonde senken Sie den Ausleger über der Aorta zu lokalisieren. Stellen Sie die Fotodiode Position der Detektorpositionierung Noppen auf der AFM-Kopf mit, wenn nötig.
- Klicken Sie auf Engage der Ausleger um einen Kontakt mit der Aorta zu ermöglichen.
- Sobald derAorta Eingriff ist, sicherzustellen , dass der Piezo - Zentrum stabil ist und Rampen klicken. Wenn der piezo Zentrum schwankt, kann dies das Ergebnis einer falschen Eingriff sein. Ziehen Sie die Sonde und erhöhen die vertikale Versatz des Lasers auf die Photodiode in kleinen Schritten (~ 0,5 V) und wieder einrasten.
- Auch, wenn die Sonde weit über der Probenoberfläche ist, manuell die Sonde näher an die Probenoberfläche zu senken, bevor sie erneut einnehmend. Wenn die vorherigen Schritte nicht die Schwankung zu beseitigen, versuchen, die Sonde austauschen.
- Stellen Sie die Rampe Größe bis 3 um den Trigger - Modus auf Relative und die Triggerschwelle bis 100 nm und klicken Sie auf Ramp Kontinuierlich. Beachten Sie, dass der Kontaktpunkt zwischen der Sonde und der Probe bei etwa der Mitte tritt zum unteren ¾ der Z Rampenzyklus. Wird dies nicht beachtet wird, lösen aus der Probe, stellen Sie die Rampen Größe je nach Bedarf und wieder greifen in die Probe.
- Klicken Sie Mikroskop in der Menüleiste und dann auf Einstellungen Engage. Ändern Sie die SPM bis 30 & mgr; m zurückziehen. Klicken Sie auf Rampe Stetig im Ramp Toolbar - Menü.
- Nach der Kraftkurve zu beobachten, Erfassung in der Menüleiste klicken und dann Dateiname erfassen. Geben Sie den gewünschten Dateinamen mit der Endung "0,000" (dies ermöglicht zusätzliche aufgenommenen Dateien in der Zahl von 1 zu erhöhen). Wählen Sie einen bestimmten Ordner und die Daten zu speichern.
- Klicken Sie auf Aufnahme in das Capture - Toolbar - Menü. Ziehen Klicken und dann Navigieren. Verwenden Sie den Joystick oder Software steuert den Ausleger über einen anderen Bereich der Aorta zu positionieren (neben dem anfangs gemessenen Punkt, siehe Abbildung 4).
- Klicken Sie auf Engage, Rampe, und Rampe Continuous sind. Nach der Kraftkurve zu beobachten, klicken Sie auf Stopp und dann erfassen.
- Wiederholen Sie die Schritte 6,9-6,10. Erfassen mindestens 5 Messungen pro Bereich wie in Abbildung 4 HINWEIS: Wir sammeln typischerweise 15 bis 25 Kraftkurven 3 bis 5 verschiedenen Standorten in jedem Gewebe , wie in Abbildung 4 gezeigt..
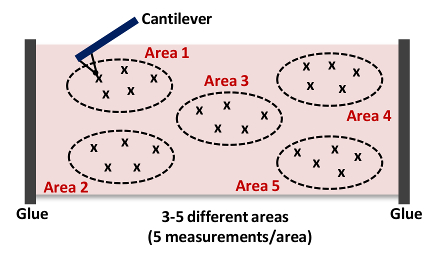
. Abbildung 4: Karikatur eines Cantilever Nähern und Einrücken das Gewebe (Bereich 1) Diese AFM - Messung wird wiederholt , bis 15 bis 25 mal 3 bis 5 verschiedenen Standorten (Areas 1 - 5) in jeder Arterie , die Steifigkeit des Gesamt zu erwerben Gewebeprobe. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
7. Datenanalyse
- Offene Kraftkurvenanalyse-Software.
- ClFinden und Öffnen ick in der Menüleiste und klicken Sie doppelt auf eine Datei analysiert werden.
- Klicken Sie auf Ändern Force - Parameter in der Symbolleiste Menü die Ablenkung Empfindlichkeit, Federkonstante, Spitzenradius, Tip Halbwinkel und Poisson-Verhältnis zu prüfen. Um die Parameter ändern Sie die Kästchen neben den Einträgen überprüfen und die richtigen Werte in der neuen Spalte Wert eingeben. Klicken Sie dann auf Ausführen.
- Wenn Kraftkurven laut sind, klicken Sie auf Filter Boxcar und stellen Eingänge für Richtung zu verlängern, Durchschnittliche Punkte bis 3 und Filter Ordnung auf 0 th. Klicken Sie auf Ausführen , um die Daten zu glätten.
- Klicken Sie auf Basislinienkorrektur in der Menüleiste und setzen Eingänge für Richtung zu verlängern, Parzelle Einheiten zu erzwingen, Typ Trennung, Korrektur Orden 1. und erweitern Basisquelle zu verlängern. Stellen Sie die vertikalen gepunkteten blauen Linien den flachen Bereich der Kraftkurve umfassen , und klicken Sie dann auf Ausführen.
- Klicken Sie Einrückungen in der Leiste und stellen Eingänge für Active Curve Extended, Fit - Methode zum Kontaktpunkt Based, Contact Point - Algorithmus als Fit Variable behandeln, Fügen Sie Adhäsionskraft zu Nein, Max Kraft Fit Begrenzung auf 30%, Min Kraft Fit Grenze 0% und Sitz Modell zu Hertzian (Spherical).
HINWEIS: In unseren Messungen signifikante Adhäsion zwischen der Spitze und der Probe (eine negative Durchbiegung des Auslegers in der Rückzugskurve) wurde selten beobachtet. In Fällen , in denen eine solche Haftung beobachtet wird, sollte das entsprechende Modell (DMT oder JKR) zur Analyse 18,19 verwendet werden. - Speichern Sie die Werte des Young-Moduls. Analysieren der Youngsche (elastisch) Elastizitätsmodul von jeder der 3- 5 Bereiche (5 Kraftkurven pro Fläche) in einem geringen Abstand voneinander genommen , wie in Abbildung 4 dargestellt.
HINWEIS: Artefakte zu entfernen, schließen Young'schen Moduli> 100 kPa ( in der Regel ~ 10% der Gesamtmessungen) von der Analyse. - Berechnen einer mittleren Young-Modul-Wert für jeden der 3 bis 5 Bereiche (die gemessen wurden) und diese Werte verwenden, einen mittleren Elastizitätsmodul für die Aorta als Ganzes zu berechnen.
HINWEIS: mindestens 3 und häufig 4 - 6 Einzel Aorten werden verwendet , um eine genaue Beurteilung der arteriellen Steifigkeit zu erhalten. Die endgültigen Ergebnisse werden als Mittelwert + SEM von "n" unabhängigen Experimenten dargestellt. Die genaue Anzahl der Aorten benötigt wird, hängt natürlich von der Höhe der erforderlichen Genauigkeit.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
5A zeigt ein Phasenkontrastbild des absteigenden (Thorax) Aorta aus einem 6-Monate alten, männlichen C57BL / 6 - Maus. Die AFM - Cantilever ist an Ort und Stelle direkt über dem Gewebe und bereit für den Einzug. 5B und 5C zeigen repräsentative Kraftkurven durch AFM Vertiefung im Kontaktmodus erhalten. Grüne Linien in den 5B und 5C gezeigt stellen die besten Fitkurven für eine Kugel mit dem Hertzian Modell erhalten. In
Access restricted. Please log in or start a trial to view this content.
Diskussion
AFM Einbuchtung kann verwendet werden, um die Steifigkeit (Elastizitätsmodul) von Zellen und Geweben zu charakterisieren. In diesem Beitrag stellen wir ausführliche Schritt- für -Schritt - Protokolle , um die absteigende Aorta und Aortenbogen in der Maus und bestimmen die Elastizitätsmoduli dieser arteriellen Regionen ex vivo zu isolieren. Wir haben jetzt zusammenfassen und die technischen Probleme und Einschränkungen des Verfahrens in diesem Papier beschrieben diskutieren.
Ver...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Referenzen
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten