Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la rigidité de
Dans cet article
Résumé
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Résumé
raidissement artérielle est un facteur de risque significatif et biomarqueur pour une maladie cardiovasculaire et une caractéristique de vieillissement. La microscopie à force atomique (AFM) est un outil d' analyse polyvalent pour la caractérisation des propriétés mécaniques viscoélastiques pour une variété de matériaux allant du disque (plastique, verre, métal, etc.) des surfaces à des cellules sur tout substrat. Il a été largement utilisé pour mesurer la rigidité des cellules, mais moins fréquemment utilisé pour mesurer la rigidité des aortes. Dans cet article, nous allons décrire les procédures d'utilisation de l' AFM en mode contact pour mesurer l'ex vivo module d' élasticité des artères de souris non chargées. Nous décrivons notre procédure d'isolement des aortes de souris, puis des informations détaillées pour l'analyse de l'AFM. Cela inclut des instructions étape par étape pour l'alignement du faisceau laser, l'étalonnage de la constante du ressort et de la sensibilité de déviation de la sonde AFM, et l'acquisition de courbes de force. Nous fournissons également un protocole détaillé pour analy de donnéessis des courbes de force.
Introduction
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocole
le travail des animaux dans cette étude a été approuvée par les soins et l'utilisation des comités institutionnels animales de l'Université de Pennsylvanie. Les méthodes ont été réalisées conformément aux lignes directrices approuvées.
1. Préparation de la souris et l'isolement de l'aorte
- Anesthésier une souris avec de la kétamine (80 - 100 mg / kg), de xylazine (8 - 10 mg / kg) et d'acépromazine (1 - 2 mg / kg) par voie intrapéritonéale. Confirmer l'anesthésie avec un test de queue de pincement. Une fois que la souris est complètement anesthésié, euthanasier la souris par dislocation cervicale.
- Placez la souris sur le dos et la broche de la souris sur une planche à dissection. Nettoyez la région de l'abdomen avec 70% (v / v) d'éthanol lingettes.
- Pincer la peau à la ligne médiane et de faire une petite incision initiale avec des ciseaux de microchirurgie de taille moyenne à l'abdomen. Tout en maintenant la peau avec des pinces, des ciseaux de microchirurgie de taille moyenne pour couper la peau et du péritoine de l'abdomen au sternum.
- Coupez les nervures sur bcôtés OTH avec des ciseaux de microchirurgie de taille moyenne. Retirez délicatement les poumons et le foie avec de petits ciseaux de microchirurgie de taille, et de laisser le cœur et l'aorte. Transfert de la souris et planche de dissection à un microscope à dissection.
- Attrapez la graisse entourant l'aorte avec de petites pinces et utiliser de petits ciseaux pour couper soigneusement la graisse autour de l'aorte.
- saisir délicatement l'aorte avec une pince, faire une coupe avec de petits ciseaux de microchirurgie de taille au début de l'aorte ascendante et une autre coupe à la fin de l'aorte descendante, juste au-dessus de l'aorte abdominale.
- Transférez l'aorte disséquée dans un plat de 60 mm contenant 1x solution saline tamponnée au phosphate (PBS; sans calcium et magnésium).
- Continuer à disséquer les tissus adipeux restant de l'aorte à l'aide de petits ciseaux de microchirurgie de taille. Utilisez de petits ciseaux pour ouvrir l'aorte longitudinalement.
- Utilisez de petits ciseaux de microchirurgie de taille pour couper un petit morceau (~ 2 x 4 mm) de l'aorte descendante et aortic arc pour l' analyse AFM (Figure 1). Placez le tissu dans un plat en plastique de 60 mm et le garder humide dans une goutte de PBS.
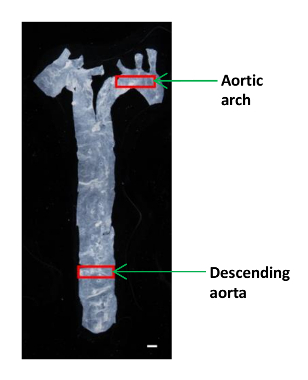
Figure 1:. Une image montrant l'emplacement des segments aortiques différents dans une souris L'aorte a été isolé du coeur à la membrane, et une petite partie de l'aorte descendante et la crosse aortique ont été utilisés pour déterminer les modules élastiques. Barre d'échelle, 1 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
2. Les échantillons de tissus Préparation pour les mesures de l'AFM
- Retirez délicatement le PBS en utilisant un laboratoire essuyez sans toucher l'aorte. Soyez certain que le côté luminal du tissu vers le haut.
- coller doucement chaque extrémité ouverte de l'aorte à la plaque par adjonction ing 5 - 10 pi de colle cyanoacrylate avec une pointe de gel-chargement (Figure 2).
NOTE: La quantité de colle nécessaire pour fixer fermement le tissu à chaque extrémité doit être déterminée empiriquement. Il est essentiel que l'aorte est pas étirée pendant ce processus. - Vérifiez l'aorte collée à assurer qu'il ne soit pas plié ou flottant. Après séchage à l'air de la colle sur l'aorte (30 - 60 s), ajouter doucement PBS et immerger l'échantillon.
NOTE: Préparation de l'AFM (étapes 3-5) peut être effectuée alors que le tissu est en cours de préparation pour l' analyse.

Figure 2: Cartoon d'un segment de l' aorte Collé sur une boîte de culture de 60 mm en utilisant l' adhésif cyanoacrylate L'adhésif cyanoacrylate est appliqué sur le bord d'un échantillon de l' aorte en préparation pour les mesures de l' AFM..com / fichiers / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Chargement de la sonde
- Monter un porte-sonde fluide sur le support de charge de la sonde.
- En utilisant des pinces, faites glisser une sonde AFM de nitrure de silicium (0,06 N / m cantilever) avec une pointe sphérique (nous avons utilisé un diamètre de 1 um SiO 2 particules , mais de plus grandes tailles peuvent également être utilisés) sur le support de sonde. Assurez-vous que la sonde AFM est fermement fixé au support de la sonde.
- Faites glisser le porte-sonde sur le Z-scanner monter de la tête AFM, et veiller à ce que le porte-sonde est solidement fixé.
4. Alignement du laser sur la sonde
- Ouvrez le logiciel de l'AFM. Choisissez le type d'expérience sur le logiciel; Experiment Catégorie à contacter mode, Groupe d'essais pour contacter le mode de fluide et des essais pour contacter le mode dans le liquide. Cliquez sur Charger experiment dans le logiciel; cela tournera sur le laser.
- Ajouter 3 ml d'eau distillée dans un plat de fond de verre de 50 mm et placez le plat sur la scène de l'unité d'alignement laser. Cette unité simplifie le processus de focalisation du faisceau laser sur le dos du cantilever.
- Monter la tête AFM en position verticale sur l'unité d'alignement au laser et la puissance de l'unité d'alignement laser. Ajouter environ 50 pi d'eau distillée pour former une gouttelette sur la pointe de l'AFM.
- En utilisant le joystick, abaisser la tête AFM de sorte que la pointe de l'AFM est en contact avec de l'eau dans le plat. Si le contact ne se fait pas entre la pointe de l'AFM et de l'eau dans le plat, soulevez doucement le plat jusqu'à ce que le contact est établi. Réglez la mise au point, la luminosité et la position XY de sorte que la pointe de l'AFM est en vue sur l'écran LCD de l'unité d'alignement.
- Positionner la tache laser sur la pointe de la sonde AFM en ajustant les boutons de la tête AFM de positionnement laser. En utilisant les boutons de positionnement du détecteur sur la tête de l'AFM, ajuster la position de la photodiode jusqu'à ce que des valeurs comprises entre 0 et -1 V, on obtient pour la déviation verticale et ~ 0 V, on obtient pour la déviation horizontale.
- Vérifiez que le signal de somme laser est maximisée. Si nécessaire, répétez l'étape 4.5 de re-régler la position du faisceau laser sur la pointe de l'AFM et la position de la photodiode pour obtenir le signal de somme maximale.
NOTE: Il peut être nécessaire de repositionner la sonde AFM sur le support de sonde pour obtenir un signal de somme maximale même si l' étape 4.5 est répétée.
5. Calibrage de la constante Déviation de sensibilité et de printemps de l'AFM Probe
- Faire une égratignure sur une boîte de culture de 60 mm avec une pince et remplir la cuve avec de l'eau distillée. Placez la boîte de culture sur la plaque porte-échantillon. Dans ce cas, monter le plat sur la XY motorisée étape de balayage d'un microscope inversé.
- Placez un support de plaque magnétique sur le dessus de la plaque pour conserver en toute sécurité lors de l'imagerie.
- Cliquez Flèche 'Up' dans le menu de navigation sur le logiciel pour déplacer la tête AFM jusqu'à près de sa position la plus élevée à veiller à ce que la sonde AFM ne touchera pas le plat.
NOTE: Cette étape est très importante car elle permet d' éviter la rupture de la pointe de l' AFM. - Placez la tête AFM sur la platine du microscope.
- Utilisez le microscope pour se concentrer sur le scratch sur la plaque. Utilisez le joystick, ou cliquez sur la flèche «bas» dans le menu de navigation, lentement et soigneusement abaisser la sonde AFM dans le PBS. Positionner la tête légèrement au-dessus de zéro dans la plaque.
NOTE: Si la position initiale de la tête AFM est plus proche de l'échantillon, le temps engager sera considérablement réduit. - Avant d'engager, re-régler la position du faisceau laser sur la pointe de l'AFM et la position de la photodiode pour obtenir le signal SUM maximale nécessaire.
- Sélectionnez un type de pointe en cliquant sur Modifier la sonde dans le menu de configuration.
- Cliquez sur Vérifier les paramètres et définir les paramètres: Balayez Taille à 0, vitesse de balayage à 1 Hz, Sample / ligne à 256 et des fléchissements de consigne à 20 nm. Cliquez sur Engage. La fenêtre d'état Engage restera ouvert jusqu'à ce que la sonde est en contact avec la surface de la plaque. Après avoir engagé la sonde, cliquez sur la rampe.
- Cliquez sur Expanded Mode dans le menu Barre d' outils d' analyse et de définir les paramètres: Ramp Taille comprise entre 500 nm et 1 pm, Taux de rampe à 2 Hz, Nombre d'échantillons 256, Conseil de rayon à 500 nm, le ratio de l' échantillon de Poisson à 0,5 ( en supposant le matériau à mesurer est parfaitement incompressible), Tip demi - angle à 0, le mode de déclenchement à seuil de déclenchement relatif et entre 20 et 100 nm.
- Cliquez sur rampe continue dans le menu Rampe Barre d'outils pour bénéficier du droitdans une courbe de force sur la plaque (figure 3A). Dans cette courbe de force, réglez le canal 1 à l' erreur de déviation.
NOTE: Cela permettra au logiciel de représenter graphiquement les résultats sous forme de déviation verticale vs. position z.- Cliquez sur les extrémités gauche ou droite de la courbe de force et faites glisser le curseur pour englober une région linéaire de la courbe de force (figure 3A, les lignes rouges en pointillés). Utilisez ces deux lignes pour marquer les limites de la région en pente pour être en forme avec une ligne droite.
- Sélectionnez la rampe dans la barre d' outils et cliquez sur Mettre à jour la sensibilité. Enregistrer la valeur et répétez cette étape quatre fois plus. Sélectionnez Calibrer dans la barre d' outils puis cliquez sur Detector. Entrez une valeur moyenne des cinq mesures dans la zone de déflexion Sensibilité.
- Cliquez sur Retrait 2 - 3 fois pour relever la tête de l' AFM. Cette étape est importante pour prévenirl'interaction entre la pointe de l'AFM et la plaque au cours du processus de mise au point thermique. Cliquez sur Tune thermique dans la barre d' outils.
- Set thermique Tune gamme de 1-100 kHz (Cette information peut être obtenue à partir du catalogue du fabricant) et des fléchissements Sensibilité Correction à 1.144 pour les cantilevers en forme de V et 1.106 pour les cantilevers rectangulaires.
- Dans le menu Tune thermique, cliquez sur Acquérir les données pour obtenir une courbe de hauteur thermique (figure 3B). Utilisation du logiciel de l' AFM, le lieu lignes pointillées rouges de chaque côté de la courbe (comme le montre la figure 3B) en faisant glisser la souris à partir du bord du graphique pour définir les limites pour le montage. Sélectionnez l'Lorentzienne (Air) ou le modèle simple oscillateur harmonique (Fluid) selon le mieux adapté aux données.
- Cliquez Fit données, puis Calculer Spring K et enregistrer cette valeur. Rétourbe du printemps étalonnages constants plusieurs fois et utiliser la valeur moyenne. Cliquez sur Extraire plusieurs fois.
- Retirez la tête AFM de la platine du microscope et le placer sur l'unité d'alignement. Retirer le plat du stade de microscope.
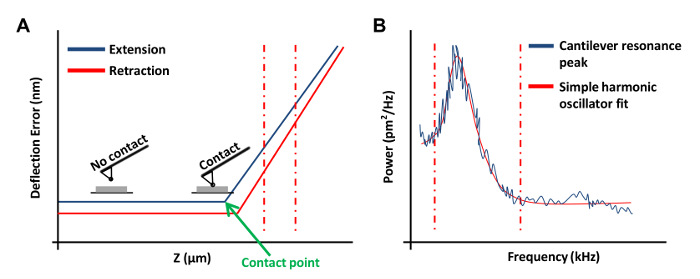
Figure 3: Courbes AFM force utilisée dans l'étalonnage de l' AFM sondes. (A) Une courbe de force de l' AFM représentant (une courbe d'étalonnage). La partie d'extension de la courbe de force entre la verticale rouge lignes pointillées a été utilisé pour déterminer la sensibilité cantilever de déviation. (B) Un graphe en forme de l' oscillateur harmonique simple utilisée pour calculer la constante du ressort du cantilever comme décrit précédemment 20. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
6. Mesure de la Modulus élastique sur les grandes routes de souris ex vivo
- Placez la boîte de culture de 60 mm contenant le tissu aortique sur la platine du microscope, et fixer la plaque avec le support de plaque magnétique.
- Placez la tête AFM sur la platine du microscope. Assurez-vous que la sonde AFM ne fait pas contact avec l'aorte, mais fait doucement contact avec PBS et forme un ménisque. Si nécessaire, placez la tête AFM sur l'unité d'alignement , puis cliquez sur Retirer jusqu'à ce qu'il y a suffisamment d' espace pour éviter le contact, puis placer la tête AFM sur la platine du microscope.
- Cliquez sur Naviguer. Utilisation du joystick ou en cliquant sur 'Down' flèche, abaissez lentement la sonde AFM pour localiser le cantilever au-dessus de l'aorte. Ajustez la position de photodiode en utilisant les boutons de positionnement du détecteur sur la tête AFM si nécessaire.
- Cliquez sur Engagez pour permettre à la console de prendre contact avec l'aorte.
- Une fois laaorte est engagée, veiller à ce que le centre de piezo est stable et cliquez sur rampe. Si le centre de piezo est fluctuante, cela peut être le résultat d'un faux engagement. Retirer la sonde et augmenter le décalage vertical du laser sur la photodiode par petits incréments (~ 0,5 V) et réengager.
- En outre, si la sonde est bien au-dessus de la surface de l'échantillon, abaisser manuellement la sonde près de la surface de l'échantillon avant de re-engagement. Si les étapes précédentes ne suppriment pas la fluctuation, essayez de remplacer la sonde.
- Régler la rampe Taille à 3 pm, le mode de déclenchement de relative et le seuil de déclenchement à 100 nm et cliquez sur rampe continue. Notez que le point de contact entre la sonde et l'échantillon se produit à peu près au centre de la partie inférieure ¾ du cycle Z de rampe. Si cela n'a pas été observé, se désengager de l'échantillon, ajuster la taille de la rampe, au besoin, et réengager l'échantillon.
- Cliquez sur Microscope dans la barre de menu, puis engager Paramètres. Changer le SPM Retrait à 30 pm. Cliquez sur rampe continue dans le menu Rampe barre d' outils.
- Après avoir observé la courbe de force, cliquez sur Capturer dans la barre de menu, puis Capturer Nom du fichier. Entrez un nom de fichier désiré avec la fin ".000" (ce qui permettra les fichiers capturés supplémentaires pour augmenter en nombre par 1). Sélectionnez un dossier désigné et enregistrer les données.
- Cliquez sur Capturer dans le menu de la barre d'outils Capture. Cliquez sur Retirer puis Naviguer. Utilisez le joystick ou les commandes de logiciels pour positionner la console sur une autre zone de l'aorte ( à côté du point initialement mesurée; voir la figure 4).
- Cliquez sur Engage, rampe et rampe continue, respectivement. Après avoir observé la courbe de force, cliquez sur Arrêter puis Capturer.
- Répétez les étapes 06.09 à 06.10. Capture au moins 5 mesures par zone comme le montre la Figure 4 NOTE: Nous recueillons généralement 15 - 25 courbes de 3 force - 5 endroits différents dans chaque tissu comme le montre la figure 4, respectivement..
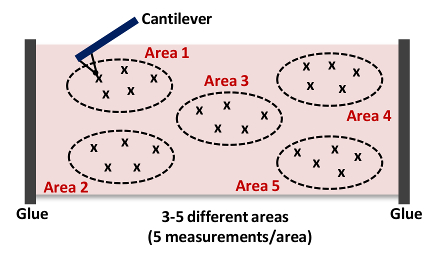
. Figure 4: bande dessinée d'un cantilever approchant et Indentation Tissue (zone 1) Cette mesure de l' AFM est répété jusqu'à 15 - 25 fois à partir de 3 - 5 endroits différents (zones 1 - 5) dans chaque artère d'acquérir la rigidité de l'ensemble échantillon de tissu. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Analyse 7. Données
- Ouvrir la force logiciel d'analyse de la courbe.
- Click Trouver et Open dans la barre de menu, puis double - cliquez sur un fichier à analyser.
- Cliquez sur Modifier les paramètres de la Force dans le menu de la barre d' outils pour vérifier la sensibilité de déviation, le ratio de Constant Spring, Tip Radius, Tip demi - angle et Poisson. Pour modifier les paramètres, cochez la case à côté de lui et entrez les valeurs correctes dans la nouvelle colonne de valeur. Ensuite , cliquez sur Exécuter.
- Si les courbes de force sont bruyants, cliquez sur Boxcar Filter et réglez les entrées de direction pour étendre, Moyenne des points à 3 et Commande de filtre à 0 e. Cliquez sur Exécuter pour lisser les données.
- Cliquez Baseline Correction dans la barre de menu et définir des entrées pour Instructions Extend, Plot unités à la force, type de séparation, Correction ordonner au 1 er et Extend Baseline Source pour étendre. Ajustez les lignes bleues verticales en pointillés pour englober la partie plate de la courbe de force, puis cliquez sur Exécuter.
- Cliquez sur indentation dans le menu de la barre d' outils et définir des entrées pour Curve Active Extended, Méthode Fit to Point de contact Based, Point de contact Algorithme pour traiter comme Fit Variable, Inclure Adhérence Force pour Non, Fit Boundary Force Max à 30%, Fit Boundary Force de Min à 0% et Fit Model à hertzienne (Spherical).
NOTE: Dans nos mesures, l' adhérence significative entre la pointe et l' échantillon (une déviation négative de la console dans la courbe de rétraction) a été rarement observée. Dans les cas où une telle adhérence est observée, le modèle approprié (DMT ou JKR) doit être utilisé pour l' analyse 18,19. - Enregistrer les valeurs de module de Young. Analyser (élastique) de chacun des trois de Young- 5 zones (5 courbes de force par unité de surface) pris à l'intérieur d' une petite distance les uns des autres comme représenté sur la figure 4.
REMARQUE: Pour supprimer les artefacts, exclure les modules d'Young> 100 kPa (normalement ~ 10% du nombre total de mesures) de l'analyse. - Calculer une valeur de module d'Young moyen pour chacun des 3 - 5 zones (qui ont été mesurés) et utiliser ces valeurs pour calculer le module d'élasticité moyenne de l'aorte dans son ensemble.
REMARQUE: au moins 3 et plus souvent 4 - 6 aortes individuels sont utilisés pour obtenir une évaluation précise de la rigidité artérielle. Les résultats finaux sont représentés par la moyenne ± ETM de «n» expériences indépendantes. Le nombre exact de aortes nécessaires sera, bien sûr, dépendra du niveau de précision requis.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 5A montre une image de contraste de phase de la descente (thoracique) aorte d'un enfant de 6 mois, mâle C57BL / 6 de souris. Le cantilever AFM est en place directement au- dessus du tissu et prêt pour l' indentation. Figures 5B et 5C montrent des courbes de force représentatives obtenues par AFM indentation en mode contact. Lignes vertes représentées sur les figures 5B et 5C représentent les meilleures cour...
Access restricted. Please log in or start a trial to view this content.
Discussion
AFM indentation peut être utilisée pour caractériser la rigidité (module d'élasticité), des cellules et des tissus. Dans cet article, nous fournissons des protocoles étape par étape détaillées pour isoler l'aorte descendante et l' arc aortique chez la souris et déterminer les modules élastiques de ces régions artérielles ex vivo. Nous résumons maintenant et discuter les problèmes techniques et les limites de la méthode décrite dans le présent document.
...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Références
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon