É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo a rigidez
Neste Artigo
Resumo
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Resumo
enrijecimento arterial é um fator de risco significativo e biomarcador para a doença cardiovascular e uma característica do envelhecimento. Microscopia de força atómica (AFM), é uma ferramenta analítica versátil para a caracterização de propriedades mecânicas viscoelásticas para uma variedade de materiais que vão desde a dura (de plástico, vidro, metal, etc.) superfícies de células em qualquer substrato. Tem sido largamente utilizado para medir a rigidez das células, mas menos frequentemente utilizados para medir a rigidez das aortas. Neste artigo, vamos descrever os procedimentos para a utilização AFM no modo de contato para medir o módulo de elasticidade ex vivo das artérias descarregados do mouse. Nós descrevemos o nosso procedimento para isolamento de aortas do rato e, em seguida, forneça informações detalhadas para a análise AFM. Isso inclui instruções passo-a-passo para o alinhamento do feixe de laser, a calibração da constante da mola e sensibilidade deflexão da sonda de AFM, e aquisição de curvas força. Nós também fornecemos um protocolo detalhado para Analy dadossis das curvas de força.
Introdução
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protocolo
trabalho com animais neste estudo foi aprovado pelo Comitê Institucional de Animais cuidado e uso de da Universidade da Pensilvânia. Os métodos foram realizados em conformidade com as orientações aprovadas.
1. Preparar o mouse e Isolamento da Aorta
- Anestesiar um rato com cetamina (80-100 mg / kg), xilazina (8 - 10 mg / kg) e acepromazina (1-2 mg / kg) por via intraperitoneal. Confirmar anestesia com um teste de cauda pitada. Uma vez que o rato está totalmente anestesiado, eutanásia o mouse por deslocamento cervical.
- Posicione o mouse sobre as suas costas e prender o mouse para uma placa de dissecação. Limpar a área abdominal com 70% (v / v) de etanol toalhetes.
- Beliscar a pele no mid-line e fazer uma pequena incisão inicial com uma tesoura de microcirurgia e médio porte no abdômen. Enquanto mantém a pele com uma pinça, utilize médias tesoura de microcirurgia porte para cortar a pele e peritônio do abdômen ao esterno.
- Cortar as costelas do blados oth com meio tesoura de microcirurgia porte. Remova cuidadosamente os pulmões e fígado com uma tesoura pequena microcirurgia porte, e deixar o coração ea aorta. Transferir o mouse e placa de dissecção de um microscópio de dissecação.
- Segure a gordura em torno da aorta com pequenas pinças e usar uma tesoura pequena para cortar cuidadosamente gordura ao redor da aorta.
- Suavemente agarrar a aorta com uma pinça, fazer um corte com uma tesoura de microcirurgia pequenas de tamanho no início da aorta ascendente e um outro corte no fim da aorta descendente, um pouco acima da aorta abdominal.
- Transferir a aorta dissecada para uma placa de 60 mm contendo solução salina tamponada com fosfato 1x (PBS; sem cálcio e magnésio).
- Continuar a dissecar fora qualquer tecido adiposo restante da aorta usando uma tesoura pequena microcirurgia porte. Use pequenas tesouras para abrir a aorta longitudinalmente.
- Use pequenas tesouras microcirúrgicas dimensionados para cortar um pedaço pequeno (~ 2 x 4 mm) da aorta descendente e aortic arco para análise AFM (Figura 1). Colocar o tecido em um prato de plástico de 60 mm e mantê-lo húmido em uma gota de PBS.
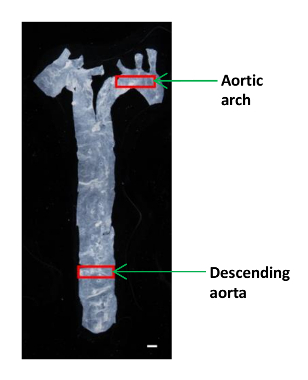
Figura 1:. Uma imagem que mostra a localização dos diferentes segmentos da aorta em um rato A aorta foi isolado a partir do coração para o diafragma, e uma pequena porção da aorta descendente e arco aórtico foram usadas para determinar os módulos elásticos. Barra de escala, 1 mm. Por favor clique aqui para ver uma versão maior desta figura.
2. preparação de amostras de tecido para as medições AFM
- Retire cuidadosamente a PBS usando um lab-limpe sem tocar na aorta. Esteja certo de que o lado luminal do tecido é voltado para cima.
- Suavemente cola cada extremidade da aorta aberta sobre a placa por suplemento ing 5 - 10 ul de adesivo de cianoacrilato com uma ponta de gel de carga (Figura 2).
NOTA: A quantidade de cola necessária para prender firmemente o tecido em cada extremidade devem ser determinadas empiricamente. É crítico que a aorta não é esticada durante este processo. - Verifique a aorta colado para ter certeza de que não está dobrado ou flutuante. Após secagem ao ar a cola sobre a aorta (30 - 60 seg), adicionar suavemente PBS e submergir a amostra.
NOTA: Preparação da AFM (Passos 3-5) pode ser realizada enquanto o tecido está a ser preparada para análise.

Figura 2: Os desenhos animados de um segmento da aorta coladas sobre uma placa de cultura de 60-mm utilizando Adesivo de cianoacrilato O adesivo de cianoacrilato é aplicado ao bordo de uma amostra da aorta em preparação para medições de AFM..com / files / ftp_upload / 54630 54630fig2large.jpg "target =" / _ blank "> Clique aqui para ver uma versão maior desta figura.
3. Carregando o Probe
- Montar um suporte de sonda fluido no suporte de carga da sonda.
- Usando pinças, deslizar uma sonda de AFM de nitreto de silício (0,06 N / m cantilever) com uma ponta esférica (temos utilizado um diâmetro de 1 | iM de SiO 2 de partícula, mas pode também ser usado tamanhos maiores) no suporte da sonda. Certifique-se de que a sonda de AFM está firmemente presa ao suporte da sonda.
- Deslize o suporte da sonda para o Z-scanner de montagem da cabeça AFM, e garantir que o titular da sonda está bem preso.
4. Alinhar a Laser na sonda
- Abra o software AFM. Escolha o tipo de experimento no software; Experiment Categoria entrar em contato Mode, Experimento Grupo de Contacto Modo no líquido e Experiência para Contacto Modo no líquido. Clique em Carregar experiment no software; isso vai ligar o laser.
- Adicionar 3 ml de água destilada para um prato de fundo de vidro de 50 mm, e colocar o prato no estágio da unidade de alinhamento do laser. Esta unidade simplifica o processo de focagem do feixe laser sobre a parte traseira do braço de suporte.
- Monte a cabeça AFM em posição vertical sobre a unidade de alinhamento a laser e de alimentação na unidade de alinhamento a laser. Adicionar aproximadamente 50 mL de água destilada para formar uma gota sobre a ponta de AFM.
- Usando o joystick, baixar a cabeça AFM modo a ponta do AFM faz contato com a água no prato. Se o contato não é feita entre a ponta do AFM e água no prato, delicadamente levantar o prato até que o contato é feito. Ajuste o foco, brilho e posição XY de modo a ponta do AFM está à vista na tela LCD da unidade de alinhamento.
- Posicionar o ponto de laser na ponta da sonda de AFM, ajustando os botões de posicionamento laser da cabeça AFM. Usando os botões de posicionamento detector na cabeça AFM, ajustar o positião do fotodíodo até valores entre 0 e -1 V são obtidos para a deflexão vertical e ~ 0 V é obtido para a deflexão horizontal.
- Verifique se que o sinal de soma laser é maximizada. Se necessário, repetir o passo 4.5 para re-ajustar a posição do feixe de laser sobre a ponta de AFM e a posição do fotodiodo para obter o sinal de soma máxima.
Nota: Pode ser necessário para reposicionar a sonda de AFM no suporte da sonda para obter um sinal soma máxima mesmo passo 4.5 é repetido.
5. Calibrar o constante deflexão Sensibilidade e Primavera da Sonda de AFM
- Fazer um arranhão em uma placa de cultura de 60 mm com uma pinça e encher o prato com água destilada. Colocar a placa de cultura na placa de suporte de amostras. Neste caso, o prato de montagem na fase de verificação XY motorizado de um microscópio invertido.
- Coloque um suporte da placa magnética em cima da placa para evitar o proteger durante o exame.
- Clique Seta 'Up' no menu de navegação no software para mover a cabeça AFM até quase sua posição mais alta para garantir que a sonda de AFM não vai tocar o prato.
NOTA: Este passo é muito importante, pois evita quebrar a ponta do AFM. - Coloque a cabeça AFM no palco microscópio.
- Use o microscópio para se concentrar no arranhão no prato. Use o joystick, ou clique na seta 'Down' no menu de navegação, a lenta e cuidadosamente abaixe a sonda de AFM para a PBS. Posicionar a cabeça ligeiramente acima do zero na placa.
NOTA: Se a posição inicial da cabeça AFM é mais estreita para a amostra, o tempo de envolver será significativamente reduzido. - Antes de se envolver, re-ajustar a posição do feixe de laser sobre a ponta de AFM e a posição do fotodiodo para obter o sinal máximo SUM como necessário.
- Selecione um tipo de dica clicando em Alterar Probe no menu de configuração.
- Clique em Verificar parâmetros e definir os parâmetros: Tamanho da Digitalização a 0, digitalização Rate para 1 Hz, Sample / linha para 256 e Desvio do valor nominal de 20 nm. Clique Engage. A janela Engage Estado permanecerá aberta até que a sonda faz contato com a superfície da placa. Depois de engatar a sonda, clique em Rampa.
- Clique em modo expandido no menu barra de ferramentas de digitalização e definir os parâmetros: Rampa tamanho para entre 500 nm e 1 mm, Ramp Rate para 2 Hz, número de amostras a 256, Ponta Radius para 500 nm, Ratio Amostra de Poisson para 0,5 (assume o material a ser medido é perfeitamente incompressível), Tip semi-ângulo a 0, o modo de disparo para Threshold relativa e disparo para entre 20 e 100 nm.
- Clique Ramp Contínuo no menu Ramp barra de ferramentas para obtanuma curva de força na placa (Figura 3A). Nesta curva de força, defina um canal a um erro de deflexão.
NOTA: Isto irá permitir que o software gráfico dos resultados como deflexão vertical vs. posição z.- Clique nas extremidades esquerda ou à direita da curva de força e arrastar o cursor para abranger uma região linear da curva de força (Figura 3A, as linhas tracejadas vermelhas). Use estas duas linhas para marcar os limites da região inclinada para estar em forma com uma linha reta.
- Selecione Ramp na barra de ferramentas e clique em Atualizar Sensibilidade. Grave o valor e repita esta etapa mais quatro vezes. Selecione Calibrar na barra de ferramentas e clique em Detector. Entrada de um valor médio das cinco medidas na caixa de deflexão Sensibilidade.
- Clique em Retirar 2 - 3 vezes para levantar a cabeça AFM. Esta etapa é importante para evitarinteracção entre a ponta de AFM e a placa durante o processo de ajuste térmico. Clique Tune térmica na barra de ferramentas.
- Definir térmica Tune Gama de 1-100 kHz (Esta informação pode ser obtida a partir de catálogo do fabricante) e Desvio de sensibilidade correção para 1.144 para consolas forma de V e 1.106 para cantilevers rectangulares.
- No menu Tune térmica, clique em adquirir dados para obter uma curva sintonia térmica (Figura 3B). Utilizando o software de AFM, o local vermelho linhas tracejadas em cada lado da curva (como se mostra na Figura 3B), arrastando o rato a partir da borda do gráfico, para definir os limites para a montagem. Selecione o modelo simples oscilador harmônico (Fluid), dependendo de qual melhor se ajusta aos dados de Lorentz (Ar) ou.
- Clique em Ajustar Data, em seguida, calcular Primavera K e salvar esse valor. Réturfa a mola calibrações constantes várias vezes e utilizar o valor médio. Clique retirar várias vezes.
- Retire a cabeça AFM do palco microscópio e colocá-lo na unidade de alinhamento. Remover o prato de platina do microscópio.
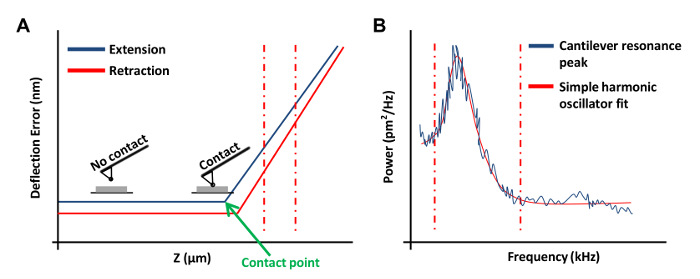
Figura 3: Curvas AFM força usada na calibração de AFM Sondas. (A) A curva da força de AFM representante (uma curva de calibração). A porção de extensão da curva de força entre o vermelho linhas tracejadas verticais foi utilizado para determinar a sensibilidade cantilever deflexão. (B) Um gráfico de ajuste oscilador harmônico simples usado para calcular a constante de mola do cantilever, como descrito anteriormente 20. Por favor clique aqui para ver uma versão maior desta figura.
6. Medindo o Elastic Modulus on mouse Artérias Ex Vivo
- Colocar a placa de cultura de 60 mm contendo o tecido aórtico na platina do microscópio, e fixar a placa com o suporte da placa magnética.
- Coloque a cabeça AFM no palco microscópio. Certifique-se de que a sonda de AFM não faz contato com a aorta, mas com cuidado faz contato com PBS e forma um menisco. Se necessário, colocar a cabeça AFM na unidade de alinhamento e clique em Retirar até que haja espaço suficiente para evitar o contato, em seguida, colocar a cabeça AFM no palco microscópio.
- Clique Navegar. Usando o joystick ou clicando em 'Down' flecha, abaixe lentamente a sonda de AFM para localizar o cantilever acima da aorta. Ajuste a posição fotodiodo usando os botões de posicionamento detector na cabeça AFM, se necessário.
- Clique Engage para permitir que o cantilever para fazer contato com a aorta.
- Uma vez oaorta está envolvida, assegurar que o centro de piezo é estável e clique Ramp. Se o centro de piezo é flutuante, isto pode ser o resultado de uma falsa acoplamento. Retirar a sonda e aumentar o deslocamento vertical do laser sobre o fotodiodo em pequenos incrementos (~ 0,5 V) e voltar a envolver.
- Além disso, se a sonda está muito acima da superfície da amostra, reduzir manualmente a sonda mais próxima à superfície da amostra antes de voltar a envolvente. Se as etapas anteriores não eliminam a flutuação, tente trocar a sonda.
- Defina a rampa Tamanho a 3 mm, o modo de disparo para Relativa eo limite de acionamento de 100 nm e clique Rampa contínua. Observe-se que o ponto de contacto entre a sonda e a amostra ocorre aproximadamente no centro inferior à do ciclo ¾ Z rampa. Se isso não for observado, desengatar a partir da amostra, ajuste o tamanho da rampa, conforme necessário, e re-acoplar a amostra.
- Clique Microscópio na barra de menu e, em seguida Engage Configurações. Alterar a SPM Retirada para 30 mm. Clique Ramp Contínuo no menu Ramp Toolbar.
- Depois de observar a curva de força, clique em Capturar na barra de menu e, em seguida, captura Matrícula. Digite um nome de arquivo desejado com o final ".000" (isso permitirá que arquivos capturados adicionais para aumentar em número por 1). Selecione a-pasta designada e salvar os dados.
- Clique em Capturar no menu de captura Toolbar. Clique em Retirar e depois navegar. Use o Joystick ou controles de software para posicionar o cantilever sobre outra área da aorta (ao lado do ponto inicialmente mensurados; veja a Figura 4).
- Clique Engage, Rampa, Rampa e contínua, respectivamente. Depois de observar a curva de força, clique em Parar e, em seguida, captura.
- Repita os passos 6,9-6,10. Capturar pelo menos 5 medições por zona, como mostrado na Figura 4 NOTA: De modo geral, recolher 15 - 25 curvas de força a partir de 3 - 5 posições diferentes em cada tecido, como mostrado na Figura 4, respectivamente..
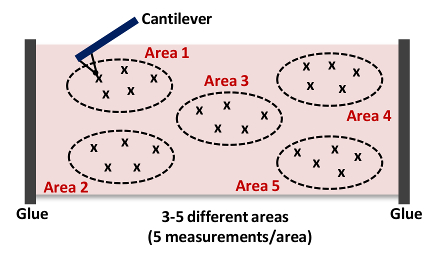
. Figura 4: Desenhos animados de um cantilever de aproximação e recuo de Tecidos (Área 1) Esta medida AFM é repetido até 15 - 25 vezes a partir de 3 - 5 locais diferentes (Áreas 1 - 5) em cada artéria para adquirir a rigidez do conjunto amostra de tecido. por favor clique aqui para ver uma versão maior desta figura.
Análise 7. Os dados
- Abrir força de software de análise de curva.
- Click encontrar e abrir na barra de menu e clique duas vezes em um arquivo para ser analisado.
- Clique em Modificar Força Parâmetros no menu de barra de ferramentas para verificar a sensibilidade de deflexão, o rácio da Primavera Constant, Tip Radius, Tip semi-ângulo e Poisson. Para alterar verificar os parâmetros da caixa ao lado dele e entrar os valores corretos na nova coluna de valor. Em seguida, clique em Executar.
- Se as curvas de força são barulhentos, clique Boxcar filtro e definir entradas para Direção estender, Média de pontos a 3 e Filtro Ordenar a 0 th. Clique em Executar para suavizar os dados.
- Clique Base Correção na barra de menu e definir entradas para a direção para estender, unidades de plotagem à força, Tipo de Separação, correção fim de 1º e Estender linha de base Fonte estender. Ajuste as linhas azuis tracejadas verticais para abranger a parte plana da curva de força e clique em Executar.
- Clique Recuo no menu da barra de ferramentas e definir entradas para o Active Curve para Extended, Método Ajustar ao Ponto de Contacto Based, Contact Algoritmo Ponto tratar variável como Fit, Incluir Adesão Força para Não, Max Força Fit Boundary a 30%, Força Min Fit Boundary para 0% e modelo Fit para hertziana (Spherical).
NOTA: Em nossas medições, a adesão significativa entre a ponta ea amostra (um desvio negativo do cantilever na curva de retração) foi raramente observada. Nos casos em que tal adesão é observado, o modelo apropriado (DMT ou JKR) deve ser utilizada para a análise 18,19. - Guardar os valores do módulo de Young. Analisar o módulo de Young (elástica) de cada um dos três- 5 áreas (curvas 5 força por área) tomadas dentro de uma pequena distância uns dos outros, como mostrado na Figura 4.
NOTA: Para remover artefactos, excluir módulos de Young> 100 kPa (normalmente ~ 10% das medições totais) a partir da análise. - Calcular um valor de módulo de Young médio para cada um dos 3 - 5 (zonas que tenham sido medidos) e usar estes valores para calcular o módulo de elasticidade médio para a aorta como um todo.
NOTA: pelo menos 3 e mais frequentemente de 4 - 6 aortas individuais são utilizados para se obter uma avaliação exacta da rigidez arterial. Os resultados finais são representados como média + SEM de "n" experiências independentes. O número exacto de aortas necessários irá, claro, depender do nível de precisão necessária.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 5A mostra uma imagem de contraste de fase da aorta descendente (torácica) a partir de um 6-meses de idade C57BL / 6 de rato, do sexo masculino. O cantilever AFM está no local diretamente acima do tecido e pronto para recuo. Figuras 5B e 5C mostram curvas força representativos obtidos por AFM recuo no modo de contato. Linhas verdes mostradas nas Figuras 5B e 5C representam os melhores curvas de ajuste obtidos usando o m...
Access restricted. Please log in or start a trial to view this content.
Discussão
AFM recuo pode ser utilizado para caracterizar a rigidez (módulo de elasticidade) de células e tecidos. Neste artigo, nós fornecemos protocolos detalhados passo-a-passo para isolar a aorta descendente e arco aórtico em ratos e determinar o módulo de elasticidade dessas regiões arteriais ex vivo. Vamos agora resumir e discutir as questões técnicas e limitações do método descrito neste artigo.
Várias questões técnicas podem surgir no isolamento e análise de aortas de ra...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Referências
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados