Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
sertliği ölçme
Bu Makalede
Özet
We present detailed protocols for isolation of aortas from mouse and measurement of their elastic modulus using atomic force microscopy.
Özet
Arteriyel sertleşme önemli bir risk faktörüdür ve kardiyovasküler hastalık için biomarker ve yaşlanma bir özelliğidir. Atomik kuvvet mikroskopisi (AFM), sert (plastik, cam, metal, vs.) herhangi bir alt-tabaka üzerinde hücrelere yüzeyleri arasında değişen çeşitli malzemeler için viskoelastik mekanik özelliklerini karakterize etmek için çok yönlü bir analiz aracı. Yaygın hücre sertliğini ölçmek için kullanılan, daha az sıklıkla aorta sertliğini ölçmek için kullanılmıştır. Bu yazıda, yüksüz fare arterlerin ex vivo elastik modülü ölçmek için temas modunda AFM kullanarak işlemleri anlatacağım. Biz fare aorta izolasyonu için prosedürü tarif ve sonra AFM analizi için ayrıntılı bilgi sağlar. Bu lazer ışını uyumu, yay sabiti ve AFM prob sapma duyarlılığı kalibrasyonu ve kuvvet eğrileri elde edilmesi için adım adım yönergeler içerir. Biz aynı zamanda veri analy için ayrıntılı bir protokol sağlarkuvvet eğrilerinin sis.
Giriş
The biomechanical properties of arteries are a critical determinant in cardiovascular disease (CVD) and aging. Arterial stiffness, a major cholesterol independent risk factor and an indicator for the progression of CVD, increases with vascular injury, atherosclerosis, age, and diabetes1-8. Arterial wall stiffening is associated with increased dedifferentiation, migration, and proliferation of vascular smooth muscle cells9-12. In addition, increased arterial stiffness has been linked to enhanced macrophage adhesion1, endothelial permeability and leukocyte transmigration13, and vessel wall remodeling14,15. Thus, therapies that could prevent arterial stiffening in CVD or aging might complement currently available pharmacological interventions that treat CVD by reducing high blood cholesterol.
AFM is a powerful analytical tool used for various physical and biological applications. AFM is increasingly used to obtain the high-resolution images and characterize the biomechanical properties of soft biological samples such as tissues and cells1,2,10,16,17 with a great degree of accuracy at nanoscale levels. A major advantage of AFM is the fact that it can be used with living cells.
This paper describes our method for measuring the elastic modulus of mouse arteries ex vivo using AFM. The described method shows how we 1) properly isolate mouse arteries (descending aorta and aortic arch) and 2) measure the elastic modulus of these tissues by AFM. Measurements of unloaded elastic moduli in arteries can help to elucidate changes in the extracellular matrix (ECM) that occur in response to vascular injury, CVD, and aging.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu çalışmada hayvan çalışmaları Pennsylvania Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komiteleri tarafından onaylandı. Yöntemi onaylanmış talimatlarına uygun olarak gerçekleştirilmiştir.
1. Fare ve Aort izolasyonu hazırlanması
- periton boşluğu içine - (2 mg / kg 1) - (- 100 mg / kg 80), ksilazin (8, 10 mg / kg) ve ketamin asepromazin bir fare anestezisi. Bir kuyruk tutam testi ile anestezi onaylayın. Fare tamamen uyuşturulduktan sonra, servikal dislokasyon ile fare euthanize.
- Sırtında fare yerleştirin ve bir diseksiyon kurulu fare pin. % 70 ile karın bölgeyi temizleyin (v / v) etanol mendil.
- orta çizgisinde cildi çimdik ve karın orta ölçekli mikrocerrahi makas ile küçük bir başlangıç kesi yapmak. forseps ile cilt tutarken, sternum karın deri ve periton kesmek için orta ölçekli mikrocerrahi makas kullanın.
- b kaburga kesiporta ölçekli mikrocerrahi makas ile oth taraf. Dikkatle küçük boyutlu mikrocerrahi makas ile akciğerler ve karaciğer kaldırmak ve kalp ve aort bırakın. Bir mikroskop fare ve diseksiyon tahtası aktarın.
- küçük forseps ile aort çevreleyen yağ kavrayın ve küçük bir makas kullanın dikkatle aort etrafında yağ kesip.
- Yavaşça, forseps ile aorta kapmak sadece abdominal aorta üzerinde, çıkan aort ve inen aort sonunda başka bir kesimin başında küçük boyutlu mikrocerrahi makas ile bir kesim yapmak.
- (Kalsiyum ve magnezyum içermeyen PBS) 1 x fosfat tamponlu tuzlu su ihtiva eden bir 60-mm çanak kesilerek aort aktarın.
- küçük boyutlu mikrocerrahi makas kullanarak aort kalan yağ dokusu uzak teşrih devam ediyor. uzunlamasına aorta açmak için küçük bir makas kullanın.
- İnen aorta ve aorti küçük bir parça (~ 2 x 4 mm) kesmek için, küçük ölçekli mikrocerrahi makas kullanınAFM analizi c kemer (Şekil 1). 60 mm'lik plastik tabak doku yerleştirin ve PBS damla nemli tutmak.
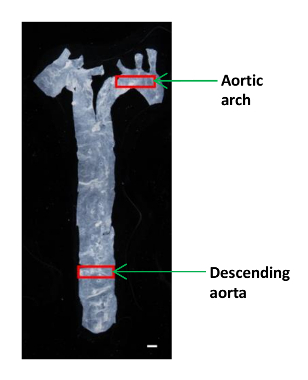
Şekil 1:. Bir fare Farklı Aort Bölümleri Yer gösteriliyor An Image aort diyaframa kalbinden izole edildi ve inen aort küçük bir kısmı ve aortik ark elastik modüle belirlemek için kullanıldı. Ölçek çubuğu, 1 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
AFM Ölçümleri 2. Hazırlama Doku Örnekleri
- Dikkatlice aort dokunmadan laboratuvar silin kullanarak PBS kaldırmak. doku luminal tarafı yukarı bakacak şekilde emin olun.
- Yavaşça eklenti tarafından plakaya açılan aorta her bir ucunu tutkal 5 ing - jel yükleme ucu siyanoakrilat yapıştırıcı madde 10 ul (Şekil 2).
Not: sıkıca her bir ucunda doku bağlamak için gerekli olan tutkal miktarı deneysel olarak tespit edilmelidir. Aort Bu işlem sırasında gergin olmadığı önemlidir. - katlanmış veya yüzer değil emin olmak için yapıştırılmış aort kontrol edin. aort tutkal hava kurutulduktan sonra (30-60 sn), nazikçe PBS ekleyin ve örnek daldırın.
Not: - Doku analiz için hazırlanmıştır edilirken gerçekleştirilebilir Preparasyon AFM (5 3 adım).

Şekil 2: Bir Aort Segment Karikatür Siyanoakrilat Yapıştırıcı kullanarak 60 mm Kültür Bulaşık üzerine yapıştırılmış siyanoakrilat yapıştırıcı AFM ölçümleri için hazırlık aort numunenin kenarına uygulanmaktadır..com / files / ftp_upload / 54630 / 54630fig2large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
3. Probe yükleniyor
- Sonda yük standın üzerine bir sıvı sonda tutucu monte edin.
- Cımbız kullanarak, küresel uçlu bir silisyum nitrür AFM probu (0.06 N / m konsol) kaydırın prob tutucu (biz 1-mikron çaplı SiO2 parçacık kullanmış ancak daha büyük boyutlarda da kullanılabilir). AFM probu sıkıca prob tutucuya tespit olduğundan emin olun.
- AFM kafa monte Z-tarayıcı üzerine sonda yuvasını ve prob tutucu sıkıca bağlı olduğundan emin olun.
4. Prob Lazer hizalama
- AFM yazılımını açın. Yazılımın deneme türünü seçin, Deney Kategori sıvısında Modu İletişim sıvı ve Deney Modu İletişim Mode, Deney Grubu İletişim için. Yük exp tıklayınyazılım eriment; Bu lazer açılacaktır.
- 50 mm 'lik cam taban çanak damıtık su 3 ml ilave edilir ve lazer ayar biriminin sahnede çanak yerleştirin. Bu birim konsol sırtına lazer ışınını odaklama sürecini kolaylaştırır.
- lazer hizalama ünitesi üzerindeki lazer hizalama ünitesi ve güç üzerine dik bir pozisyonda AFM baş takın. AFM ucunda bir damlacık oluşturulması için damıtılmış suyun yaklaşık 50 ul ekle.
- AFM ucu çanak su ile temas yapar böylece joystick'i kullanarak, AFM baş aşağı indirin. iletişim çanak AFM ucu ile su arasında yapılmaması durumunda kontak yapılıncaya kadar, hafifçe çanak yükseltmek. AFM ucu hizalama biriminin LCD ekranda görünümünde yani odak, parlaklık ve XY konumunu ayarlayın.
- AFM baş lazer konumlandırma düğmeleri ayarlayarak AFM prob ucuna lazer nokta yerleştirin. varsaymak ayarlamak, AFM kafasına detektör konumlandırma düğmeleri kullanarak0 ve -1 V arasında değerler kadar fotodiyot iyon dikey saptırma için elde edilir ve ~ 0 V yatay saptırma için elde edilir.
- Lazer toplamı sinyali maksimize emin olmak için kontrol edin. Gerekirse, adımı tekrarlayın 4.5 AFM ucunda lazer ışını ve maksimum toplam sinyalini elde etmek fotodiyot pozisyon konumunu yeniden ayarlamak için.
NOT: adım 4.5 tekrarlanır bile maksimum toplamı sinyali elde etmek prob tutucu AFM probu yeniden konumlandırmak için gerekli olabilir.
5. AFM Probe Sapma Duyarlılık ve Bahar Constant kalibre
- Bir forsepsi ile 60 mm kültür kaplarına bir çizik yapın ve saf su ile çanak doldurun. Numune tutucu plaka üzerinde kültür çanak yerleştirin. Bu durumda, bir ters mikroskop motorlu XY tarama sahnede çanak monte edin.
- o görüntüleme sırasında güvenli tutmak için plaka üstünde manyetik plaka tutucu yerleştirin.
- tıklayın Neredeyse en yüksek konuma AFM baş yukarı taşımak için yazılıma Navigasyon menüsünde 'Up' ok AFM prob çanak dokunmayın emin olmak için.
NOT: AFM ucu kırılma önler bu adım çok önemlidir. - mikroskop sahnede AFM baş yerleştirin.
- plaka üzerinde sıfırdan odaklanmak mikroskop kullanın. Joystick'i kullanın, ya da yavaş ve dikkatli PBS içine AFM probu düşürmek için, Navigasyon menüsünden 'down' oku tıklatın. Biraz plaka sıfırdan yukarıdaki baş pozisyonu.
NOT: AFM başın başlangıç konumu numunesi yakın ise, önemli ölçüde azalacaktır zaman meşgul. - çekici önce, AFM ucunda lazer ışını ve gerektiğinde maksimum TOPLA sinyalini elde etmek fotodiyot pozisyon konumunu yeniden ayarlayın.
- Kurulum menüsünde Değiştir Probe tıklayarak bir ipucu türünü seçin.
- Parametreleri kontrol edin ve parametrelerini ayarlamak düğmesini tıklayın: 256 1 Hz, Numune / hattına, 0 Tarama Hızı Tarama Boyutu ve Sapma Ayar Noktası 20 nm. Engage tıklayın. Sonda plaka yüzeyi ile temas edene kadar Engage Durum penceresi açık kalacaktır. Prob katıldıktan sonra, Rampa tıklayın.
- Parametreleri Tara Araç Çubuğu menüsünde Mode Expanded ve set seçeneğini tıklayın: 2 Hz Rampa Oranı, nm 500 ile 1 mikron Rampa Boyutu, 256 Numune Sayısı, İpucu Radius 500 nm, 0.5 (Numune Poisson Oranı malzemesini varsayar ölçülecek 20 ila 100 nm Karşılıklı ve tetikleme eşiğini 0 ila Tip yarım açı, Tetik modu), mükemmel sıkıştırılamaz.
- obta için Rampa Çubuğu menüsünde Rampa Sürekli tıklayınplaka (Şekil 3A) üzerine bir kuvvet eğrisi. Bu kuvvet eğrisinin, saptırma hata kanal 1 olarak ayarlayın.
NOT: Bu yazılım z pozisyonuna karşı dikey saptırma olarak sonuçları grafik sağlayacaktır.- Kuvvet eğrisinin sol veya sağ ucunda tıklayın ve kuvvet eğrisi (Şekil 3A, kesik kırmızı çizgiler) lineer bir bölgeyi kapsayacak şekilde imleci sürükleyin. düz bir çizgi ile uygun olması eğimli bölgenin sınırlarını işaretlemek için bu iki satır kullanın.
- Araç Çubuğu Rampa seçeneğini seçiniz ve Update Duyarlılığı tıklayın. değerini kaydedin ve bu adımı dört kez daha tekrarlayın. Araç Çubuğu Kalibre seçin ve ardından Dedektörü tıklayın. Giriş Saptırma duyarlılık kutusuna beş ölçümün ortalama bir değer.
- AFM baş yükseltmek için 3 kez - 2 Çekme tıklayın. Bu adım önlemek için önemlidirAFM ucu ve termal ayar işlemi sırasında plaka arasındaki etkileşim. Araç Çubuğu Termal Melodisi tıklayın.
- Dikdörtgen konsollar için V şeklindeki konsollar için 1.144 ve 1.106 100 kHz (Bu bilgiler üreticinin katalog temin edilebilir) ve Eğilme Duyarlılık Düzeltme - Termal 1 Tune Aralığı ayarlayın.
- Termal Dinle menüsünde, termal ayar eğrisi (Şekil 3B) elde etmek için Veri Al'ı tıklatın. AFM yazılımı kullanarak, yer kırmızı montaj için sınırlarını tanımlamak için grafiğin kenarından fareyi sürükleyerek (Şekil 3B görüldüğü gibi) eğrisinin iki tarafında kesikli çizgiler. Seçin ya Lorentz (Hava) veya daha iyi verilere uygun olduğu bağlı Basit Harmonik osilatör (Akışkan) modeli.
- Fit Veri ardından Bahar K hesaplayın ve bu değeri kaydetmek tıklayın. Yenidenyay sabiti kalibrasyon sağlamaktadır birkaç kez turba ve ortalama değeri kullanın. Birkaç kez çekin tıklayın.
- mikroskop aşamasından AFM baş kaldırmak ve hizalama ünitesinde üzerine yerleştirin. mikroskop aşamasından çanak çıkarın.
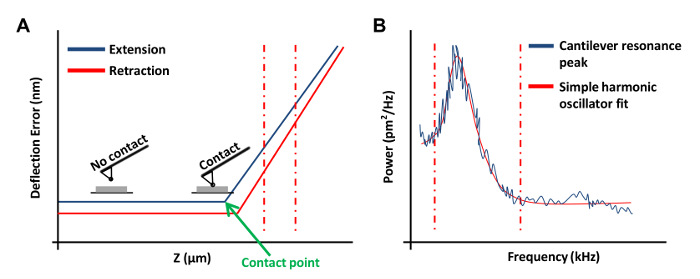
Şekil 3: AFM Sondalar kalibrasyonu Kullanılan AFM Kuvvet Eğrileri. (A) temsilci AFM kuvvet eğrisi (kalibrasyon eğrisi). Dikey kırmızı arasındaki kuvvet eğrisinin uzatma bölümü çizgileri konsol saptırma duyarlılığını belirlemek için kullanılmıştır kesik. (B), daha önce 20 açıklanan konsolun yay sabitini hesaplamak için kullanılan basit bir harmonik osilatör uygun grafik. Görüntülemek için tıklayınız Bu rakamın daha büyük bir versiyonu.
6. Fare Arter Ex Vivo Elastik Modülü Ölçme
- mikroskop sahnede aort doku içeren 60 mm kültür çanak yerleştirin ve manyetik plaka tutucu plaka sabitleyin.
- mikroskop sahnede AFM baş yerleştirin. AFM prob aorta ile temas etmediğinden emin olun ama nazikçe PBS ile temas eder ve bir menisküs oluşturur. Gerekirse, hizalama ünitedeki AFM baş koyun ve sonra, teması önlemek mikroskop sahnede AFM baş yerleştirmek için yeterli açıklık kalmayıncaya kadar Çekme tıklayın.
- Şuraya tıklayın. Yavaşça AFM probu düşürmek, joystick kullanarak veya ok 'Aşağı' düğmesini tıklayarak aort üzerinde konsol bulmak için. Gerekirse AFM kafasına detektör konumlandırma düğmeleri kullanarak fotodiyot konumunu ayarlayın.
- Konsol aorta ile temas kurmaya izin Engage seçeneğini tıklayın.
- Bir kereAort devreye girer, piezo merkezi istikrarlı olmasını sağlamak ve Rampa tıklayın. Piezo merkezi dalgalanan ise, bu yanlış bir angajman sonucu olabilir. prob çekin ve küçük artışlarla fotodiyot üzerine lazer ofset dikey artırmak (~ 0.5 V) ve yeniden meşgul.
- Sonda çok örnek yüzeyinin üzerinde ise de, elle yakın örnek yüzeyine probu düşürmek yeniden çekici önce. Önceki adımlar dalgalanmayı ortadan kaldırmak yoksa, prob alışverişi deneyin.
- 3 um, Bağıl Trigger Mode ve 100 nm Tetik Eşik Rampa Boyutu ayarını ve Rampa Sürekli tıklayın. prob ve numune arasındaki temas noktası Z rampa döngüsünün ¾ alt yaklaşık merkezinde meydana gözlemleyin. Bu gözlenmez ise, örnek boşa gerektiği gibi Rampa boyutunu ayarlamak ve örnek yeniden meşgul.
- Menü Bar Mikroskop tıklayın ve ardından Ayarlar Engage. SPM 30 mikron Çekme değiştirin. Rampa Araç Çubuğu menüsünde Rampa Sürekli tıklayın.
- Kuvvet eğrisi gözlemledikten sonra, Menü çubuğundaki yakalama tıklatın ve Dosya adı yakalayın. biten ".000" (bu ek yakalanan dosyalar 1 ile sayısındaki artış sağlayacak) ile istenen dosya adı girin. belirlenmiş-klasörü seçin ve verileri kaydetmek.
- Yakalama Araç Çubuğu menüsünde yakalama tıklayın. Sonra Şuraya çekiniz ve tıklayın. Aort başka alana konsol konumlandırmak için Joystick veya yazılım kontrollerini kullanın (sonraki başlangıçta ölçülen noktaya; Şekil 4).
- , Rampa Engage tıklayın ve sırasıyla, Sürekli Rampa. Kuvvet eğrisi gözlemledikten sonra, Durdur 'u tıklatın ve ardından yakalayın.
- 6.10 - yineleyin 6.9 adımları. . Alan başına yakalama en az 5 ölçümleri, Şekil 4 Not gösterildiği gibi: Bu tipik olarak 15 toplama - Şekil 4 'de gösterildiği gibi, sırasıyla, her bir doku 5 farklı yerle - 3 ila 25 güç eğrileri.
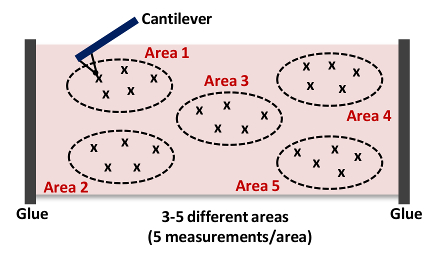
. Şekil 4: Genel sertliğini elde etmek her arter - 5 farklı yerlerde (5 Alanları 1 -) - 3 25 kez Cantilever Yaklaşıyor ve Doku Hizalama (Alan 1) Cartoon Bu AFM ölçümü 15 kadar tekrarlanır doku numunesi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
7. Veri analizi
- Açık kuvvet eğrisi analizi yazılımı.
- ClTran bulun ve menü çubuğunda Aç ve dosya üzerinde çift tıklayın analiz edilecek.
- Saptırma duyarlılığını, Sabit Bahar, İpucu Radius, İpucu Yarım Açısı ve Poisson oranını kontrol etmek için araç çubuğu menüsünden Değiştir Kuvvet Parametreleri tıklayın. Parametreler yanındaki kutuyu işaretleyin ve yeni değer sütununa doğru değerleri girin değiştirmek için. Sonra Çalıştır 'ı tıklatın.
- Kuvvet eğrileri gürültülü ise Yön 0 inci 3 ve Filtre Order, Ortalama Puan uzatın için, Boxcar Filtre tıklayın ve girdileri ayarlayın. Verileri düzeltmek için Yürüt düğmesini tıklatın.
- Menü çubuğundaki Temel Düzeltme tıklayın ve 1 st Yön uzatın için girdiler, Force Plot Birimleri, Ayırma Tipi, Düzeltme Sipariş ayarlamak ve Temel Kaynak Extend uzatmak için. Kuvvet eğrisinin düz kısmı kapsayacak şekilde dikey noktalı mavi çizgiler ayarlayın ve sonra Çalıştır 'ı tıklatın.
- Araç çubuğu menüsünden girinti tıklayın ve uyulmuş değişkeni davranın Point Esaslı, Temas Noktası Algoritma İletişim Genişletilmiş, sığdır Yöntem Aktif Eğrisi için girdi ayarlamak, No yapışma Gücü Max Kuvvet Fit Sınır% 30, Min Kuvvetleri Fit Sınırının için ekleyin % 0 ve Hertz (Spherical) sığdır Modeli.
NOT: Bizim ölçümlerinde, ucu ve örnek (retraksiyon eğrisinde konsolun olumsuz sapma) arasında önemli yapışma nadiren gözlenmiştir. Bu yapışma görülen durumlarda, uygun bir model (DMT ya JKR) analiz 18,19 için kullanılmalıdır. - Young modülü değerlerini kaydedin. 3 Her Young (elastik) modülü analiz- Şekil 4 'de gösterildiği gibi birbirine küçük mesafede alınan 5 alanı (alan başına 5 kuvveti eğrileri).
NOT: eserler kaldırmak Young modülüne> 100 kPa hariç tutmak için (normalde ~ toplam ölçümlerin% 10) analizinden. - 3 her biri için bir ortalama Young Modülü değerini hesaplayın - (ölçülmüştür) 5 alanları ve bir bütün olarak aort için ortalama bir esneklik modülüne hesaplamak için bu değerleri kullanır.
NOT: En az 3 ve daha sık 4-6 ayrı aorta arteriyel sertlik doğru bir şekilde değerlendirmesini elde etmek için kullanılır. Nihai sonuçlar, "n" bağımsız deneyin ortalama ± SEM olarak çizilmiştir. gerekli aorta tam sayısı, tabii ki, gerekli hassasiyet düzeyine bağlı olacaktır.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 5A 6 aylık, erkek C57BL / 6 fare azalan (torakal) aorta bir faz kontrast görüntü gösterir. AFM konsol doğrudan dokuda üzerinde yer alıyor ve girinti hazır. Şekil 5B ve 5C temas modunda AFM girinti ile elde edilen temsili kuvvet eğrileri göstermektedir. Şekil 5B ve 5C gösterilen yeşil çizgiler bir küre için Hertz modeli kullanılarak elde en uygun eğrileri temsil etmektedir. Metinde tarif edildiği gibi
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
AFM girinti hücre ve dokuların sertliği (esneklik katsayısı) karakterize etmek için kullanılabilir. Bu yazıda fare azalan aort ve aort arkı izole etmek ve bu arter bölgelerin ex vivo elastik modüle belirlemek için ayrıntılı adım adım protokolleri sağlar. Biz şimdi özetlemek ve bu yazıda anlatılan yöntemin teknik konuları ve sınırlamaları tartışmak.
Çeşitli teknik konular izolasyonu ve bunların küçük ve ince yapısı verilen fare aorta analizinde or...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
AFM analysis was performed on instrumentation supported by the Pennsylvania Muscle Institute and the Institute for Translational Medicine and Therapeutics, Perelman School of Medicine, the University of Pennsylvania. This work was supported by NIH grants HL62250 and AG047373. YHB was supported by post-doctoral fellowship from the American Heart Association.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BioScope Catalyst AFM system | Bruker | ||
| Nikon Eclipse TE 200 inverted microscope | Nikon Instruments | ||
| Silicon nitride AFM probe | Novascan Technologies | PT.SI02.SN.1 | 0.06 N/m cantilever; 1 µm SiO2 particle |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | See section 1.4 |
| Dumont #5SF forceps | Fine Science Tools | 11252-00 | See section 1.8 |
| Fine Scissors-ToughCut | Fine Science Tools | 14058-11 | See section 1.4 (medium sized) |
| Vannas-Tübingen spring scissors | Fine Science Tools | 15008-08 | See section 1.6 (small sized) |
| 60 mm TC-treated cell culture dish | Corning | 353004 | |
| Dulbecco's Phosphate-Buffered Saline, 1x | Corning | 21-031-CM | Without calcium and magnesium |
| Krazy Glue instant all purpose liquid | Krazy Glue | KG58548R | See section 2.2 |
| Gel-loading tips, 1 - 200 µl | Fisher | 02-707-139 | See section 2.2 |
| Tip Tweezers | Electron Microscopy Sciences | 78092-CP | See section 3.2 |
| 50-mm, clear wall glass bottom dishes | TED PELLA | 14027-20 | See section 4.4 |
Referanslar
- Kothapalli, D., et al. Cardiovascular Protection by ApoE and ApoE-HDL Linked to Suppression of ECM Gene Expression and Arterial Stiffening. Cell Rep. 2, 1259-1271 (2012).
- Liu, S. -L., et al. Matrix metalloproteinase-12 is an essential mediator of acute and chronic arterial stiffening. Sci Rep. 5, 17189(2015).
- Lakatta, E. G. Central arterial aging and the epidemic of systolic hypertension and atherosclerosis. J Am Soc Hypertens. 1, 302-340 (2007).
- Stehouwer, C. D. A., Henry, R. M. A., Ferreira, I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. Diabetologia. 51, 527-539 (2008).
- Steppan, J., Barodka, V., Berkowitz, D. E., Nyhan, D. Vascular Stiffness and Increased Pulse Pressure in the Aging Cardiovascular System. Cardiol Res Pract. 2011, 263585(2011).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Mitchell, G. F., et al. Arterial Stiffness and Cardiovascular Events: The Framingham Heart Study. Circulation. 121, 505-511 (2010).
- Sutton-Tyrrell, K., et al. Elevated Aortic Pulse Wave Velocity, a Marker of Arterial Stiffness, Predicts Cardiovascular Events in Well-Functioning Older Adults. Circulation. 111, 3384-3390 (2005).
- Klein, E. A., et al. Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Curr Biol. 19, 1511-1518 (2009).
- Bae, Y. H., et al. A FAK-Cas-Rac-lamellipodin signaling module transduces extracellular matrix stiffness into mechanosensitive cell cycling. Sci signal. 7, ra57(2014).
- Thyberg, J., Hedin, U., Sjölund, M., Palmberg, L., Bottger, B. A. Regulation of differentiated properties and proliferation of arterial smooth muscle cells. Arterioscler Thromb Vasc Biol. 10, 966-990 (1990).
- Owens, G. K., Kumar, M. S., Wamhoff, B. R. Molecular Regulation of Vascular Smooth Muscle Cell Differentiation in Development and Disease. Physiol Rev. 84, 767-801 (2004).
- Huynh, J., et al. Age-Related Intimal Stiffening Enhances Endothelial Permeability and Leukocyte Transmigration. Sci Transl Med. 3, 112ra122(2011).
- Safar, M. E., Levy, B. I., Struijker-Boudier, H. Current Perspectives on Arterial Stiffness and Pulse Pressure in Hypertension and Cardiovascular Diseases. Circulation. 107, 2864-2869 (2003).
- Raffetto, J. D., Khalil, R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 75, 346-359 (2008).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat Nanotechnol. 3, 261-269 (2008).
- Hsu, B. Y., Bae, Y. H., Mui, K. L., Liu, S. -L., Assoian, R. K. Apolipoprotein E3 Inhibits Rho to Regulate the Mechanosensitive Expression of Cox2. PLoS ONE. 10, e0128974(2015).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface Energy and the Contact of Elastic Solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. J Colloid Interface Sci. 53, 314-326 (1975).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev Sci Instrum. 64, 1868-1873 (1993).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Arch EJP. 440, 653-666 (2000).
- Pogoda, K., et al. Depth-sensing analysis of cytoskeleton organization based on AFM data. Eur Biophys J. 41, 79-87 (2012).
- Mendez, M. G., Restle, D., Janmey, P. A. Vimentin Enhances Cell Elastic Behavior and Protects against Compressive Stress. Biophys J. 107, 314-323 (2014).
- Moreno-Flores, S., Benitez, R., Md Vivanco,, Toca-Herrera, J. L. Stress relaxation and creep on living cells with the atomic force microscope: a means to calculate elastic moduli and viscosities of cell components. Nanotechnology. 21, 445101(2010).
- Darling, E. M., Topel, M., Zauscher, S., Vail, T. P., Guilak, F. Viscoelastic properties of human mesenchymally-derived stem cells and primary osteoblasts, chondrocytes, and adipocytes. J Biomech. 41, 454-464 (2008).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of Elastic Moduli of Thin Layers of Soft Material Using the Atomic Force Microscope. Biophys J. 82, 2798-2810 (2002).
- Mahaffy, R. E., Shih, C. K., MacKintosh, F. C., Käs, J. Scanning Probe-Based Frequency-Dependent Microrheology of Polymer Gels and Biological Cells. Phys Rev Lett. 85, 880-883 (2000).
- Amin, M., Le, V. P., Wagenseil, J. E. Mechanical Testing of Mouse Carotid Arteries: from Newborn to Adult. J Vis Exp. , e3733(2012).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27, 2588-2605 (2006).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nat Nano. 7, 757-765 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat Nano. 6, 809-814 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır