A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جيل من الفئران المعدلة وراثيا من خلال ميكروينجكتيون من البويضات
In This Article
Summary
يستخدم حقن ميكروينجكتيون من البويضات الماوس لكل من ترانسجينيسيس الكلاسيكية ( أي التكامل العشوائي للجينات المحورة وراثيا) و كريسبر بوساطة استهداف الجينات. هذا البروتوكول يستعرض أحدث التطورات في ميكروينجكتيون، مع التركيز بشكل خاص على مراقبة الجودة واستراتيجيات التنميط الجيني.
Abstract
وقد ساهم استخدام الفئران المعدلة وراثيا بشكل كبير في الدراسات على كل من الفسيولوجية والمرضية في عمليات الجسم الحي . حقن برونوكلار من التعبير الحمض النووي يبني في البويضات المخصبة لا يزال الأسلوب الأكثر شيوعا لتوليد الفئران المعدلة وراثيا ل أوفيركسريسيون. مع إدخال تكنولوجيا كريسبر لاستهداف الجينات، وقد تم تمديد حقن برونوكلار في البويضات المخصبة لتوليد كل من خروج المغلوب والفئران نوكين. ويصف هذا العمل إعداد الحمض النووي للحقن وتوليد أدلة كريسبر لاستهداف الجينات، مع التركيز بشكل خاص على مراقبة الجودة. إجراءات التنميط الجيني المطلوبة لتحديد المؤسسين المحتملين أمر بالغ الأهمية. وترد في هذا التقرير استراتيجيات مبتكرة للتنميط الجيني تستفيد من قدرات "تعدد الإرسال" في نظام كريسبر. كما يتم تحديد الإجراءات الجراحية. معا، فإن خطوات البروتوكول تسمح لتوليد جينالفئران المعدلة إيكاليا ولإنشاء لاحق من مستعمرات الماوس لمجموعة كبيرة من مجالات البحث، بما في ذلك علم المناعة، علم الأعصاب، والسرطان، وعلم وظائف الأعضاء، والتنمية، وغيرها.
Introduction
وكانت النماذج الحيوانية، سواء في الفقاريات واللافقاريات، مفيدة لفحص الفيزيولوجيا المرضية للظروف البشرية مثل مرض الزهايمر 1 ، 2 . وهي أيضا أدوات لا تقدر بثمن للبحث عن معدلات المرض وتطوير استراتيجيات العلاج الجديدة في نهاية المطاف على أمل العلاج. على الرغم من أن كل نموذج له قيود جوهرية، واستخدام الحيوانات والنماذج النظامية بأكملها أمر حيوي للبحوث الطبية الحيوية. وذلك لأن البيئة الفسيولوجية الأيضية والمعقدة لا يمكن محاكاة تماما في زراعة الأنسجة.
حتى الآن، لا يزال الفأر أنواع الثدييات الأكثر شيوعا المستخدمة في التلاعب الجيني لأنه يتميز العديد من المزايا. يتم حفظ العمليات الفسيولوجية والجينات المرتبطة بالأمراض بشكل كبير بين الفئران والبشر. كان الفأر أول حيوان ثديي له تسلسله الكامل للجينوم (2002)، قبل سنة واحدة من الجين البشريلي (2003). وبصرف النظر عن هذه الثروة من المعلومات الوراثية، والفأر لديه قدرات تربية جيدة، دورة تنمية سريعة (6 أسابيع من الإخصاب إلى الفطام)، وحجم معقول. كل هذه المزايا، إلى جانب المؤشرات الفسيولوجية، مثل الألوان معطف متميزة (المطلوبة لاستراتيجيات عبور)، وجعل الماوس نموذجا جذابا للتلاعب الجيني. ومن الجدير بالذكر أنه في سن مبكرة جدا من علم الوراثة الحديثة، بدأ جريجور مندل العمل على الفئران قبل الانتقال إلى النباتات 3 .
وأسفرت تقنيات نقل الجينات عن توليد الفأرة المعدلة وراثيا الأولى على مدى ثلاثة عقود مضت 4 ، التي تم إنشاؤها في البداية باستخدام الولادة الفيروسية. ومع ذلك، سرعان ما أدرك الباحثون أن واحدة من التحديات الرئيسية للالترانزجينيس الماوس هو عدم القدرة على السيطرة على مصير الحمض النووي خارجي. لأن التسليم الفيروسي من الجينات المحورة في البويضات الماوس أدى إلى نسخ متعددة متكاملة بشكل عشوائي في الجينوم، و بوسيبيليتذ من إنشاء خطوط المعدلة وراثيا اللاحقة كان محدودا.
تم التغلب على أحد هذه القيود عندما غوردون وآخرون. ولدت أول خط الماوس المعدلة وراثيا بواسطة ميكروينجكتيون 5 ، 6 . بدأ هذا عصر تكنولوجيا الحمض النووي المؤتلف، والمعلمات التي تؤثر على نتائج جلسة ميكروينجكتيون وقد درست على نطاق واسع 7 . على الرغم من أن ميكروينجكتيون لا يسمح للسيطرة على موقع التكامل من التحوير (الذي يؤدي في نهاية المطاف إلى مستويات التعبير محددة لكل مؤسس الماوس)، والميزة الرئيسية لل ميكروينجكتيون برونوكلار يبقى تشكيل المحاور ( أي صفائف من نسخ متعددة من التحوير، مرتبطة في سلسلة) قبل التكامل الجيني 5 . وقد استخدمت هذه الخاصية على مر السنين لإنشاء الآلاف من خطوط الماوس المعدلة وراثيا التي أوفيركسريس الجين من الفائدة. ومنذ ذلك الحين، ترانسجينيسيس، والتعديل الجيني لجينوم الكائن الحي، وقد استخدم على نطاق واسع لتحديد دور الجينات واحدة في حدوث الأمراض.
تم تحقيق إنجاز رئيسي آخر في التلاعب الجينوم الماوس عندما ماريو كابيتشي تعطل بنجاح الجين واحد في الماوس، وفتح عصر الجينات استهداف 8 . ومع ذلك، ظهرت العيوب الرئيسية بسرعة من الخلايا الجذعية المستندة إلى الخلايا الجذعية المستقرة، بما في ذلك تحديات زراعة الخلايا الجذعية السرطانية، ودرجة متغير نوعا ما من الخيمرية، وطول العملية ( أي 12-18 شهرا، والحد الأدنى، للحصول على الماوس) .
في الآونة الأخيرة، ظهرت أوجه التقدم في التكنولوجيات الجديدة، مثل إندونوكليسيس المهندسة (على سبيل المثال، نوكليسيس الإصبع الزنك (زفن)، النسخ المنشط مثل نوكليسيس المستجيب (تالين)، وتجمعات منتظمة متداخلة قصيرة متداخلة قصيرة (كريسبر / Cas9)) كطرق بديلة ل وتسريع عملية استهداف الجينات في هيئة التصنيع العسكريe 9 ، 10 . يمكن حقن هذه إندونوكليس بسهولة في البويضات الماوس عن طريق ميكروينجكتيون، مما يسمح لتوليد الفئران المستهدفة الجينات في اقل من 6 أسابيع.
منذ التقرير الأول عن استخدام كريسبر لتحرير الجينوم 11 ، هذا الجهاز المناعي التكتيكي الجرثومي قد حل محل زفن و تالين بسبب العديد من المزايا، بما في ذلك سهولة التوليف والقدرة على استهداف موقع متعدد في وقت واحد (المشار إليها باسم "تعدد الإرسال "). تم استخدام كريسبر لأول مرة لاستهداف الجينات في الفئران 12 ومنذ ذلك الحين تم تطبيقها على عدد لا يحصى من الأنواع، من النباتات إلى البشر 13 ، 14 . وحتى الآن، لا يوجد تقرير عن نوع واحد مقاوم لتحرير الجينوم كريسبر.
اثنين من الخطوات الرئيسية المحددة لتوليد الفئران المعدلة وراثيا هي حقن البويضات وإعادة زرعمن هذه البويضات في الإناث الحوامل الزائفة. على الرغم من أن هذه التقنية قد وصفها لنا 15 وآخرون 16 ، والتحسينات التقنية الأخيرة في علم الأجنة الماوس وتقنيات نقل الجينات ثورة في عملية توليد الفئران المعدلة وراثيا. وسيتم وصف هذه التحسينات هنا.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد تمت الموافقة على جميع الإجراءات من قبل جامعة نيو ساوث ويلز رعاية الحيوانات والأخلاقيات اللجنة.
1. إعداد التحوير (التكامل العشوائي)
- تحليلي أغاروس هلام الكهربائي.
- هضم البلازميد لاستخراج التحوير باستخدام الانزيمات المناسبة (1 ساعة حضانة) أو سريع الهضم الإنزيمات (15 إلى 30 دقيقة الحضانة) في ثيرمويكلر بعد توصيات الشركة الصانعة (انظر الشكل 2A وأسطوره).
- يلقي حمض 1٪ تريس أسيتات-إثيلينديامينيتتراسيتيك حمض (إدتا) (تي) أغاروس هلام، ملطخة 0.5-1.0 ميكروغرام / مل إيثيديوم بروميد (إتبر).
ملاحظة: توخي الحذر عند استخدام إيتبر؛ بل هو طفرات قوية. يرجى استخدام معدات الوقاية الشخصية المناسبة (راجع ورقة بيانات سلامة المواد). - تحميل 1 كيلوبايت علامة الوزن الجزيئي.
- تحميل شظايا الخطية ( أي التحوير والعمود الفقري).
- تشغيل الكهربائي في 100 V لمدة 45 دقيقة.
- تصور هلام على الأشعة فوق البنفسجية ترانسيلوميناتور للتحقق من أن عملية الهضم كاملة وتأكيد الحجم الصحيح للتحوير ( أي 7،338 نقطة أساس، انظر الشكل 2A ).
- استعداد أغاروس هلام الكهربائي.
- يلقي هلام الاغاروز تاي 1٪ ملطخة مع انخفاض سمية هلام وصمة عار. تحميل 8 أليكوتس (1 ميكروغرام لكل منهما) من التحوير الخطي دون علامة الوزن الجزيئي وتشغيل الكهربائي في 100 V لمدة 45 دقيقة. استخدام مشرط لاستئصال جميع 8 نطاقات المقابلة للتحوير الخطي.
- استخراج الحمض النووي باستخدام مجموعة استخراج هلام باتباع توصيات الشركة المصنعة (انظر جدول المواد ).
- تذوب شظايا هلام في 50 درجة مئوية في أنابيب 1.5 مل لمدة 15 دقيقة على الأقل. يعجل ذلك مع الأيزوبروبانول ومن ثم إضافة العازلة ملزمة.
- الجمع بين كامل Dنا بواسطة بيبتينغ كل ذلك في عمود واحد. أزل في نوكليس خالية من العازلة ميكروينجكتيون (8 ملي تريس-حمض الهيدروكلوريك و 0.15 ملي إدتا). تصفية من خلال مرشح ميكروسنتريفوج 0.22 ميكرون وأجهزة الطرد المركزي لمدة 60 ثانية في 12000 x ز.
- قياس تركيز ونوعية الحمض النووي باستخدام الطيفي. تحقق من أن نسبة A260 / A280 حوالي 1.8 ( أي عدم وجود تلوث بالبروتينات) ونسبة A260 / A230 هي 2.0 على الأقل ( أي لا تلوث بالمذيبات العضوية). تمييع وصولا الى 3 نانوغرام / ميكرولتر في المخزن ميكروينجكتيون خالية من نوكليس، قسامة (20-50 ميكرولتر)، وتجميد في -20 درجة مئوية.
2. توليف مكونات كريسبر (استهداف الجينات)
- Cas9 مرنا.
- تمييع مرنا Cas9 (تم الحصول عليها من مصدر تجاري، انظر جدول المواد ) إلى تركيز 1 ميكروغرام / ميكرولتر في المخزن المؤقت ميكروينجكتيون خالية من نوكليس.
- قسامة في 2 ميكرولتر وخالية زي في -80 درجة مئوية.
- دليل واحد رنا (سغرنا).
- تحديد تسلسل الجينوم المطلوب (الهدفين) المطلوبين باستخدام أداة تصميم حسابية تسمح الحد الأدنى من النشاط المحتمل خارج الهدف 17 .
- ل خروج المغلوب الجيني، واختيار منهجي اثنين دليل يقع بضع مئات من أزواج قاعدة (بب) وبصرف النظر، في اتجاهات متعاكسة، وتشمل كودون بدء الجين من الفائدة. للحصول على التماثل إصلاح مباشر، حدد اثنين من أدلة متداخلة (كلما كان ذلك ممكنا)، في اتجاهات متعاكسة.
ملاحظة: كمثال على ذلك، وقد تم مؤخرا بنجاح شارك في حقن أدلة التالية لتعطيل أول اكسون الجين TPM4.2 :
الدليل 1: 5 'سغكاتسكاغتكغتك 3'؛
الدليل 2: 5 'كاغاسغتاغكاتغك 3'
- ل خروج المغلوب الجيني، واختيار منهجي اثنين دليل يقع بضع مئات من أزواج قاعدة (بب) وبصرف النظر، في اتجاهات متعاكسة، وتشمل كودون بدء الجين من الفائدة. للحصول على التماثل إصلاح مباشر، حدد اثنين من أدلة متداخلة (كلما كان ذلك ممكنا)، في اتجاهات متعاكسة.
- طلب مجموعة من الاشعال كما هو موضح في الجدول 1 .
- توليف قالب الحمض النووي الخطي.
- تمييع px330ريف "> 12 البلازميد إلى 10 نانوغرام / ميكرولتر في المياه خالية من نوكليس.
- إعداد مزيج الرئيسي كما هو مبين في الجدول 1 . إضافة البلمرة في نهاية والحفاظ على مزيج الرئيسي على الجليد.
- مزيج وتقسيم هذا إلى 8 أنابيب ير (19 ميكرولتر / أنبوب). إضافة 1 ميكرولتر من px330 لكل أنبوب وتشغيل ير في ظل الظروف التالية: 1 دقيقة في 98 درجة مئوية. 40 دورة من 98 درجة مئوية لمدة 10 ثانية، 64 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة 15 ثانية. واستطالة النهائية عند 72 درجة مئوية لمدة 5 دقائق. عقد في 4 درجات مئوية.
- تنقية المنتجات ير باستخدام عدة تنقية ير (انظر جدول المواد )، مشعب، ومصدر فراغ (لمعالجة أسرع). تطبيق أقصى قوة فراغ ( أي 8 ميغا بار).
- إضافة 5 مجلدات (100 ميكرولتر) من العازلة ملزمة إلى 1 حجم عينة ير والمزيج.
- وضع (المقدمة) غشاء السيليكا تدور العمود في (المقدمة) 2-مل أنبوب جمع الطرد المركزي، أو على مشعب لعملية فراغجي. لربط الحمض النووي، على التوالي تطبيق جميع العينات 8 إلى العمود والفراغ أو أجهزة الطرد المركزي لمدة 60 ثانية في 12000 x ج لكل حمولة.
- لغسل، إضافة 0.75 مل من غسل العازلة (العازلة بي) إلى العمود والفراغ أو أجهزة الطرد المركزي لمدة 60 ثانية في 12000 x ز. الطرد المركزي العمود لمدة 60 ثانية في 12000 x ج للقضاء على الإيثانول المتبقية.
- وضع العمود في أنبوب ميكروسنتريفوج 1.5 مل نظيفة. أزل الحمض النووي، إضافة 30 ميكرولتر من نوكليس خالية من المياه إلى مركز الغشاء، والسماح للعمود الوقوف لمدة 1 دقيقة، وأجهزة الطرد المركزي لمدة 60 ثانية في 12،000 ز.
- قياس تركيز باستخدام الطيف. عادة، ينبغي أن يكون تركيز 100 نانوغرام / ميكرولتر أو أعلى. تحقق من أن نسبة A260 / A280 حوالي 1.8 ( أي عدم وجود تلوث بالبروتينات) ونسبة A260 / A230 هي 2.0 على الأقل ( أي لا تلوث بالمذيبات العضوية).
- في المختبر النسخ باستخدام T7 رنا عدة التوليف.
- إعداد tانه مزيج الرئيسي، كما هو مبين في الجدول 1 ، واحتضان لمدة 3 ساعات عند 37 درجة مئوية في ثيرمويكلر. إضافة 28 ميكرولتر من نوكليس خالية من المياه و 2 ميكرولتر من الدناز الأول واحتضان لمدة 15 دقيقة أخرى عند 37 درجة مئوية في ثيرمويكلر.
- تنقية الحمض النووي الريبي باستخدام الأعمدة تدور.
- حل مسحوق الواردة في العمود تدور المقدمة في 650 ميكرولتر من العازلة ميكروينجكتيون خالية من نوكليس، إزالة بعناية جميع فقاعات الهواء. كاب الأنبوب والهيدرات لمدة 5 - 15 دقيقة في درجة حرارة الغرفة.
- إزالة الغطاء الأزرق في الجزء السفلي ووضع العمود في أنبوب 2 مل. أجهزة الطرد المركزي لمدة 2 دقيقة في 750 x ج ودرجة حرارة الغرفة. وضع العمود في أنبوب 1.5 مل الطازجة وتطبيق 50 ميكرولتر من الحمض النووي الريبي حل قطرة قطرة إلى المركز، دون لمس جدار العمود. تدور العمود لمدة 2 دقيقة في 750 × ز.
- قياس تركيز الحمض النووي الريبي باستخدام مطياف (العائد النموذجي من رد فعل واحد هو 30 - 50 ميكروغرام). تحقق من أن نسبة A260 / A280 هي a( أي أي تلوث بالبروتينات) ونسبة A260 / A230 هي 2.0 على الأقل ( أي عدم وجود تلوث بالمذيبات العضوية). تخزين سغرناس في -80 درجة مئوية حتى الاستخدام.
- تقييم نوعية الحمض النووي الريبي باستخدام المواد الهلامية تاي 1٪ تستخدم بشكل روتيني لالدنا الكهربائي. تشغيل 200-400 نانوغرام من قالب الحمض النووي و سغرنا المقابلة بالتوازي. يجب أن تكون الفرقة رنا (≈ 100 بب) أكبر قليلا من الفرقة دنا (انظر الشكل 3A ).
- تحديد تسلسل الجينوم المطلوب (الهدفين) المطلوبين باستخدام أداة تصميم حسابية تسمح الحد الأدنى من النشاط المحتمل خارج الهدف 17 .
3. نموذج المانح
- ترتيب أوليغونوكلأوتيدس تقطعت بهم السبل تجاريا (سوليغوس، انظر جدول المواد ) لطفرات نقطة أو لدمج متواليات صغيرة تصل إلى 50 نقطة أساس. وعادة ما تكون الأسلحة التماثل 60-90 بي بي طويلة.
- لإدخال أكبر، استخدام البلازميد المانحة كقالب. توليد البلازميد المناسبة إما باستخدام أسلوب الاستنساخ الكلاسيكي أو توليف دي نوفو من أمصدر تجاري.
ملاحظة: يوصى بحد أدنى 800 بيب لذراع التماثل. حجم العمود الفقري ليس له تأثير على كفاءة إصلاح التشابه المباشر (هر).
4. حقن ميكس
- تمييع مرنا Cas9 إلى 50 نانوغرام / ميكرولتر و سغرناس إلى 12.5 نانوغرام / ميكرولتر (25 نانوغرام / ميكرولتر في المجموع) باستخدام نوكلياز خالية من ميكروينجكتيون العازلة للتجارب خروج المغلوب الجينات. إضافة قالب المانحة (سوليغو أو البلازميد) بتركيز 200 نانوغرام / ميكرولتر لتجارب التحرير الجينوم على أساس التماثل إصلاح مباشر.
ملاحظة: يمكن تحديد أحجام التخفيف بسهولة باستخدام أدوات الإنترنت، مثل آلة حاسبة ريسوسبنسيون 18 . - الحفاظ على كل قسامة على الجليد خلال جلسة ميكروينجكتيون وتجاهل بعد ذلك (لا إعادة تجميد مزيج الحقن).
5. كيس الصفن
ملاحظة: يتم تنفيذ نوعين من استئصال الأسهر عادة في الفئران: البطن والصفن. الأخيرهو أقل الغازية وقد سبق وصفها 15 .
- الأوتوكلاف جميع الأدوات الجراحية الفولاذ المقاوم للصدأ.
- تحديد وزن الماوس باستخدام مقياس وزن وتخدير الذكور عن طريق الحقن داخل الصفاق (إب) مع التخدير عن طريق الحقن (الكيتامين 100 ملغ / كغ، زيلازين 10 ملغ / كلغ).
- رصد فقدان اصبع القدم منعكس قرصة ومرة واحدة هو مكان مسكن الماوس على رأس وسادة التدفئة.
- تطهير الجلد حول الخصيتين مع المناديل بالتناوب من مطهر موضعي مثل الكلورهيكسيدين و 70٪ من الإيثانول.
- دفع الخصيتين في كيس كيس الصفن وجعل شق الجلد مع مشرط.
- تصور الخصية، ذئبة البربخ، والأسهر.
- الاستيلاء على الأسهر مع ملقط، عقده، ويكوى على كل جانب من ملقط لإزالة 3 ملم من الأسهر.
- إجراء نفس الإجراء على الخصية الثانية.
- إغلاق شقوق الجلد مع مقاطع الجرح ومراقبةالماوس عن كثب حتى الانتعاش الكامل.
6. سوبيروفولاتيون (البويضات المانحين) والتزاوج الوقت (الزائفة الحوامل الإناث)
ملاحظة: تم وصف تقنية لتوليد عدد مناسب من البويضات المخصبة وتوصيل الإناث الحاضنة لإعادة زرع في مكان آخر 15 .
- حقن 10 الإناث الملكية الفكرية مع 5 وحدة دولية من الحوامل الغدد التناسلية المصل فرس (بمسغ؛ في 100 ميكرولتر) في حوالي 12 مساء في يوم 1.
- حقن الإناث إب مع 5 وحدة دولية من موجهة الغدد التناسلية المشيمية البشرية (قوات حرس السواحل الهايتية؛ في 100 ميكرولتر) 46-48 ساعة في وقت لاحق (حوالي 11 صباحا في اليوم 3).
- تزاوج على الفور الإناث مع الذكور واحد مبيت بين عشية وضحاها.
7. برونوكلار (التكامل العشوائي) والحقن (استهداف جين) الحقن
- يفرز الفئران سوبيروفولاتد عن طريق خلع عنق الرحم، وفضح البطن، والوصول إلى المبيض وقنوات البيض، كما هو موضح سابقا 15 . تشريح سفيدوكتس وحصاد المركب البويضة المجمعات (كوك) تحت ستيريوميكورسكوب 15 . وضعها في قطرة من البوتاسيوم البسيط الأمثل المتوسطة تستكمل مع الأحماض الأمينية (كسوما) اتباع الطريقة التقليدية 15 .
- تنقية البويضات عن طريق إضافة تقريبا 1 ميكرولتر من هيالورونيداز (10 ملغ / مل) إلى قطرة كسوما المتوسطة باستخدام قطعة الفم الشافطة ووضع الطبق في 37 درجة مئوية / 5٪ كو 2 حاضنة لمدة 30 ثانية إلى 1 دقيقة.
- غسل البويضات مع 4 قطرات جديدة من كسوما المتوسطة باستخدام قطعة الفم الشافطة ونقلها إلى الانخفاض النهائي من كسوما المتوسطة مضافين مع الزيوت المعدنية (حوالي 2 مل). وضع الطبق في 37 درجة مئوية / 5٪ كو 2 حاضنة حتى البويضات جاهزة للحقن.
- حقن برونوكلار (التكامل العشوائي).
- تصور البيض تحت المجهر مجسمة ونقل ما يقرب من 50 بيضة إلى غرفة الحقن (دروص من M2 المتوسطة مضافا مع الزيوت المعدنية) باستخدام قطعة الفم الشافطة.
- نقل غرفة الحقن إلى المجهر مقلوب وحقن البويضات المخصبة (اثنين نواة مرئية) مع عدد قليل من بيكوليترز من مزيج الحقن، واستهداف نواة (أي من نواة يمكن استهداف). تصور حقن ناجحة من خلال مراقبة تورم في النواة.
- الحقن السيتوبلازمية (استهداف الجينات).
- نقل ما يقرب من 50 بيضة إلى قطرة من كسوما تحتوي على 5 ميكروغرام / مل سيتوشالاسين B باستخدام قطعة الفم واحتضان لمدة 5 دقائق في 37 درجة مئوية / 5٪ كو 2 حاضنة.
- نقل البيض إلى غرفة الحقن باستخدام قطعة الفم.
- حقن عدد قليل من بيكوليترز من مزيج الحقن في السيتوبلازم في ضغط منخفض جدا (50-100 هبا)، وذلك باستخدام ضغط التعويض من ميكروينجيكتور الآلي حيثما كان ذلك ممكنا.
- بعد الحقن، ونقل البويضات مرة أخرى إلى قطرة من كسوما (باستخدام قطعة الفم) والاحتفاظ بها في 37 درجة مئوية / 5٪ كو 2 حاضنة، حتى تحميل لإعادة زرع في قناة البيض من الإناث الزائفة الحوامل.
8. إعادة زرع
- الأوتوكلاف جميع الأدوات الجراحية الفولاذ المقاوم للصدأ.
- تحديد وزن الماوس باستخدام مقياس وزن وتخدير الإناث عن طريق الحقن داخل الصفاق (إب) مع التخدير عن طريق الحقن (الكيتامين 100 ملغ / كغ، زيلازين 10 ملغ / كلغ).
- رصد فقدان اصبع القدم منعكس قرصة ومرة واحدة هو مكان مسكن الماوس على رأس وسادة التدفئة.
- مقطع مساحة كبيرة من الفراء حول خط الوسط الظهرية من الماوس الإناث.
- تطهير الجلد المكشوفة مع المناديل بالتناوب من مطهر موضعي مثل الكلورهيكسيدين و 70٪ من الإيثانول.
- فضح الجهاز التناسلي التالية الطريقة التقليدية 15 . جعل 1 سم شق الجلد طويلة موازية لخط الوسط الظهرية، وقطع العضلات والاستيلاء على لوحة الدهون وايث ملقط، ثم سحب بلطف المبيض خارج حتى قناة البيض المرفقة والرحم واضحة للعيان.
- إصلاح لوحة الدهون مع المشبك السفينة. تصور قناة البيض تحت المجهر مجسمة واستخدام زوج من مقص الصغير جعل شق في جدار قناة البيض بضعة مليمتر المنبع من أمبولة.
- تحت المجهر مجسمة، تحميل 25 ميكروينجكتد البيض في الزجاج الشعرية متصلة قطعة الفم (القطر الداخلي للشعيرات الدموية يجب أن يكون حوالي 120 ميكرون واسعة). إدخال الزجاجية الشعرية في قناة البيض وطرد حتى فقاعة الهواء مرئية داخل أمبولة.
- إزالة بلطف الشعرية الزجاجية ووضع الجهاز التناسلي مرة أخرى في البطن. خياطة شق مع 3-0 غير قابلة للامتصاص الجراحية الجراحية، ثم إغلاق مع مقاطع الجرح. مراقبة الماوس عن كثب حتى الانتعاش الكامل.
9. استراتيجيات التنميط الجيني / التسلسل
ملاحظة: عزل الجينوميةالحمض النووي من خزعات ذيل 2mm أو الأذن، وفقا لقواعد الأخلاق الحيوانية ذات الصلة.
- سريع استخراج الحمض النووي الجيني (التكامل العشوائي).
- ليس عينات الأنسجة (~ 2 مم) في 95 درجة مئوية لمدة 1 ساعة في 100 ميكرولتر من كاشف تحلل القلوية (25 ملي هيدروكسيد الصوديوم و 0.2 ملي إدتا، ودرجة الحموضة = 12).
- إضافة 100 ميكرولتر من كاشف تحييد (40 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة = 5).
- أجهزة الطرد المركزي لمدة 5 دقائق في 12،000 ز و 4 درجات مئوية.
- عالية الجودة استخراج الحمض النووي الجيني (استهداف الجينات).
- إضافة 500 ميكرولتر من العازلة الذيل (50 ملي تريس، ودرجة الحموضة = 8؛ 100 ملي إدتا، ودرجة الحموضة = 8، 100 ملي كلوريد الصوديوم، 1٪ سدز، و 0.5 ملغ / مل بروتين K، الطازجة).
- احتضان بين عشية وضحاها في 55 درجة مئوية.
- مزيج لمدة 5 دقائق عن طريق عكس (لا دوامة).
- إضافة 250 ميكرولتر من كلوريد الصوديوم المشبعة (6 M) وتخلط لمدة 5 دقائق عن طريق عكس (لا الدوامة).
- تدور لمدة 5-10 دقيقة في 12000 x ج و 4 درجة مئوية وتصب طاف في أنبوب جديد.
- إضافة 500 ميكرولتر من الأيزوبروبانول وتخلط لمدة 5 دقائق عن طريق عكس (لا دوامة).
- تدور لمدة 10 دقيقة في 12000 زغ ودرجة حرارة الغرفة.
- صب طاف (بيليه غير مرئية والعصي على أنبوب).
- يغسل مع 1 مل من الايثانول 70٪.
- تدور لمدة 5-10 دقيقة في 12000 زغ ودرجة حرارة الغرفة. إزالة طاف مع الرعاية، كما بيليه بيضاء ليست لزجة بعد الآن ويمكن أن تضيع.
- الهواء الجاف هذا ~ 1 ساعة.
- إضافة 400 ميكرولتر من العازلة تي (10 ملي تريس و 1 ملي إدتا، ودرجة الحموضة = 8).
- حل الحمض النووي في 55-60 درجة مئوية لمدة 2 ساعة.
- تصميم التمهيدي.
- تصميم الاشعال لا يقل عن 20 نقطة أساس طويلة باستخدام أداة حسابية 19 .
ملاحظة: من أجل التكامل العشوائي، يجب أن التهجين تهجين مع التحوير، وتوليد جزء متميز من 200-800 نقطة أساس. لاستهداف الجينات، تصميم الاشعال بحيث تهجين مع الحمض النووي الجيني، وتوليد و واضحرجمنت بضع مئات من نقاط القوة حول مواقع قطع. بالنسبة للإدخالات الكبيرة، يمكن للبوادر أن تجلس على التحوير، ولكن يجب أن يتم تأكيد التكامل المستهدف بعد ذلك باستخدام التمهيدي المشي أو تقنية مماثلة.
- تصميم الاشعال لا يقل عن 20 نقطة أساس طويلة باستخدام أداة حسابية 19 .
- ير التنميط الجيني.
- لكل تعديل الجينومية، تصميم بروتوكول ير الجديد واختباره تجريبيا. النظر في طول جزء ولدت ودرجة حرارة انصهار (تم) من كل زوج من الاشعال.
- التسلسل.
- لاستهداف الجينات، وإرسال المنتجات ير إلى سانجر مزود خدمة التسلسل.
Access restricted. Please log in or start a trial to view this content.
النتائج
أدناه، يتم وصف سير العمل ل ميكروينجكتيون في حالة التكامل العشوائي و كريسبر بوساطة استهداف الجينات ( الشكل 1 ).
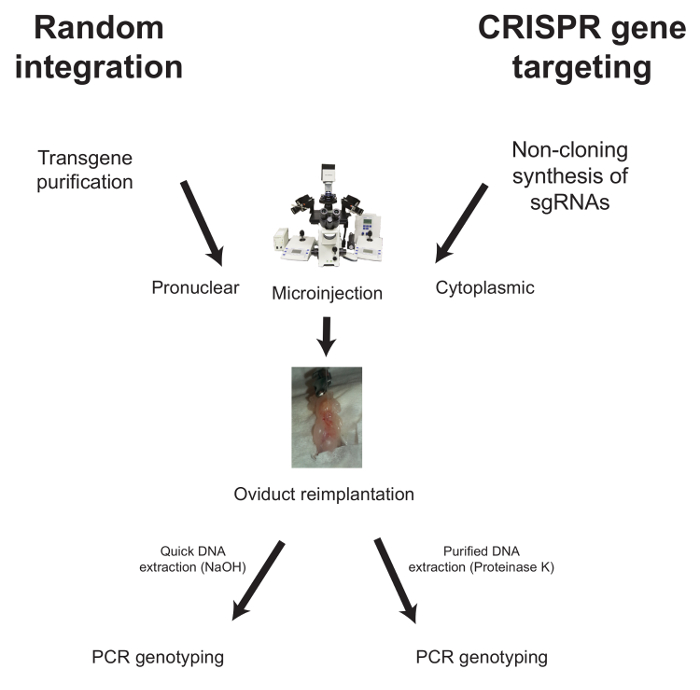
الشكل 1: سير ا?...
Access restricted. Please log in or start a trial to view this content.
Discussion
خطوات حاسمة داخل البروتوكول
ومن المعروف أن توليد الفئران المعدلة وراثيا أن يكون تحديا من الناحية الفنية. ومع ذلك، فإن بروتوكول المقدمة هنا هو الأسلوب الأمثل والمبسط الذي يسمح لإتقان واستكشاف هذه التقنية في وقت قياسي. هناك خطوتان ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يوفر المؤلفون خدمات ترانزجينيسيس الأكاديمية في الفئران عبر جامعة نيو ساوث ويلز مركز مارك وينوريت التحليلية.
Acknowledgements
ويشكر المؤلفون موظفي مرفق الحيوانات (برك) على دعمهم المستمر. وقد تم تمويل هذا العمل من قبل المجلس الوطني للصحة والبحوث الطبية ومجلس البحوث الأسترالي.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 μL | Eppendorf | 4920000016 | |
| Micropipette 2 - 20 μL | Eppendorf | 4920000040 | |
| Micropipette 20 - 200 μL | Eppendorf | 4920000067 | |
| Micropipette 100 - 1,000 μL | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1 kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
References
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. The Monk in the Garden. , Mariner books. (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- CRISPR DESIGN. , Available from: http://crispr.mit.edu (2017).
- Integrated DNA Technologies. Resuspension Calculator. , Available from: https://sg.idtdna.com/calc/resuspension/ (2017).
- BioTools at UMass Medical School. Primer3: WWW primer tool. , Available from: http://biotools.umassmed.edu/bioapps/primer3_www.cgi (2017).
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49(2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88(2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431(2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479(2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved