Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Oositlerin Mikroenjeksiyonu ile Genetiği Değiştirilmiş Farelerin Üretilmesi
Bu Makalede
Özet
Fare oositlerinin mikroenjeksiyonu hem klasik transgenezis ( yani, transgenlerin rastgele bütünleşmesi) hem de CRISPR aracılı gen hedeflemesi için yaygın olarak kullanılır. Bu protokol, kalite kontrolü ve genotiplendirme stratejileri üzerinde özel bir vurguyla mikroenjeksiyondaki en son gelişmeleri gözden geçiriyor.
Özet
Genetik olarak modifiye edilmiş farelerin kullanımı hem fizyolojik hem de patolojik in vivo süreçler üzerinde çalışmalara önemli ölçüde katkıda bulunmuştur. DNA ekspresyon yapılarının fare devirde döllenen oositlere enjekte edilmesi, aşırı ekspresyon için transgenik fareler üretmek için en sık kullanılan teknik olarak kalır. Gen hedeflemesi için CRISPR teknolojisinin kullanıma girmesiyle, döllenmiş oositlere pronükleer enjeksiyon, hem nakavt hem de knockin farelerinin nesline kadar genişletildi. Bu çalışma, enjeksiyon için DNA'nın hazırlanmasını ve gen kontrolü için özel bir vurguyla gen hedeflemesi için CRISPR kılavuzlarının oluşturulmasını açıklamaktadır. Potansiyel kurucuların tespiti için gerekli genotiplendirme prosedürleri kritik öneme sahiptir. CRISPR'nin "çoğullama" yeteneklerinden yararlanan yenilikçi genotipleme stratejileri burada sunulmuştur. Cerrahi işlemler de özetlenmektedir. Birlikte, protokolün aşamaları genin üretilmesini sağlayacaktırImmünoloji, nörobilim, kanser, fizyoloji, gelişim ve diğerleri dahil olmak üzere bir çok araştırma alanı için fare kolonilerinin kurulması için kullanılmıştır.
Giriş
Omurgalılarda ve omurgasız hayvanlarda hayvan modelleri, Alzheimer hastalığı 1 , 2 gibi insan koşullarının patofizyolojisini incelemek için bir araç olmuştur. Ayrıca, hastalık düzenleyicileri aramak ve sonuçta tedaviyi umut ederek yeni tedavi stratejileri geliştirmek için paha biçilemez araçlar. Her model özünde sınırlamalara sahip olsa da, hayvanların tüm sistemik modeller olarak kullanılması, biyomedikal araştırmalar için hayati öneme sahiptir. Bunun nedeni, metabolik ve kompleks fizyolojik ortamın doku kültüründe tamamen simüle edilememesi.
Bugüne kadar, fare birçok avantaja sahip olduğu için genetik manipülasyon için kullanılan en yaygın memeli türüdür. Hastalıklarla ilişkili fizyolojik süreçler ve genler, fareler ve insanlar arasında oldukça korunmaktadır. Fare, insan genosundan bir yıl önce, tam genom dizilimine sahip ilk memeliydi (2002)Ben (2003). Bu genetik bilginin yanı sıra, fare iyi yetiştirme kapasitelerine, hızlı gelişme döngüsüne (fertilizasyondan sütten kesilmeye kadar 6 hafta) ve makul bir boyuta sahiptir. Bütün bu avantajlar, farklı kat renkleri (geçiş stratejileri için gerekli) gibi fizyolojik göstergelerle birleştiğinde fare, genetik manipülasyon için çekici bir model yaptı. Özellikle, modern genetikte çok erken yaşlarda, Gregor Mendel, bitkilere gitmeden önce farelerde çalışmaya başladı 3 .
Gen transferi teknikleri başlangıçta viral doğum kullanılarak yaratılan, ilk otuz yıl önce ilk transjenik fare oluşumuyla sonuçlandı. Bununla birlikte, araştırmacılar kısa sürede, fare transgenezinin ana zorluklarından birinin, eksojen DNA'nın kaderini kontrol edemediğini fark etti. Transgenlerin fare oositlerine viral olarak verilmesi, birden fazla kopyanın genom içine rasgele entegre edilmesine neden olduğundan, olasılıklarDaha sonraki transgenik hatların kurulması sınırlıydı.
Böyle bir kısıtlamaya Gordon ve ark. Ilk transjenik fare hattını mikroenjeksiyon 5 , 6 ile üretti. Bu, rekombinant DNA teknolojisi çağına başladı ve bir mikroenjeksiyon oturumunun sonucunu etkileyen parametreler çokça incelendi. Mikroenjeksiyon, transgenin entegrasyon bölgesinin (sonuçta her bir kurucu fare için spesifik ekspresyon seviyeleri ile sonuçlanır) kontrol edilmesini sağlamasa da, pronükleer mikroenjeksiyonun ana avantajı, konkatemlerin oluşumunda kalmaktadır ( yani, transgenin çoklu kopyalarının dizileri, Seri bağlı) genomik integrasyon öncesi 5 . Bu özellik, ilgilenilen bir geni aşırı ifade eden binlerce transgenik fare hattı kurmak için yıllarca kullanılmıştır. O zamandan beri, transgenesis, birBir organizmanın genomunun doğal tadilatı, hastalıkların ortaya çıkmasında tekli genlerin rolünü tanımlamak için yaygın bir şekilde kullanılmıştır.
Fare genomunun manipüle edilmesinde bir diğer önemli başarı, Mario Capecchi'nin, fare üzerindeki tek bir geni başarıyla bozmasıyla, hedeflenen 8 gen hedefinin açılışında ulaşıldı. Bununla birlikte, büyük dezavantajlar, ES hücrelerinin kültürlenmesindeki zorluklar, biraz değişen kimeriklik derecesi ve sürecin uzunluğu (fare elde etmek için en az 12-18 ay, asgari olarak) dahil olmak üzere ES hücre temelli gen hedeflemesinden hızla çıkmıştır. .
Son zamanlarda, mühendislik endonükleazları ( örneğin, çinko parmak nükleazları (ZFN), transkripsiyon aktivatörü benzeri efektör nükleazları (TALEN) ve düzenli olarak aralıklı kısa palindromik tekrarlar (CRISPR / Cas9) gibi yeni teknolojilerdeki ilerlemeler) alternatif yöntemler olarak ortaya çıkmıştır Mikrofonda gen hedefleme sürecini hızlandırmakE 9 , 10 . Bu endonükleazlar, 6 hafta gibi kısa bir sürede gen hedefli farelerin üretilmesine olanak tanıyan, mikroenjeksiyon yoluyla fare oositlerine kolayca enjekte edilebilir.
Genom düzenleme 11 için CRISPR kullanımıyla ilgili ilk rapordan bu yana, bu bakteriyel adaptif bağışıklık sistemi, sentez kolaylığı ve bir defada birden fazla lokus hedefleme yeteneği de dahil olmak üzere birçok avantajı nedeniyle ZFN ve TALEN'in yerini almıştır ("çoğullama" "). CRISPR ilk farelerde 12 gen hedeflemesi için kullanılmıştır ve o zamandan beri bitkilerden insanlara 13 , 14'e kadar sayısız türün uygulanmıştır. Bugüne kadar, CRISPR genomu düzenine dirençli tek bir türe ilişkin rapor bulunmamaktadır.
Transjenik farelerin üretiminin iki temel sınırlayıcı aşaması oositlerin enjeksiyonu ve reimplantasyonBu oositlerden psödo-gebe kadınlara dönüşür. Bu teknik bizim 15 ve diğerleri16 tarafından tarif edilmesine rağmen, fare embriyolojisinde ve gen transfer tekniklerinde son zamanlardaki teknik gelişmeler, genetiği değiştirilmiş fareler üretme sürecinde devrim yaratmıştır. Bu iyileştirmeler burada açıklanacaktır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm prosedürler Yeni Güney Galler Hayvan Bakımı ve Etik Kurulu tarafından onaylanmıştır.
1. Transgenin Hazırlanması (Rasgele Entegrasyon)
- Analitik agaroz jel elektroforezi.
- Üreticinin tavsiyelerini izleyerek uygun bir enzim (1 saat inkübasyon) veya hızlı sindirim enzimleri (15 ila 30 dakika inkübasyon) kullanarak transgeni tüketmek için plazmidi özümleyin (bkz. Şekil 2A ve efsanesi).
- 0.5-1.0 ug / mL etidyum bromid (EtBr) ile boyanan% 1 tris-asetat-etilendiamintetraasetik asit (EDTA) (TEA) agaroz jeli dökün.
NOT: EtBr kullanırken dikkatli olun; Bu güçlü bir mutajendir. Lütfen uygun kişisel koruyucu ekipman kullanın (madde güvenlik bilgi formuna bakın). - 1 kb'lik bir molekül ağırlığı işaretleyicisi yükleyin.
- Doğrusallaştırılmış parçaları yükleyin ( yani, transgen ve omurga).
- Elektroforezi 100 V'de 45 dakika boyunca çalıştırın.
- Jelin, sindirimin tamamlandığını kontrol etmek ve transgenin doğru boyutunu teyit etmek için ultraviyole (UV) transilüminatör üzerinde görselleştirin ( ör . 7,338 bp; bkz. Şekil 2A ).
- Hazırlayıcı agaroz jel elektroforezi.
- Düşük toksisite jel lekesi ile boyanan% 1 TAE agaroz jeli dökün. Bir molekül ağırlığı markörü olmaksızın 8 alikuot (her biri 1 μg) doğrusallaştırılmış transgeni yükleyin ve elektroforezi 100 V'de 45 dakika boyunca çalıştırın. Doğrusallaştırılmış transgene karşılık gelen 8 bandın tümünü çıkarmak için neşter kullanın.
- Üreticinin tavsiyelerine uyarak DNA'yı bir jel özütleme kiti kullanarak çıkarın ( Malzeme Tablosuna bakın ).
- Jel parçalarını en az 15 dakika boyunca 1.5 mL'lik tüplerde 50 ° C'de eritin. Bunu izopropanol ile çöktürünüz ve daha sonra bağlama tamponunu ekleyin.
- Tüm D'yi birleştirNA hepsini tek bir sütuna pipetle atarak. Nükleaz içermeyen mikroenjeksiyon tamponuna (8 mM Tris-HC1 ve 0.15 mM EDTA) elute edin. 0.22 μm'lik mikrosantrifüj filtresinden geçirin ve 12.000 x g'de 60 saniye santrifüjleyin.
- Bir spektrofotometre kullanarak DNA konsantrasyonunu ve kalitesini ölçün. A260 / A280 oranının 1.8 civarında olduğunu ( yani, proteinlerin bulaşması olmadığını) ve A260 / A230 oranının en az 2.0 olduğunu kontrol edin ( yani, organik çözücüler tarafından bulaşma olmamalıdır). Nükleaz içermeyen mikroenjeksiyon tamponu, 3 ng / μL'ye kadar seyreltin (20-50 μL) ve -20 ° C'de dondurun.
2. CRISPR Bileşenlerinin Sentezi (Gen Hedefleme)
- Cas9 mRNA'sı.
- Nazlâksız mikroenjeksiyon tamponunda 1 μg / μL'lik bir konsantrasyona kadar Cas9 mRNA'yı seyreltin (ticari bir kaynaktan elde edin , Malzeme Tablosuna bakın ).
- 2 uL'lik kısım ve serbest -80 ° C'de ze.
- Tek kılavuz RNA (SgRNA).
- İstenilen iki hedefli genomik sekansları (kılavuzları) minimum potansiyel hedef dışı etkinliğe izin veren bir hesaplama tasarım aracı kullanarak belirleyin 17 .
- Gen nakavt için, sistematik olarak zıt yönlerde birkaç yüz baz çiftli (bp) bulunan iki kılavuz seçin ve ilgilenilen genin başlangıç kodonu dahil edilir. Homoloji doğrudan onarımı için, birbirine zıt yönlerde birbirine örtüşen iki kılavuz (mümkün olduğunda) seçin.
NOT: Bir örnek olarak, TPM4.2 geninin ilk ekzonunu bozmak için şu kılavuzlar yakın bir tarihte başarılı bir şekilde enjekte edilmiştir :
Kılavuz 1: 5 'CGCCATCCAGTTCGCGCTGC 3';
Kılavuz 2: 5 'CAGAACGATTGAGCTATGGC 3'
- Gen nakavt için, sistematik olarak zıt yönlerde birkaç yüz baz çiftli (bp) bulunan iki kılavuz seçin ve ilgilenilen genin başlangıç kodonu dahil edilir. Homoloji doğrudan onarımı için, birbirine zıt yönlerde birbirine örtüşen iki kılavuz (mümkün olduğunda) seçin.
- Tablo 1'de açıklandığı gibi bir dizi primer sipariş edin.
- Doğrusal bir DNA şablonunu sentezleyin.
- Seyreltik px330Ref "> 12 plazmitten 10 ng / μL'ye kadar nükleaz içermeyen suda yıkanır.
- Ana karışımın Tablo 1'de belirtildiği şekilde hazırlanması. Polimerazı sonunda ekleyin ve ana karışığı buzda tutun.
- Karıştırın ve 8 PCR tüpüne bölün (19 uL / tüp). Tüp başına 1 μL px330 ekleyin ve PCR'yi aşağıdaki koşullar altında çalıştırın: 98 ° C'de 1 dakika; 10 saniye için 98 ° C, 30 saniye için 64 ° C ve 15 saniye boyunca 72 ° C'lik 40 döngü; Ve son uzatma 72 ° C'de 5 dakika. 4 ° C'de tutun.
- Bir PCR saflaştırma kiti ( Malzeme Tablosuna bakın ), bir manifold ve bir vakum kaynağı (daha hızlı işlem için) kullanarak PCR ürünlerini saflaştırın. Maksimum vakum gücünü uygulayın ( yani, 8 mbar).
- PCR örneğinin 1 hacmine 5 hacim (100 μL) bağlama tamponu ilave edin ve karıştırın.
- Santrifüjleme için (sağlanan) 2 mL'lik bir toplama tüpüne (sağlanan) silika membran spin sütunu yerleştirin veya vakum işlemi için manifolddaing. DNA'yı bağlamak için, 8 numuneyi sırasıyla sütuna ve vakumda veya santrifüjde, her yük için 12,000 xg'de 60 saniye süreyle uygulayın.
- Yıkamak için, sütuna 0.75 mL yıkama tamponu (tampon PE) ilave edin ve 12,000 x g'de 60 s vakum veya santrifüj uygulayın. Kalıntı etanolü gidermek için sütunu 12,000 xg'de 60 saniye boyunca santrifüjleyin.
- Sütunu temiz bir 1.5 mL'lik mikrosantrifüj tüpüne yerleştirin. DNA'yı çözmek için membranın merkezine 30 uL nükleaz içermeyen su ekleyin, sütun 1 dakika bekletin ve 12.000 g'da 60 saniye boyunca santrifüjleyin.
- Bir spektrofotometre kullanarak konsantrasyonu ölçün; Tipik olarak konsantrasyon 100 ng / μL veya daha yüksek olmalıdır. A260 / A280 oranının 1.8 civarında olduğunu ( yani, proteinlerin bulaşması olmadığını) ve A260 / A230 oranının en az 2.0 olduğunu kontrol edin ( yani, organik çözücüler tarafından bulaşma olmamalıdır).
- T7 RNA sentez kiti kullanılarak in vitro transkripsiyon.
- HazırlaTablo l' de gösterildiği gibi ana karıştırın ve 3 saat süreyle 37 ° C'de bir termosiklör içinde inkübe edin. 28 μL nükleaz içermeyen su ve 2 μL DNase I ekleyin ve 37 ° C sıcaklıkta başka bir 15 dakika süreyle inkübe edin.
- Spin kolonlarını kullanarak RNA saflaştırması.
- Verilen spin sütununda bulunan tozu, tüm hava kabarcıklarını dikkatle kaldırarak 650 μL nükleaz içermeyen mikroenjeksiyon tampon çözündürün. Tüpü kapatıp oda sıcaklığında 5 - 15 dakika hidratlayın.
- Tabandaki mavi kapağı çıkarıp sütunu 2 mL tüp içine yerleştirin. 750 xg'de ve oda sıcaklığında 2 dakika boyunca santrifüjleyin. Sütunu taze bir 1.5 mL tüp içine yerleştirin ve sütun duvarına dokunmadan ortasına damla damla 50 μL RNA solüsyonu uygulayın. Sütunu 750 x g'de 2 dakika döndürün.
- Bir spektrofotometre kullanarak RNA konsantrasyonunu ölçün (bir reaksiyonun tipik verimi 30 - 50 ug'dir). A260 / A280 oranının bir2.0 yuvarlak ( yani, proteinler tarafından kontaminasyon yok) ve A260 / A230 oranı en az 2.0'dır ( yani, organik çözücüler tarafından bulaşma olmamalıdır). Kullanana kadar sgRNA'ları -80 ° C'de saklayın.
- DNA elektroforezinde rutin olarak kullanılan% 1 TAE jellerini kullanarak RNA'nın kalitesini değerlendirin. 200-400 ng DNA şablonunu ve karşılık gelen sgRNA'yı paralel olarak çalıştırın. RNA bandı (≈ 100 bp) DNA bandından biraz daha büyük olmalıdır (bkz. Şekil 3A ).
- İstenilen iki hedefli genomik sekansları (kılavuzları) minimum potansiyel hedef dışı etkinliğe izin veren bir hesaplama tasarım aracı kullanarak belirleyin 17 .
3. Donör Şablon
- Nokta mutasyonları veya 50 bp'ye kadar küçük dizilerin entegrasyonu için ticari olarak sentezlenmiş tek sarmallı oligonükleotidleri (s0-0ligos, Malzeme Tablosuna bakın ) sipariş edin; Homoloji kolları tipik olarak 60-90 bp uzunluğundadır.
- Daha büyük eklemeler için bir kalıp olarak bir donor plasmid kullanın. Klasik klonlama metodu veya bir yeni molekülün de novo sentezi kullanılarak uygun bir plazmid üretilir.Ticari kaynak.
NOT: Her bir homoloji kolu için en az 800 bp önerilir. Omurganın boyutu, homoloji doğrudan onarımının (HDR) etkinliği üzerinde hiçbir etkiye sahip değildir.
4. Enjeksiyon Karışımı
- Gen nakavt denemeleri için nükleazsız mikroenjeksiyon tamponu kullanarak Cas9 mRNA'sını 50 ng / μL'ye ve sgRNA'ları 12.5 ng / μL'ye (toplam 25 ng / μL) seyreltin. Homoloji doğrudan onarımına dayanan genom düzenleme deneyleri için 200 ng / μL'lik bir konsantrasyonda donör şablonunu (ssOligo veya plazmid) ekleyin.
NOT: Seyreltme hacimleri, yeniden süspansiyon hesaplayıcı 18 gibi çevrimiçi araçlarla kolaylıkla belirlenebilir. - Mikroenjeksiyon oturumu esnasında her bir alikotu buz üzerinde tutun ve daha sonra atın (enjeksiyon karışımını tekrar dondurmayın).
5. Scrotal Vazektomi
NOT: Farelerde iki tip vazektomi sıklıkla uygulanır: abdominal ve skrotal. İkincisiDaha az invazivdir ve daha önce tarif edilmiştir15.
- Tüm paslanmaz çelik cerrahi aletleri otoklavlayın.
- Bir tartım ölçeği kullanarak fare ağırlığını belirleyin ve enjekte edilebilir anestetikler (ketamine 100 mg / kg, xylazine 10 mg / kg) ile intraperitoneal (ip) enjeksiyon ile erkekleri anestezi edin.
- Parmak çimdik refleksinin kaybolduğunu takip edin ve fare sıkıştığında bir ısıtma yastığının üzerine yerleştirin.
- Testis çevresindeki cildi, klorheksidin ve% 70 etanol gibi topikal bir antiseptik mendille yıkayarak dezenfekte edin.
- Testisleri skrotal keseye itin ve bir neşter ile cilt kesiği yapın.
- Testiste, cauda epididimisinde ve vas deferens'i görselleştirin.
- Vas deferens'leri forsepsle tutun, tutun ve vas deferens'in 3 mm'lik kısmını çıkarmak için forsepsin her iki yanına da tarayın.
- Aynı işlemi ikinci testis üzerinde yapın.
- Cilt insizyonlarını yara klipsleriyle kapatın veTam iyileşene kadar fareyi yakından izleyin.
6. Süperovulasyon (Oosit Bağışçıları) ve Eş zamanlı (Psödo-gebe Dişiler)
NOT: Reimplantasyon için döllenmiş oositlerin ve fişek tutturulmuş dişilerin uygun sayıda üretilmesi için teknik başka bir yerde tanımlanmıştır 15 .
- 10 dişeyi, günde 1 I'de 12 I civarı civarında, 5 IU gebe kaltak muayene serum gonadotropini (PMSG; 100 μL'de) ile enjekte edin.
- Dişileri, 46-48 saat sonra 5 IU insan koryonik gonadotropin (hCG; 100 μL'de) ile enjekte edin (3. günde saat 11'de).
- Dişileri hemen tek evli erkeklerle bir gece çiftleştirin.
7. Pronükleer (rastgele bütünleşme) ve Sitoplazmik (Gen-hedefleme) Enjeksiyonlar
- Aşırı hareketli fareleri servikal çıkığıyla yok edin, karın bölgesini açın ve daha önce tarif edildiği gibi 15 yumurtalıklara ve yumurtalara erişin. O parçayı söyleKümülüs-oosit komplekslerini (KOK'ler) bir stereomikorskopta viducts ve hasat eder 15 . Onları geleneksel yöntem 15 izleyerek amino asitler (KSOMaa) ile takviye edilmiş bir damla potasyum simpleks optimizasyon ortamı içine yerleştirin.
- Bir aspiratör ağızlı parçası kullanarak KSOMaa ortamı damlasına yaklaşık olarak 1 μL hiyalüronidaz (10 mg / mL) ilave ederek oositleri saflaştırın ve 1 dakika 30 saniye boyunca 37 ° C /% 5 CO 2 kuluçka makinesinde çanağı yerleştirin.
- Oositleri aspiratör ağız parçası kullanarak 4 taze damla KSOMaa aracı ile yıkayın ve onları mineral yağı (yaklaşık 2 mL) ile kaplanmış son bir KSOMaa damlası damlasına aktarın. Oositlerin enjeksiyona hazır olana kadar çanağı 37 ° C /% 5 CO 2 inkübatörüne yerleştirin.
- Pronükleer enjeksiyon (rasgele entegrasyon).
- Yumurtaları stereoskopik mikroskop altında görselleştirin ve enjeksiyon odasına yaklaşık 50 yumurta aktarın (bir droP orta madeni yağ ile kaplanmış M2 ortamı) aspiratör ağız parçası kullanarak.
- Enjeksiyon odasını tersine çevrilmiş mikroskopta aktarın ve döllenmiş oositleri (iki görünür pronüklei) enjeksiyon karışımından birkaç pikolitre ile enjekte edin (bir pronukleus hedef alınabilir). Baş dönmesinin şişmesi gözlemlenerek başarılı bir enjeksiyonun görselleştirilmesi.
- Sitoplazmik enjeksiyon (gen hedeflemesi).
- Ağız parçası kullanılarak 5 μg / mL Cytochalasin B içeren bir damla KSOMaa yaklaşık 50 yumurta aktarın ve 37 ° C /% 5 CO 2 inkübatörde 5 dakika inkübe edin.
- Yumurtaları ağız parçasını kullanarak enjeksiyon odasına aktarın.
- Mümkün olduğunca otomatik enjektörün kompanzasyon basıncını kullanarak, çok düşük basınçta (50-100 hPa) enjeksiyon karışımının birkaç pikoliteri sitoplazmaya enjekte edin.
- Enjeksiyondan sonra, oositleri bir damla KSO'aMaa (ağız parçası kullanarak) ve psödo-gebe kadınların yumurta akışına yeniden implante edilene kadar onları 37 ° C /% 5 CO2 inkübatöründe tutun.
8. Reimplantasyon
- Tüm paslanmaz çelik cerrahi aletleri otoklavlayın.
- Tartı skalasını kullanarak fare ağırlığını belirleyin ve dişileri, enjekte edilebilir anestetikler (ketamine 100 mg / kg, xylazine 10 mg / kg) ile intraperitoneal (ip) enjeksiyon ile anestezi altına alın.
- Parmak çimdik refleksinin kaybolduğunu takip edin ve fare sıkıştığında bir ısıtma yastığının üzerine yerleştirin.
- Dişi farenin dorsal orta çizgisinin çevresinde kürkün büyük bir bölümünü klipsleyin.
- Maruz kalan deri, klorheksidin ve% 70 etanol gibi topikal bir antiseptik mendille yıkanarak dezenfekte edilir.
- Geleneksel yöntemle üreme kanalını açığa vurun 15 . Dorsal orta çizgiye paralel 1 cm uzunluğunda bir cilt insizyonu yapın, kası kesin ve yağ yastığını kapınForseps uygulayın, sonra ovaryumunu bağlı oviduct ve uterusa açıkça görene kadar hafifçe çekin.
- Yağ bandını bir damar kelepçesi ile sabitleyin. Stereoskopik mikroskopta yumurta akışını gözünüzde canlandırın ve bir çift mikro makas kullanarak ampülün birkaç milimetre akış yukarıdaki kanalına bir kesi yapın.
- Stereoskopik mikroskop altında, ağız parçasına bağlı cam kılcal içine 25 mikroenjeksiyon yumurta yükleyin (kılcal iç çap yaklaşık 120 μm geniş olmalıdır). Cam kılcal boruyu ovıdüktürün içine sokun ve ampülün içinde hava kabarcığı görünene kadar dışarı atın.
- Cam kılcal damağı hafifçe çıkarın ve üreme bölgesini karın içine geri koyun. Kesiyi 3-0 emilemez ameliyat dikişleri ile dikin, sonra yara klipsleriyle kapatın. Tam iyileşme sağlanıncaya kadar fareyi yakından izleyin.
9. Genotiplendirme Stratejileri / Sıralaması
NOT: Genomik izole etmekİlgili hayvan etiği yönetmeliklerine uyarak 2 mm kuyruk veya kulak biyopsilerinden DNA.
- Hızlı genomik DNA ekstraksiyonu (rasgele entegrasyon).
- Doku örneklerini (~ 2 mm), 100 uL alkalin lizis ayıracı (25 mM sodyum hidroksit ve 0.2 mM EDTA, pH = 12) içinde 95 ° C'de 1 saat süreyle lize edin.
- 100 μL nötrleştirici reaktif (40 mM Tris-HC1, pH = 5) ekleyin.
- 12,000 g ve 4 ° C'de 5 dakika boyunca santrifüjleyin.
- Yüksek kaliteli genomik DNA ekstraksiyonu (gen hedeflemesi).
- 500 μL kuyruk tamponu (50 mM Tris, pH = 8; 100 mM EDTA, pH = 8; 100 mM NaCl;% 1 SDS ve taze eklenmiş 0.5 mg / mL proteinaz K) ekleyin.
- Gecelik 55 ° C'de inkübe edin.
- 5 dakika karıştırılarak çevirin (vorteks yapmayın).
- 250 μL doymuş NaCl (6 M) ilave edin ve ters çevirerek (vorteks yapmayın) 5 dakika karıştırın.
- 5-10 dakika boyunca 12.000 xg ve 4 ° C'de döndürün ve süpernatanı yeni tüpe boşaltın.
- 500 uL izopropanol ekleyin ve ters çevirerek 5 dakika karıştırın (girdapsız).
- 12.000 xg'de ve oda sıcaklığında 10 dakika döndürün.
- Süpernatantı boşaltın (pellet görünmezdir ve boruya yapışır).
- 1 mL% 70 etanol ile yıkayın.
- 12.000 xg'de ve oda sıcaklığında 5-10 dakika döndürün. Yüzen pellet artık yapışkan olmadığından ve kaybolabildiğinden, süpernatanı dikkatlice çıkarın.
- Havayı 1 saat kadar kurutun.
- 400 uL TE tamponu (10 mM Tris ve 1 mM EDTA, pH = 8) ilave edin.
- DNA'yı 55-60 ° C'de 2 saat eritin.
- Astar tasarımı.
- Hesaplama aracı 19 kullanarak minimum 20 bp dizayn edin.
NOT: Rasgele entegrasyon için, primerler transgene hibridize edilmeli ve 200-800 bp'lik farklı bir fragman üretilmelidir. Gen hedeflemesi için, primerleri genomik DNA ile hibridize olacak şekilde tasarlayın, farklı bir fKesilen sitelerin etrafında birkaç yüz bp bölün. Büyük eklemeler için, primerler transgene oturabilir, ancak daha sonra primer yürüyüş veya benzeri bir teknik kullanılarak hedeflenen entegrasyonun doğrulanması yapılmalıdır.
- Hesaplama aracı 19 kullanarak minimum 20 bp dizayn edin.
- PCR genotiplendirme.
- Her bir genomik değişiklik için yeni bir PCR protokolü tasarlayın ve ampirik olarak test edin. Üretilen parçanın uzunluğunu ve her primer çiftinin erime sıcaklığını (Tm) göz önünde bulundurun.
- Sıralama.
- Gen hedeflemesi için, PCR ürünleri Sanger sıralama hizmeti sağlayıcısına gönderin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Aşağıda, rasgele entegrasyon ve CRISPR aracılı gen hedeflemesi durumunda mikroenjeksiyon için iş akışları açıklanmaktadır ( Şekil 1 ).
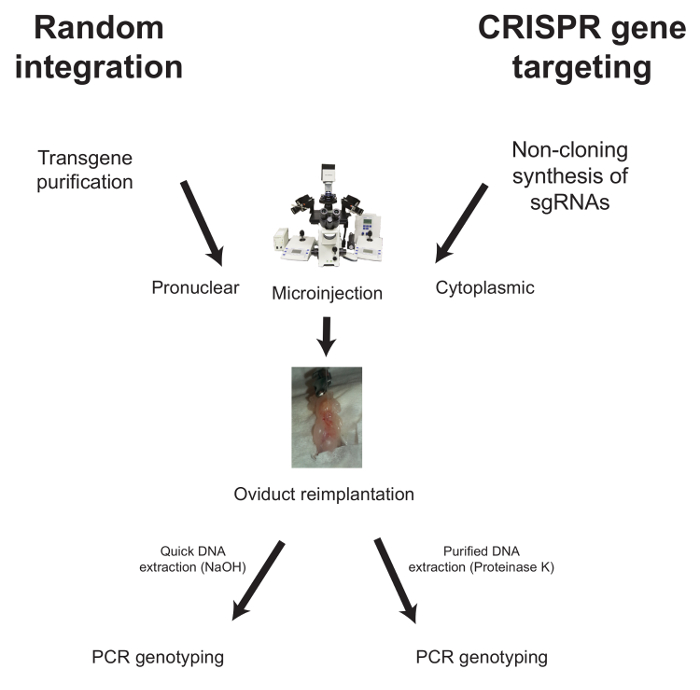
Şekil 1: Genetiği Değiştirilmiş Farelerin Üretimi için Tipik İş Akışı. Rastgele entegrasyon için, saflaştırılmış transgen, dö...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Protokol dahilinde kritik adımlar
Genetiği değiştirilmiş farelerin üretimi teknik açıdan zorlayıcı olarak bilinir. Bununla birlikte, burada sunulan protokol tekniğin rekor düzeyde hakim olmasına ve gidermesine olanak tanıyan optimize edilmiş ve basitleştirilmiş bir yöntemdir. Tekniğin başarılı bir şekilde tamamlanması için iki adım vardır. Birincisi, lineer DNA şablonlarının sentezi (sgRNA'ların sentezi için) magnezyum klorid (MgCl2) olmadan başarılabilir. ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, Yeni Güney Galler Üniversitesi Mark Wainwright Analitik Merkezi aracılığıyla farelerde akademik transgenesis hizmetleri sunmaktadır.
Teşekkürler
Yazarlar, devam eden destekleri için hayvan tesisi personeline (BRC) teşekkür ederler. Bu çalışma Ulusal Sağlık ve Tıbbi Araştırma Konseyi ve Avustralya Araştırma Konseyi tarafından finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 μL | Eppendorf | 4920000016 | |
| Micropipette 2 - 20 μL | Eppendorf | 4920000040 | |
| Micropipette 20 - 200 μL | Eppendorf | 4920000067 | |
| Micropipette 100 - 1,000 μL | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1 kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
Referanslar
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. The Monk in the Garden. , Mariner books. (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- CRISPR DESIGN. , Available from: http://crispr.mit.edu (2017).
- Integrated DNA Technologies. Resuspension Calculator. , Available from: https://sg.idtdna.com/calc/resuspension/ (2017).
- BioTools at UMass Medical School. Primer3: WWW primer tool. , Available from: http://biotools.umassmed.edu/bioapps/primer3_www.cgi (2017).
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49(2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88(2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431(2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479(2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır