Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация генетически модифицированных мышей посредством микроинъекции ооцитов
В этой статье
Резюме
Микроинъекция ооцитов мыши обычно используется как для классического трансгенеза ( т. Е. Для случайной интеграции трансгенов), так и для CRISPR-опосредованного гена. В этом протоколе рассматриваются последние разработки в области микроинъекции с особым акцентом на стратегии контроля качества и генотипирования.
Аннотация
Использование генетически модифицированных мышей значительно способствовало исследованиям как физиологических, так и патологических процессов in vivo . Пронуклеарная инъекция конструкций экспрессии ДНК в оплодотворенные ооциты остается наиболее часто используемым методом для генерации трансгенных мышей для сверхэкспрессии. С внедрением технологии CRISPR для нацеливания генов пронуклеарная инъекция в оплодотворенные ооциты была распространена на генерацию мышей с нокаутом и нокаутом. В этой работе описывается подготовка ДНК для инъекций и подготовка руководств CRISPR для ориентации генов с особым акцентом на контроль качества. Процедуры генотипирования, необходимые для идентификации потенциальных основателей, имеют решающее значение. Здесь представлены инновационные стратегии генотипирования, которые используют преимущества «мультиплексирования» CRISPR. Также описаны хирургические процедуры. Вместе этапы протокола позволят генерировать генерациюЭтически модифицированных мышей и для последующего создания колоний мыши для множества областей исследований, включая иммунологию, нейронауку, рак, физиологию, развитие и другие.
Введение
Модели животных, как у позвоночных, так и у беспозвоночных, сыграли важную роль в изучении патофизиологии состояний человека, таких как болезнь Альцгеймера 1 , 2 . Они также являются бесценными инструментами для поиска модификаторов болезни и в конечном итоге разрабатывают новые стратегии лечения в надежде на лечение. Хотя каждая модель имеет внутренние ограничения, использование животных как целых системных моделей жизненно важно для биомедицинских исследований. Это связано с тем, что метаболическая и сложная физиологическая среда не может быть полностью смоделирована в культуре тканей.
На сегодняшний день мышь остается наиболее распространенным видом млекопитающих, используемым для генетической манипуляции, поскольку она имеет несколько преимуществ. Физиологические процессы и гены, связанные с заболеваниями, очень сохраняются между мышами и людьми. Мышь была первым млекопитающим, имеющим полный геном, секвенированный (2002), за год до генома человекаМеня (2003). Помимо этого богатства генетической информации мышь обладает хорошей способностью к размножению, быстрым циклом развития (6 недель от оплодотворения до отлучения) и разумным размером. Все эти преимущества в сочетании с физиологическими показателями, такими как различные цвета пальто (необходимые для перекрестных стратегий), сделали мышь привлекательной моделью для генетических манипуляций. Примечательно, что в самом раннем возрасте современной генетики Грегор Мендель начал работать над мышами, прежде чем переходить на растения 3 .
Методы переноса гена привели к генерации первой трансгенной мыши в течение трех десятилетий назад 4 , первоначально созданной с использованием вирусной доставки. Однако вскоре исследователи поняли, что одной из основных проблем трансгенеза мыши является невозможность контролировать судьбу экзогенной ДНК. Поскольку вирусная доставка трансгенов в ооциты мыши приводила к множественным копиям, случайным образом интегрированным в геном, возможноY установления последующих трансгенных линий было ограничено.
Одно из таких ограничений было преодолено, когда Гордон и др. Генерировали первую трансгенную линию мыши путем микроинъекции 5 , 6 . Это начало эры технологии рекомбинантной ДНК, и параметры, влияющие на результат сеанса микроинъекции, были широко изучены 7 . Хотя микроинъекция не позволяет контролировать сайт интеграции трансгена (что в конечном итоге приводит к определенным уровням экспрессии для каждой мыши-основателя), основным преимуществом пронуклеарного микроинъекции остается образование конкатемеров ( т. Е. Массивов множественных копий трансгена, Связанные последовательно) до геномной интеграции 5 . Эта характеристика использовалась на протяжении многих лет, чтобы установить тысячи трансгенных линий мыши, которые сверхэкспрессируют ген, представляющий интерес. С тех пор трансгенезис, aRtificial модификация генома организма, широко используется для определения роли одиночных генов в возникновении заболеваний.
Еще одно ключевое достижение в манипуляции с геномом мыши было достигнуто, когда Марио Капечи успешно разрушил один ген мыши, открыв эру нацеливания гена 8 . Тем не менее, основные недостатки быстро возникали из нацеленного на ЭС клеточного гена, включая проблемы культивирования ES-клеток, несколько изменчивую степень химеризма и длину процесса ( т. Е. 12-18 месяцев, минимум, чтобы получить мышь) ,
Недавно появились новые технологии, такие как инженерные эндонуклеазы ( например, нуклеазы цинковых пальцев (ZFN), активатор-подобные эффекторные нуклеазы транскрипции (TALEN) и кластеризованные регулярно промежуточные короткие палиндромные повторы (CRISPR / Cas9)), как альтернативные методы Ускорить процесс нацеливания генов в микрофонE 9 , 10 . Эти эндонуклеазы могут быть легко введены в ооциты мыши путем микроинъекции, что позволяет генерировать ген-целевых мышей всего за 6 недель.
Начиная с первого отчета об использовании CRISPR для редактирования генома 11 , эта бактериальная адаптивная иммунная система заменила ZFN и TALEN из-за ее многочисленных преимуществ, в том числе легкости синтеза и способности сразу нацеливать несколько локусов (называемых «мультиплексированием» «). CRISPR был впервые использован для нацеливания генов у мышей 12 и с тех пор применяется к бесчисленным видам, от растений до людей 13 , 14 . На сегодняшний день нет отчета об одном виде, устойчивом к редактированию генома CRISPR.
Двумя основными предельными стадиями генерации трансгенных мышей являются инъекция ооцитов и реимплантацияИз этих ооцитов в псевдо-беременных женщин. Хотя эта методика была описана нами 15 и другими 16 , последние технические усовершенствования эмбриологии мыши и методов переноса генов коренным образом изменили процесс генерации генетически модифицированных мышей. Эти улучшения будут описаны здесь.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры были одобрены Комитетом по уходу за животными и этикой Университета Нового Южного Уэльса.
1. Получение трансгена (случайная интеграция)
- Аналитический агарозный гель-электрофорез.
- Дайджест плазмиды для извлечения трансгена с использованием соответствующих ферментов (инкубация 1 ч) или ферментов с быстрым перевариванием (инкубация с 15-30 мин) в термоциклере в соответствии с рекомендациями производителя (см . Рисунок 2А и его легенда).
- Вливают 1% агарозный гель трис-ацетат-этилендиаминтетрауксусной кислоты (ЭДТА) (ТЭА), окрашенный 0,5-1,0 мкг / мл этидиябромида (EtBr).
ПРИМЕЧАНИЕ. Соблюдайте осторожность при использовании EtBr; Это мощный мутаген. Используйте соответствующие средства индивидуальной защиты (см. Паспорт безопасности материала). - Загрузите маркер молекулярной массы 1 kb.
- Загрузите линеаризованные фрагменты ( т. Е. Трансген и позвоночник).
- Проведите электрофорез при 100 В в течение 45 мин.
- Визуализируйте гель на ультрафиолетовом (УФ) трансиллюминаторе, чтобы проверить, что пищеварение завершено, и чтобы подтвердить правильный размер трансгена ( т. Е. 7,338 б.п., см . Рисунок 2А ).
- Препаративный агарозный гель-электрофорез.
- Лить 1% -ного агарозного геля TAE, окрашенного пятном с низкой токсичностью геля. Загружайте 8 аликвот (по 1 мкг каждый) линеаризованного трансгена без маркера молекулярного веса и проводите электрофорез при 100 В в течение 45 мин. Используйте скальпель для резки всех 8 полос, соответствующих линеаризованному трансгену.
- Извлеките ДНК, используя комплект для экстракции геля, следуя рекомендациям производителя (см. Таблицу материалов ).
- Растопить гель-фрагменты при 50 ° С в 1,5-мл пробирках в течение не менее 15 мин. Осадить его изопропанолом и затем добавить буфер связывания.
- Объедините весь DNA, пипетируя все это в одну колонку. Элюат в буфер для микроинъекции без нуклеазы (8 мМ Трис-HCl и 0,15 мМ ЭДТА). Фильтруют через микроцентрифужный фильтр 0,22 мкм и центрифугируют в течение 60 с при 12000 х г.
- Измерьте концентрацию и качество ДНК с помощью спектрофотометра. Убедитесь , что соотношение A260 / A280 составляет около 1,8 ( т. Е. Никакого загрязнения белками), а соотношение A260 / A230 составляет не менее 2,0 ( т.е. отсутствие загрязнения органическими растворителями). Разбавьте до 3 нг / мкл в беснуклеазном микроинъекционном буфере, аликвоте (20-50 мкл) и замораживайте при -20 ° C.
2. Синтез компонентов CRISPR (нацеливание генов)
- Cas9 мРНК.
- Разбавьте мРНК Cas9 (полученную из коммерческого источника, см. Таблицу материалов ) до концентрации 1 мкг / мкл в беснуклеазном микроинъекционном буфере.
- Аликвоту в 2 мкл и свободный Ze при -80 ° C.
- Однонаправленная РНК (SgRNA).
- Определите желаемые геномные последовательности (направляющие) с двумя мишенями, используя вычислительный инструмент проектирования, позволяющий минимальную потенциальную неактивную активность 17 .
- Для нокаута гена систематически выбирают два направляющих, расположенных в несколько сотен пар оснований (bp) в противоположных направлениях и включают в себя начальный кодон представляющего интерес гена. Для прямого ремонта гомологии выберите две наложенные направляющие (по возможности) в противоположных направлениях.
ПРИМЕЧАНИЕ. В качестве примера, недавно были успешно совместно введены следующие руководства для разрушения первого экзона гена TPM4.2 :
Руководство 1: 5 «CGCCATCCAGTTCGCGCTGC 3»;
Руководство 2: 5 'CAGAACGATTGAGCTATGGC 3'
- Для нокаута гена систематически выбирают два направляющих, расположенных в несколько сотен пар оснований (bp) в противоположных направлениях и включают в себя начальный кодон представляющего интерес гена. Для прямого ремонта гомологии выберите две наложенные направляющие (по возможности) в противоположных направлениях.
- Закажите набор праймеров, как описано в таблице 1 .
- Синтезируйте линейный шаблон ДНК.
- Разбавьте px330Ref "> 12 плазмиды до 10 нг / мкл в воде, свободной от нуклеазы.
- Подготовьте мастер-микс, как показано в таблице 1 . Добавьте полимеразу в конце и держите смеситель на льду.
- Смешайте и разделите его на 8 ПЦР-пробирок (19 мкл / пробирка). Добавьте 1 мкл px330 на пробирку и запустите ПЦР в следующих условиях: 1 мин при 98 ° C; 40 циклов 98 ° С в течение 10 с, 64 ° С в течение 30 с и 72 ° С в течение 15 с; И конечное удлинение при 72 ° С в течение 5 мин. Держите при 4 ° C.
- Очистите продукты ПЦР с помощью набора для очистки ПЦР (см. Таблицу материалов ), коллектора и источника вакуума (для более быстрой обработки). Примените максимальную силу вакуума ( т. Е. 8 мбар).
- Добавьте 5 объемов (100 мкл) связывающего буфера в 1 объем образца ПЦР и смесь.
- Поместите (предоставленную) спин-колонку из кремнеземной мембраны в (поставляемую) 2-мл коллекционную трубку для центрифугирования или на коллекторе для вакуумного процессаING. Для связывания ДНК последовательно применяют все 8 образцов к колонке и вакуум или центрифугу в течение 60 с при 12000 мкг для каждой нагрузки.
- Для промывки добавляют 0,75 мл промывочного буфера (буфер PE) в колонку и вакуум или центрифугируют в течение 60 с при 12000 × g. Центрифугируйте колонку в течение 60 с при 12000 xg для удаления остаточного этанола.
- Поместите колонку в чистую микроцентрифужную пробирку объемом 1,5 мл. Чтобы элюировать ДНК, добавьте 30 мкл воды без нуклеазы в центр мембраны, дайте колонке на 1 минуту и центрифугируйте в течение 60 с при 12000 г.
- Измерьте концентрацию с помощью спектрофотометра; Обычно концентрация должна составлять 100 нг / мкл или выше. Убедитесь , что соотношение A260 / A280 составляет около 1,8 ( т. Е. Никакого загрязнения белками), а соотношение A260 / A230 составляет не менее 2,0 ( т.е. отсутствие загрязнения органическими растворителями).
- Транскрипция in vitro с использованием набора для синтеза РНК Т7.
- Подготовьте tОн, как указано в таблице 1 , инкубируют в течение 3 ч при 37 ° С в термоциклере. Добавить 28 мкл свободной от нуклеазы воды и 2 мкл ДНКазы I и инкубировать еще 15 мин при 37 ° С в термоциклере.
- Очистка РНК с использованием спиновых колонок.
- Растворите порошок, содержащийся в предоставленной спиновой колонке, в 650 мкл буфера для микроинъекции без нуклеазы, тщательно удалив все пузырьки воздуха. Закройте трубку и гидратируйте в течение 5-15 мин при комнатной температуре.
- Снимите синюю крышку снизу и поместите колонку в пробирку объемом 2 мл. Центрифуга в течение 2 мин при 750 xg и комнатной температуре. Поместите колонку в свежую пробирку объемом 1,5 мл и по каплям поместите 50 мкл раствора РНК в центр, не касаясь стенки колонны. Вращайте колонку в течение 2 мин при 750 х g.
- Измерьте концентрацию РНК с помощью спектрофотометра (типичный выход одной реакции составляет 30-50 мкг). Убедитесь, что коэффициент A260 / A280 равенКруглый 2.0 ( т.е. отсутствие загрязнения белками), а соотношение A260 / A230 составляет не менее 2,0 ( т.е. отсутствие загрязнения органическими растворителями). Храните sgRNAs при -80 ° C до использования.
- Оцените качество РНК с использованием 1% TAE гелей, обычно используемых для электрофореза ДНК. Проведите 200-400 нг ДНК-матрицы и соответствующей sgRNA параллельно. Полоса РНК (≈ 100 б.п.) должна быть немного больше, чем полоса ДНК (см . Рис. 3А ).
- Определите желаемые геномные последовательности (направляющие) с двумя мишенями, используя вычислительный инструмент проектирования, позволяющий минимальную потенциальную неактивную активность 17 .
3. Шаблон донора
- Заказать коммерчески синтезированные одноцепочечные олигонуклеотиды (ssOligos, см. Таблицу материалов ) для точечных мутаций или для интеграции небольших последовательностей до 50 bp; Гомологическое оружие обычно составляет 60-90 б.п.
- Для больших вставок используйте донорскую плазмиду в качестве шаблона. Генерируют подходящую плазмиду, используя либо классический метод клонирования, либо синтез de novo изКоммерческий источник.
ПРИМЕЧАНИЕ. Рекомендуется минимум 800 б.п. на руку для гомологии. Размер позвоночника не влияет на эффективность прямого ремонта гомологии (HDR).
4. Инжекционный микс
- Разбавьте мРНК Cas9 до 50 нг / мкл и sgRNAs до 12,5 нг / мкл (всего 25 нг / мкл) с использованием буфера для микроинъекции без нуклеазы для экспериментов с нокаутом генов. Добавьте донорскую матрицу (ssOligo или плазмиду) в концентрации 200 нг / мкл для экспериментов по редактированию генома, основанных на прямом восстановлении гомологии.
ПРИМЕЧАНИЕ. Объемы разбавления можно легко определить с помощью онлайн-инструментов, таких как калькулятор 18 ресуспендирования. - Держите каждую аликвоту на льду во время сеанса микроинъекции и отбросьте потом (не повторно замораживайте инъекционный микс).
5. Скротальная вазэктомия
ПРИМЕЧАНИЕ. Два типа вазэктомии обычно выполняются у мышей: брюшной полости и мошонки. ПоследнийМенее инвазивна и ранее была описана 15 .
- Автоклавируйте все хирургические инструменты из нержавеющей стали.
- Определите вес мыши с помощью весовой шкалы и обезболивайте самцов путем внутрибрюшинной инъекции инъекционных анестетиков (кетамин 100 мг / кг, ксилазин 10 мг / кг).
- Контролируйте потерю рефлекса пальца и после того, как мышь успокоилась, положите его поверх нагревательной подушки.
- Дезинфицируйте кожу вокруг яичек чередующимися салфетками местного антисептика, такого как хлоргексидин и 70% этанол.
- Вставьте семенники в мошонку и сделайте разрез кожи с помощью скальпеля.
- Визуализируйте яички, cauda epididymis и vas deferens.
- Возьмите семявыносящий проток с помощью щипцов, держите его и прижигайте с каждой стороны щипцов, чтобы удалить 3 мм семявыносящего протока.
- Выполните ту же процедуру на втором семеннике.
- Закройте разрезы кожи с помощью зажимов для раны иМышь близко до полного восстановления.
6. Суперовуляция (доноры ооцитов) и время-спаривание (Псевдо-беременные самки)
ПРИМЕЧАНИЕ. Методика получения подходящего количества оплодотворенных ооцитов и закупоренных приемных самок для реимплантации была описана в другом месте 15 .
- Внесите 10 самок ip с 5 МЕ сывороточного гонадотропина беременной кобылы (PMSG, в 100 мкл) примерно в 12 часов дня 1-го дня.
- Внесите самки ip с 5 МЕ хорионического гонадотропина человека (hCG, в 100 мкл) через 46-48 часов (примерно в 11 часов утра в день 3).
- Немедленно спасите самок с одиночными мужчинами в одночасье.
7. Проядерная (случайная интеграция) и цитоплазматическая (ген-нацеливающая) инъекция
- Вычистите суперовеллированных мышей шейным дислокацией, выставите живот и получите доступ к яичникам и яйцеводам, как описано ранее 15 . Рассеивать oViducts и собирать кумулюс-ооцит-комплексы (COC) под стереомикроскоп 15 . Поместите их в каплю среды для оптимизации симптом калия, дополненной аминокислотами (KSOMaa), следуя традиционному методу 15 .
- Очистите ооциты, добавив приблизительно 1 мкл гиалуронидазы (10 мг / мл) к капле среды KSOMaa, используя кусочек устья аспиратора, и поместите блюдо в инкубатор 37 ° C / 5% CO 2 в течение 30 с - 1 мин.
- Вымойте ооциты 4 свежими каплями среды KSOMaa, используя кусочек рта аспиратора, и перенесите их до конечной капли среды KSOMaa, покрытой минеральным маслом (около 2 мл). Поместите блюдо в инкубатор 37 ° C / 5% CO 2 до тех пор, пока ооциты не будут готовы к инъекции.
- Ядерная инъекция (случайная интеграция).
- Визуализируйте яйца под стереоскопическим микроскопом и перенесите приблизительно 50 яиц в камеру инъекции (a droP среды M2, наложенной на минеральное масло) с использованием части устья аспиратора.
- Перенесите инъекционную камеру в инвертированный микроскоп и добавьте оплодотворенные ооциты (две видимые пронуклеусы) несколькими пиколитрами инъекционной смеси, нацеливаясь на пронуклеус (любой из пронуклеусов может быть нацелен). Визуализируйте успешную инъекцию, наблюдая набухание пронуклеуса.
- Цитоплазматическая инъекция (нацеливание генов).
- Перенесите приблизительно 50 яиц в каплю KSOMaa, содержащей 5 мкг / мл цитохалазина В, с использованием части рта и инкубируйте в течение 5 мин в инкубаторе 37 ° C / 5% CO 2 .
- Перенесите яйца в камеру для инъекций с помощью рта.
- Внесите несколько пиколитров инъекционной смеси в цитоплазму при очень низком давлении (50-100 гПа), используя, по возможности, компенсационное давление автоматизированного микроинъектора.
- После инъекции переносите ооциты обратно в каплю KSOMaa (используя кусочек рта) и удерживайте их в инкубаторе 37 ° C / 5% CO 2 , пока он не будет загружен для реимплантации в яйцевод с псевдо-беременными самками.
8. Реимплантация
- Автоклавируйте все хирургические инструменты из нержавеющей стали.
- Определите вес мыши с помощью весовой шкалы и обезболивайте самки путем внутрибрюшинной инъекции (инъекции) инъекционными анестетиками (кетамин 100 мг / кг, ксилазин 10 мг / кг).
- Контролируйте потерю рефлекса пальца и после того, как мышь успокоилась, положите его поверх нагревательной подушки.
- Закрепите большую область меха вокруг спинной срединной линии женской мыши.
- Дезинфицируйте обнаженную кожу чередующимися салфетками местного антисептика, такого как хлоргексидин и 70% этанол.
- Выставить репродуктивный тракт по традиционному методу 15 . Сделайте разрез кожи длиной 1 см параллельно спинной срединной линии, отрежьте мышцу и возьмите жироуловитель wiПинцет, затем осторожно вытащите завязь, пока ее прикрепленный яйцевод и матка не будут хорошо видны.
- Закрепите жироуловитель с помощью хомута. Визуализируйте яйцевод в стереоскопическом микроскопе и используя пару микро-ножниц, сделайте надрез в стенке яйцевода на несколько миллиметров выше по течению от ампулы.
- Под стереоскопическим микроскопом загрузите 25 микроинъекционных яиц в стеклянный капилляр, соединенный с частью рта (внутренний диаметр капилляра должен быть около 120 мкм). Вставьте стеклянный капилляр в яйцевод и выпустите, пока в ампуле не появится воздушный пузырь.
- Осторожно удалите стеклянный капилляр и поместите репродуктивный тракт обратно в живот. Швы нарезать с помощью 3-0 неабсорбируемых хирургических швов, затем закрыть зажимы для раны. Контролируйте мышь близко до полного восстановления.
9. Стратегии генотипирования / секвенирование
ПРИМЕЧАНИЕ. Изолируйте геномнуюДНК из 2-мм хвостовых или ушных биопсий, следуя соответствующим правилам этики животных.
- Быстрая геномная экстракция ДНК (случайная интеграция).
- Lyse образцы тканей (~ 2 мм) при 95 ° C в течение 1 часа в 100 мкл щелочного лизисного реагента (25 мМ гидроксида натрия и 0,2 мМ ЭДТА, pH = 12).
- Добавить 100 мкл нейтрализующего реагента (40 мМ Трис-HCl, pH = 5).
- Центрифугируют в течение 5 мин при 12000 г и 4 ° С.
- Высококачественная экстракция геномной ДНК (нацеливание генов).
- Добавить 500 мкл хвостового буфера (50 мМ Трис, рН = 8, 100 мМ ЭДТА, pH = 8, 100 мМ NaCl, 1% SDS и 0,5 мг / мл протеиназы K, свежеприготовленный).
- Инкубируйте в течение ночи при 55 ° C.
- Смешать в течение 5 мин путем инвертирования (не вихря).
- Добавляют 250 мкл насыщенного NaCl (6 М) и перемешивают в течение 5 мин путем инвертирования (не вихря).
- Спин в течение 5-10 мин при 12000 xg и 4 ° C и выливают супернатант в новую пробирку.
- Добавьте 500 мкл изопропанола и перемешайте в течение 5 мин путем инвертирования (не вихрь).
- Спин в течение 10 мин при 12000 × г и комнатной температуре.
- Декантируют супернатант (таблетка невидима и прилипает к трубе).
- Промыть 1 мл 70% этанола.
- Спин в течение 5-10 мин при 12000 × г и комнатной температуре. Удалите супернатант с осторожностью, так как белая таблетка больше не липнет и может быть потеряна.
- Воздух высохнет в течение ~ 1 часа.
- Добавить 400 мкл ТЕ-буфера (10 мМ Трис и 1 мМ ЭДТА, рН = 8).
- Растворить ДНК при 55-60 ° С в течение 2 часов.
- Дизайн грунтовки.
- Проектные праймеры длиной не менее 20 б.п. с использованием вычислительного инструмента 19 .
ПРИМЕЧАНИЕ. Для случайной интеграции праймеры должны гибридизоваться с трансгеном, генерируя отдельный фрагмент 200-800 б.п. Для нацеливания генов разрабатывайте праймеры так, чтобы они гибридизировались с геномной ДНК,Разброс нескольких сотен б.п. вокруг участков разреза. Для больших вставок праймеры могут сидеть на трансгене, но впоследствии подтверждение целевого интегрирования должно выполняться с помощью праймерной ходьбы или аналогичной методики.
- Проектные праймеры длиной не менее 20 б.п. с использованием вычислительного инструмента 19 .
- ПЦР-генотипирование.
- Для каждой геномной модификации создайте новый протокол ПЦР и протестируйте его эмпирически. Рассмотрим длину сгенерированного фрагмента и температуру плавления (Tm) каждой пары праймеров.
- Последовательность действий.
- Для ориентации генов отправьте продукты ПЦР поставщику услуг секвенирования Sanger.
Access restricted. Please log in or start a trial to view this content.
Результаты
Ниже описаны рабочие процессы для микроинъекции в случае случайного интегрирования и нацеливания на CRISPR-ген ( Рисунок 1 ).
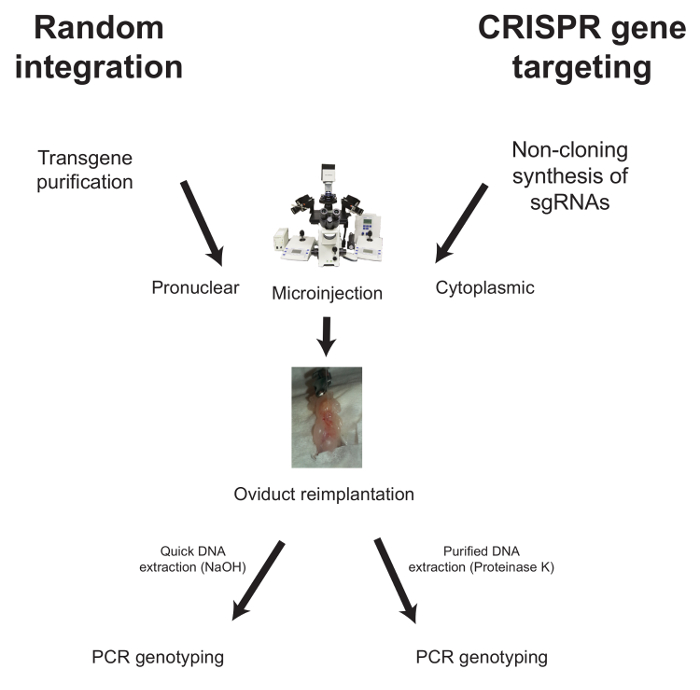
Рисунок 1: Типичный рабочий процесс для...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Критические шаги в протоколе
Известно, что генерация генетически модифицированных мышей технически сложна. Однако представленный здесь протокол представляет собой оптимизированный и упрощенный метод, позволяющий осваивать и устранять эту технику в рекордные сроки. Дл...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы предоставляют услуги академического трансгенеза у мышей через аналитический центр Университета Нового Южного Уэльса Марк Уэйнрайт.
Благодарности
Авторы выражают благодарность персоналу животного объекта (BRC) за их постоянную поддержку. Эта работа финансировалась Национальным советом по здравоохранению и медицинским исследованиям и Австралийским исследовательским советом.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 μL | Eppendorf | 4920000016 | |
| Micropipette 2 - 20 μL | Eppendorf | 4920000040 | |
| Micropipette 20 - 200 μL | Eppendorf | 4920000067 | |
| Micropipette 100 - 1,000 μL | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1 kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
Ссылки
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. The Monk in the Garden. , Mariner books. (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- CRISPR DESIGN. , Available from: http://crispr.mit.edu (2017).
- Integrated DNA Technologies. Resuspension Calculator. , Available from: https://sg.idtdna.com/calc/resuspension/ (2017).
- BioTools at UMass Medical School. Primer3: WWW primer tool. , Available from: http://biotools.umassmed.edu/bioapps/primer3_www.cgi (2017).
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49(2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88(2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431(2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479(2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены