Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de ratones modificados genéticamente a través de la microinyección de ovocitos
En este artículo
Resumen
La microinyección de ovocitos de ratón se utiliza comúnmente tanto para la transgénesis clásica ( es decir, la integración aleatoria de transgenes) como para la orientación de genes mediados por CRISPR. Este protocolo revisa los últimos avances en microinyección, con especial énfasis en el control de calidad y las estrategias de genotipificación.
Resumen
El uso de ratones modificados genéticamente ha contribuido significativamente a los estudios tanto en procesos fisiológicos y patológicos in vivo . La inyección pronuclear de construcciones de expresión de ADN en oocitos fertilizados sigue siendo la técnica más comúnmente utilizada para generar ratones transgénicos para sobreexpresión. Con la introducción de la tecnología CRISPR para la orientación génica, la inyección pronuclear en ovocitos fertilizados se ha extendido a la generación de ratones knock-out y knockin. Este trabajo describe la preparación de ADN para inyección y la generación de guías CRISPR para la orientación génica, con especial énfasis en el control de calidad. Los procedimientos de genotipado necesarios para la identificación de los posibles fundadores son críticos. Se presentan aquí estrategias innovadoras de genotipado que aprovechan las capacidades de "multiplexación" de CRISPR. También se describen procedimientos quirúrgicos. Juntos, los pasos del protocolo permitirán la generación de genY para el posterior establecimiento de colonias de ratón para una plétora de campos de investigación, incluyendo inmunología, neurociencia, cáncer, fisiología, desarrollo y otros.
Introducción
Modelos animales, tanto en vertebrados e invertebrados, han sido fundamentales para examinar la fisiopatología de condiciones humanas como la enfermedad de Alzheimer 1 , 2 . También son herramientas invaluables para buscar modificadores de la enfermedad y, en última instancia, desarrollar nuevas estrategias de tratamiento con la esperanza de una cura. Aunque cada modelo tiene limitaciones intrínsecas, el uso de animales como modelos sistémicos enteros es vital para la investigación biomédica. Esto se debe a que el entorno fisiológico metabólico y complejo no puede ser completamente simulado en el cultivo de tejidos.
Hasta la fecha, el ratón sigue siendo la especie de mamífero más común utilizada para la manipulación genética, ya que presenta varias ventajas. Los procesos fisiológicos y los genes asociados con enfermedades son altamente conservados entre ratones y humanos. El ratón fue el primer mamífero que tuvo su genoma completo secuenciado (2002), un año antes del genotipo humanoMe (2003). Aparte de esta riqueza de información genética, el ratón tiene buenas capacidades de cría, un ciclo de desarrollo rápido (6 semanas desde la fertilización hasta el destete) y un tamaño razonable. Todas estas ventajas, junto con los indicadores fisiológicos, como los distintos colores de la capa (necesarios para las estrategias de cruce), convirtieron al ratón en un modelo atractivo para la manipulación genética. En particular, en la temprana edad de la genética moderna, Gregor Mendel comenzó a trabajar en ratones antes de pasar a las plantas 3 .
Técnicas de transferencia de genes resultó en la generación del primer ratón transgénico hace más de tres décadas 4 , inicialmente creado mediante la administración viral. Sin embargo, los investigadores pronto se dieron cuenta de que uno de los principales retos de la transgénesis del ratón era la incapacidad de controlar el destino del ADN exógeno. Debido a que la entrega viral de transgenes en ovocitos de ratón resultó en múltiples copias integradas al azar en el genoma, el possibilitY de establecer líneas transgénicas posteriores fue limitada.
Una de tales limitaciones fue superada cuando Gordon et al. Generó la primera línea de ratón transgénico por microinyección 5 , 6 . Esto comenzó la era de la tecnología del ADN recombinante, y los parámetros que influyen en el resultado de una sesión de microinyección han sido ampliamente estudiados [ 7] . Aunque la microinyección no permite el control sobre el sitio de integración del transgén (que eventualmente da lugar a niveles de expresión específicos para cada ratón fundador), la principal ventaja de la microinjección pronuclear sigue siendo la formación de concatemers ( es decir, matrices de múltiples copias del transgén, Vinculados en serie) antes de la integración genómica 5 . Esta característica se ha utilizado a lo largo de los años para establecer miles de líneas transgénicas de ratón que sobreexpresan un gen de interés. Desde entonces, la transgénesis, la aModificación artificial del genoma de un organismo, se ha utilizado ampliamente para identificar el papel de los genes individuales en la aparición de enfermedades.
Otro logro clave en la manipulación del genoma del ratón se alcanzó cuando Mario Capecchi con éxito interrumpido un solo gen en el ratón, abriendo la era de la orientación de genes [ 8] . Sin embargo, los inconvenientes importantes emergieron rápidamente de la orientación de genes basados en células ES, incluyendo los desafíos de cultivar células ES, el grado de quimerismo algo variable y la duración del proceso ( es decir, 12-18 meses, mínimo, para obtener el ratón) .
Recientemente, los avances en nuevas tecnologías, tales como las endonucleasas de ingeniería ( por ejemplo, las nucleasas de dedo de cinc (ZFN), las nucleasas efectoras tipo activador de la transcripción (TALEN) y las repeticiones palindrómicas cortas intercaladas con intervalos regulares (CRISPR / Cas9) han surgido como métodos alternativos para Acelerar el proceso de orientación de genes en micrófonoE 9 , 10 . Estas endonucleasas pueden inyectarse fácilmente en ovocitos de ratón mediante microinyección, lo que permite la generación de ratones dirigidos a genes en tan sólo 6 semanas.
Desde el primer informe sobre el uso de CRISPR para la edición del genoma 11 , este sistema inmune adaptativo bacteriano ha reemplazado ZFN y TALEN debido a sus muchas ventajas, incluyendo la facilidad de síntesis y la capacidad de apuntar múltiples loci a la vez (denominado "multiplexing "). CRISPR se utilizó por primera vez para la orientación génica en ratones [ 12] y desde entonces se ha aplicado a innumerables especies, de las plantas a los seres humanos [ 13 , 14] . Hasta la fecha, no hay ningún informe de una sola especie resistente a la edición del genoma CRISPR.
Los dos pasos limitantes principales de la generación de ratones transgénicos son la inyección de ovocitos y el reimplanteDe estos ovocitos en hembras pseudo-preñadas. Aunque esta técnica ha sido descrita por nosotros 15 y otros 16 , las recientes mejoras técnicas en embriología de ratón y técnicas de transferencia de genes han revolucionado el proceso de generación de ratones genéticamente modificados. Estas mejoras se describirán en el presente documento.
Protocolo
Todos los procedimientos han sido aprobados por el Comité de Ética y Cuidado de Animales de la Universidad de Nueva Gales del Sur.
1. Preparación del transgén (integración aleatoria)
- Electroforesis analítica en gel de agarosa.
- Digerir el plásmido para extirpar el transgén utilizando enzimas apropiadas (1 h de incubación) o enzimas de digestión rápida (15 a 30 min de incubación) en un termociclador siguiendo las recomendaciones del fabricante (ver Figura 2A y su leyenda).
- Se echó un gel de agarosa de ácido tris-acetato-etilendiaminotetraacético al 1% (TEA), teñido con 0,5-1,0 μg / ml de bromuro de etidio (EtBr).
NOTA: Tenga cuidado cuando utilice EtBr; Es un potente mutágeno. Utilice el equipo de protección personal adecuado (consulte la hoja de datos de seguridad del material). - Cargar un marcador de peso molecular de 1 kb.
- Cargar los fragmentos linealizados ( es decir, transgén y columna vertebral).
- Ejecutar la electroforesis a 100 V durante 45 min.
- Visualizar el gel en un transiluminador ultravioleta (UV) para comprobar que la digestión es completa y confirmar el tamaño correcto del transgén ( es decir, 7,338 pb; véase la figura 2A ).
- Electroforesis preparativa en gel de agarosa.
- Se echó un gel de agarosa TAE al 1% teñido con una tinción de gel de baja toxicidad. Cargar 8 alícuotas (1 μg cada una) de transgén linealizado sin un marcador de peso molecular y ejecutar la electroforesis a 100 V durante 45 min. Utilice un bisturí para excisar todas las 8 bandas correspondientes al transgén linealizado.
- Extraer el ADN usando un kit de extracción de gel siguiendo las recomendaciones del fabricante (ver Tabla de Materiales ).
- Se funden los fragmentos de gel a 50 ° C en tubos de 1,5 ml durante al menos 15 min. Se precipita con isopropanol y luego se añade el tampón de unión.
- Combine todo el DNA pipeteando todo en una columna. Eluir en tampón de microinyección libre de nuclease (Tris-HCl 8 mM y EDTA 0,15 mM). Filtrar a través de un filtro de microcentrífuga de 0,22 μm y centrifugar durante 60 s a 12.000 x g.
- Medir la concentración y la calidad del ADN utilizando un espectrofotómetro. Compruebe que la relación A260 / A280 es de alrededor de 1,8 ( es decir, no hay contaminación por proteínas) y la relación A260 / A230 es de al menos 2,0 ( es decir, no hay contaminación por disolventes orgánicos). Diluir hasta 3 ng / μL en tampón de microinyección sin nucleasa, alícuota (20-50 μL) y congelar a -20 ° C.
2. Síntesis de los componentes CRISPR (Gene Targeting)
- ARNm de Cas9.
- Diluir el ARNm de Cas9 (obtenido de una fuente comercial, véase la Tabla de Materiales ) a una concentración de 1 μg / μl en tampón de microinyección libre de nucleasa.
- Alícuota en 2 μL y libre Ze a -80ºC.
- Single-guide RNA (SgRNA).
- Identificar las dos secuencias genómicas deseadas (guías) utilizando una herramienta de diseño computacional que permite un mínimo potencial fuera de la actividad objetivo [ 17] .
- Para el knockout de genes, seleccionar sistemáticamente dos guías situadas a unos pocos cientos de pares de bases (bp), en direcciones opuestas, e incluir el codón de inicio del gen de interés. Para la reparación directa de homología, seleccione dos guías superpuestas (siempre que sea posible), en direcciones opuestas.
NOTA: A modo de ejemplo, las guías siguientes han sido recientemente co-inyectadas con éxito para interrumpir el primer exón del gen TPM4.2 :
Guía 1: 5 'CGCCATCCAGTTCGCGCTGC 3';
Guía 2: 5 'CAGAACGATTGAGCTATGGC 3'
- Para el knockout de genes, seleccionar sistemáticamente dos guías situadas a unos pocos cientos de pares de bases (bp), en direcciones opuestas, e incluir el codón de inicio del gen de interés. Para la reparación directa de homología, seleccione dos guías superpuestas (siempre que sea posible), en direcciones opuestas.
- Ordenar un conjunto de cebadores como se describe en la Tabla 1 .
- Sintetiza una plantilla de ADN lineal.
- Diluir px330Ref "> 12 a 10 ng / μl en agua libre de nucleasa.
- Prepare la mezcla maestra como se indica en la Tabla 1 . Añadir la polimerasa al final y mantener la mezcla principal en hielo.
- Mezclar y dividir en 8 tubos de PCR (19 μl / tubo). Añadir 1 μl de px330 por tubo y ejecutar la PCR bajo las siguientes condiciones: 1 min a 98 ° C; 40 ciclos de 98 ° C durante 10 s, 64 ° C durante 30 s, y 72 ° C durante 15 s; Y un alargamiento final a 72 ° C durante 5 min. Mantener a 4 ° C.
- Purificar los productos de PCR utilizando un kit de purificación de PCR (véase la Tabla de Materiales ), un colector y una fuente de vacío (para un procesamiento más rápido). Aplicar la máxima resistencia al vacío ( es decir, 8 mbar).
- Añadir 5 volúmenes (100 μl) de tampón de unión a 1 volumen de la muestra de PCR y mezclar.
- Coloque una columna de centrifugado de membrana de sílice (proporcionada) en un tubo de recolección (provisto) de 2 ml para centrifugación o en el colector para el proceso de vacíoEn g. Para unir ADN, aplique sucesivamente las 8 muestras a la columna y vacíe o centrifugue durante 60 s a 12.000 xg para cada carga.
- Para lavar, añadir 0,75 ml de tampón de lavado (tampón PE) a la columna y vacío o centrifugar durante 60 s a 12.000 x g. Centrifugar la columna durante 60 s a 12.000 xg para eliminar el etanol residual.
- Coloque la columna en un tubo limpio de microcentrífuga de 1,5 ml. Para eluir el ADN, añadir 30 μL de agua libre de nucleasa al centro de la membrana, dejar reposar la columna durante 1 min y centrifugar durante 60 s a 12.000 g.
- Medir la concentración utilizando un espectrofotómetro; Típicamente, la concentración debe ser de 100 ng / μl o superior. Compruebe que la relación A260 / A280 es de alrededor de 1,8 ( es decir, no hay contaminación por proteínas) y la relación A260 / A230 es de al menos 2,0 ( es decir, no hay contaminación por disolventes orgánicos).
- Transcripción in vitro usando un kit de síntesis de ARN T7.
- PrepararMezcla principal, como se indica en la Tabla 1 , e incubar durante 3 ha 37 ° C en un termociclador. Añadir 28 μl de agua libre de nucleasa y 2 μl de DNasa I e incubar durante otros 15 minutos a 37 ° C en un termociclador.
- Purificación de ARN utilizando columnas giratorias.
- Disolver el polvo contenido en la columna de centrifugado proporcionada en 650 μl de tampón de microinyección libre de nucleasas, eliminando cuidadosamente todas las burbujas de aire. Tape el tubo e hidrate durante 5 - 15 min a temperatura ambiente.
- Retire la tapa azul en la parte inferior y coloque la columna en un tubo de 2 ml. Centrifugar durante 2 min a 750 xg y temperatura ambiente. Coloque la columna en un tubo fresco de 1,5 ml y aplique 50 μL de la solución de ARN gota a gota al centro, sin tocar la pared de la columna. Girar la columna durante 2 min a 750 x g.
- Mida la concentración de ARN usando un espectrofotómetro (el rendimiento típico de una reacción es de 30 - 50 μg). Compruebe que la relación A260 / A280 esAlrededor de 2,0 ( es decir, sin contaminación por proteínas) y la relación A260 / A230 es de al menos 2,0 ( es decir, no hay contaminación por disolventes orgánicos). Guarde los sgRNAs a -80 ° C hasta su uso.
- Evaluar la calidad del ARN usando los geles TAE al 1% utilizados habitualmente para la electroforesis de ADN. Ejecutar 200-400 ng de la plantilla de ADN y el correspondiente sgRNA en paralelo. La banda de ARN (≈ 100 pb) debería ser ligeramente mayor que la banda de ADN (véase la Figura 3A ).
- Identificar las dos secuencias genómicas deseadas (guías) utilizando una herramienta de diseño computacional que permite un mínimo potencial fuera de la actividad objetivo [ 17] .
3. Plantilla de donante
- Solicitar oligonucleótidos monocatenarios sintetizados comercialmente (ssOligos, véase la Tabla de Materiales ) para mutaciones puntuales o para la integración de pequeñas secuencias de hasta 50 pb; Homología armas son típicamente 60-90 pb de largo.
- Para inserciones más grandes, use un plásmido donante como plantilla. Generar un plásmido adecuado usando el método de clonación clásico o la síntesis de novo de unFuente comercial.
NOTA: Se recomienda un mínimo de 800 pb por homología. El tamaño de la columna vertebral no tiene influencia sobre la eficiencia de la homología directa de reparación (HDR).
4. Mezcla de inyección
- Diluir el ARNm de Cas9 a 50 ng / μl y los sgRNAs a 12,5 ng / μl (25 ng / μL en total) utilizando tampón de microinyección libre de nucleasa para experimentos de knockout génico. Añadir la plantilla de donante (ssOligo o plásmido) a una concentración de 200 ng / μ l para el genoma de edición de experimentos basados en homología reparación directa.
NOTA: Los volúmenes de dilución se pueden determinar fácilmente utilizando herramientas en línea, como una calculadora de resuspensión 18 . - Mantenga cada alícuota en hielo durante la sesión de microinyección y deséchela después (no vuelva a congelar la mezcla de inyección).
5. Vasectomía escrotal
NOTA: Dos tipos de vasectomía se realizan comúnmente en ratones: abdominal y escrotal. El últimoEs menos invasiva y se ha descrito previamente [ 15] .
- Autoclave todos los instrumentos quirúrgicos de acero inoxidable.
- Determinar el peso del ratón usando una escala de pesada y anestesiar a los machos por inyección intraperitoneal (ip) con anestésicos inyectables (ketamina 100 mg / kg, xilazina 10 mg / kg).
- Monitoree la pérdida del reflejo del pellizco del dedo del pie y una vez que el ratón está sedado colóquelo encima de un cojín de calefacción.
- Desinfectar la piel alrededor de los testículos con toallitas alternas de un antiséptico tópico como la clorhexidina y etanol al 70%.
- Empuje los testículos hacia el saco escrotal y haga una incisión en la piel con un bisturí.
- Visualice el testículo, la cauda del epidídimo y el conducto deferente.
- Coge el conducto deferente con fórceps, sosténgalo y cauterize en cada lado de la pinza para retirar 3 mm del conducto deferente.
- Realizar el mismo procedimiento en el segundo testículo.
- Cierre las incisiones de la piel con clips de herida yRatón de cerca hasta la recuperación completa.
6. Superovulación (donantes de ovocitos) y el tiempo de apareamiento (hembras pseudo-embarazadas)
NOTA: La técnica para generar un número adecuado de ovocitos fecundados y hembras foster taponadas para reimplantación se ha descrito en otra parte 15 .
- Inyectar 10 mujeres ip con 5 UI de gonadotropina sérica de yegua preñada (PMSG, en 100 μl) a las 12:00 del día 1.
- Inyectar las hembras ip con 5 UI de gonadotropina coriónica humana (hCG, en 100 μl) 46-48 h después (alrededor de las 11 am del día 3).
- Acoplar inmediatamente a las hembras con machos de una sola vivienda durante la noche.
7. Inyecciones pronucleares (de integración aleatoria) y citoplásmicas (de orientación génica)
- Cull los ratones superovulados por dislocación cervical, exponer el abdomen, y el acceso a los ovarios y oviductos, como se describe anteriormente [ 15] . Diseccionar el oViducts y cosechar los complejos cumulus-ovocito (COCs) bajo un stereomicorscope [ 15] . Colóquelas en una gota de potasio simple optimización medio suplementado con aminoácidos (KSOMaa) siguiendo el método tradicional 15 .
- Purificar los ovocitos añadiendo aproximadamente 1 μl de hialuronidasa (10 mg / ml) a la gota de medio KSOMaa utilizando una pieza bucal del aspirador y colocar la cápsula en una incubadora a 37ºC / CO2 al 5% durante 30 s a 1 min.
- Lavar los ovocitos con 4 gotas nuevas de medio KSOMaa utilizando la pieza bucal del aspirador y transferirlos a una gota final de medio KSOMaa recubierto con aceite mineral (alrededor de 2 ml). Colocar el plato en la incubadora de 37 ° C / CO 2 al 5% hasta que los ovocitos estén listos para la inyección.
- Inyección pronuclear (integración aleatoria).
- Visualizar los huevos bajo el microscopio estereoscópico y transferir aproximadamente 50 huevos a la cámara de inyecciónP de medio M2 recubierto con aceite mineral) usando la pieza bucal del aspirador.
- Transferir la cámara de inyección al microscopio invertido e inyectar los ovocitos fecundados (dos pronúcleos visibles) con unos picolitros de la mezcla de inyección, apuntando a un pronúcleo (cualquiera de los pronúcleos puede ser objetivo). Visualizar una inyección exitosa observando la hinchazón del pronúcleo.
- Inyección citoplasmática (orientación génica).
- Transferir aproximadamente 50 huevos a una gota de KSOMaa que contiene 5 μg / ml de citocalasina B usando la pieza bucal e incubar durante 5 min en la incubadora a 37ºC / CO 2 al 5%.
- Transferir los huevos a la cámara de inyección con la pieza bucal.
- Inyectar pocos picolitros de la mezcla de inyección en el citoplasma a una presión muy baja (50-100 hPa), utilizando la presión de compensación del microinyector automático cuando sea posible.
- Después de la inyección, transfiera los ovocitos de nuevo a una gota de KSOMaa (con la boca) y mantenerlos en el incubador de 37 ° C / 5% CO 2 , hasta que se cargan para su reimplantación en el oviducto de las hembras pseudo-preñadas.
8. Reimplantación
- Autoclave todos los instrumentos quirúrgicos de acero inoxidable.
- Determinar el peso del ratón utilizando la escala de pesada y anestesiar a las hembras por inyección intraperitoneal (ip) con anestésicos inyectables (ketamina 100 mg / kg, xilazina 10 mg / kg).
- Monitoree la pérdida del reflejo del pellizco del dedo del pie y una vez que el ratón está sedado colóquelo encima de un cojín de calefacción.
- Clip de una gran área de la piel alrededor de la línea media dorsal de la hembra del ratón.
- Desinfectar la piel expuesta con toallitas alternas de un antiséptico tópico como la clorhexidina y etanol al 70%.
- Exponer el tracto reproductivo siguiendo el método tradicional 15 . Haga una incisión de la piel de 1 cm de longitud paralela a la línea media dorsal, corte el músculo y agarre la almohadilla de grasa wiCon una pinza, luego tire suavemente del ovario hasta que su oviducto y el útero estén claramente visibles.
- Fijar la almohadilla de grasa con una abrazadera del recipiente. Visualice el oviducto bajo el microscopio estereoscópico y usando un par de micro-tijeras hacer una incisión en la pared del oviducto pocos milímetros aguas arriba de la ampolla.
- Bajo el microscopio estereoscópico, cargue 25 huevos microinyectados en el capilar de vidrio conectado a la pieza bucal (el diámetro interno del capilar debe ser alrededor de 120 μm de ancho). Introducir el capilar de vidrio en el oviducto y expulsar hasta que una burbuja de aire sea visible dentro de la ampolla.
- Retire suavemente el capilar de vidrio y coloque el tracto reproductivo en el abdomen. Suturar la incisión con suturas quirúrgicas no absorbibles 3-0, luego cerrar con clips de herida. Monitoree el ratón de cerca hasta la recuperación completa.
9. Estrategias de genotipificación / secuenciación
NOTA: Aislar el genomaADN de biopsias de 2 mm de la cola o del oído, siguiendo las normas de ética animal pertinentes.
- Extracción rápida de ADN genómico (integración aleatoria).
- Lyse las muestras de tejido (~ 2 mm) a 95 ° C durante 1 h en 100 μ l de reactivo de lisis alcalina (25 mM hidróxido de sodio y 0,2 mM EDTA, pH = 12).
- Añadir 100 μl de reactivo neutralizante (Tris-HCl 40 mM, pH = 5).
- Centrifugar durante 5 min a 12.000 gy 4 ° C.
- Extracción de ADN genómico de alta calidad (orientación génica).
- Se añaden 500 μl de tampón cola (Tris 50 mM, pH = 8, EDTA 100 mM, pH = 8, NaCl 100 mM, SDS al 1% y proteinasa K 0,5 mg / ml).
- Incubar durante la noche a 55 ° C.
- Mezclar durante 5 minutos por inversión (no vórtice).
- Añadir 250 μL de NaCl saturado (6 M) y mezclar durante 5 min por inversión (no agitar vórtice).
- Hacer girar durante 5-10 minutos a 12.000 xg y 4 ° C y verter el sobrenadante en el tubo nuevo.
- Añadir 500 μl de isopropanol y mezclar durante 5 min por inversión (no vórtice).
- Girar durante 10 min a 12.000 xg y temperatura ambiente.
- Decantar el sobrenadante (el pellet es invisible y se pega al tubo).
- Lavar con 1 ml de etanol al 70%.
- Girar durante 5-10 min a 12.000 xg y temperatura ambiente. Retire el sobrenadante con cuidado, ya que el pellet blanco ya no es pegajoso y se puede perder.
- Secar al aire durante ~ 1 h.
- Añadir 400 μl de tampón TE (Tris 10 mM y EDTA 1 mM, pH = 8).
- Disolver el ADN a 55-60 ° C durante 2 h.
- Diseño del cebador.
- Diseño de los cebadores un mínimo de 20 pb de largo utilizando una herramienta computacional 19 .
NOTA: Para la integración aleatoria, los cebadores deben hibridarse con el transgén, generando un fragmento distinto de 200-800 pb. Para la orientación génica, diseñar los cebadores para que se hibridan con el ADN genómico, la generación de un distinto fRación de unos cientos de pb alrededor de los sitios de corte. Para inserciones grandes, los cebadores pueden sentarse sobre el transgén, pero la confirmación de la integración dirigida se debe realizar posteriormente usando el caminar de imprimación o una técnica similar.
- Diseño de los cebadores un mínimo de 20 pb de largo utilizando una herramienta computacional 19 .
- PCR genotipificación.
- Para cada modificación genómica, diseñar un nuevo protocolo de PCR y probarlo empíricamente. Consideremos la longitud del fragmento generado y la temperatura de fusión (Tm) de cada par de cebadores.
- Secuenciación.
- Para la orientación de genes, envíe productos de PCR a un proveedor de servicios de secuenciación de Sanger.
Resultados
A continuación, se describen los flujos de trabajo para la microinyección en el caso de la integración aleatoria y la orientación de genes mediados por CRISPR ( Figura 1 ).
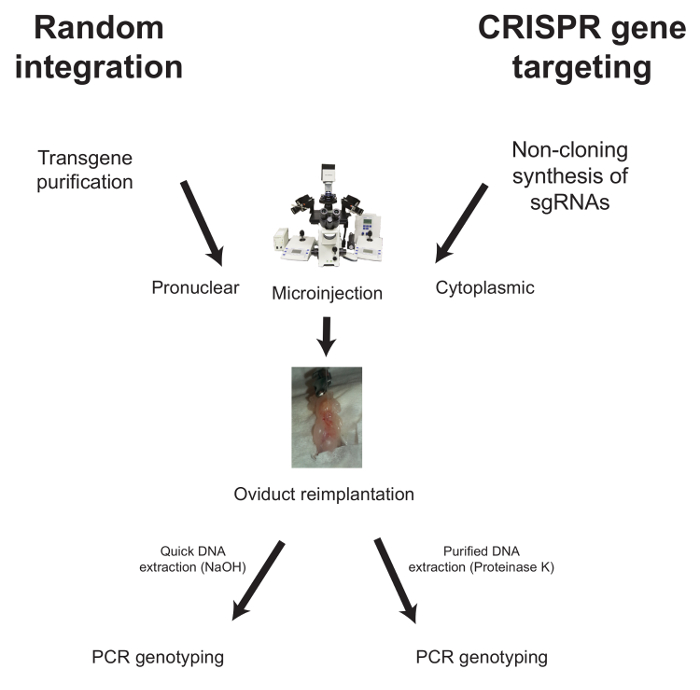
Figura 1: Flujo de trabajo típico para la generación de ratones modificados genéticamente. Para la integración a...
Discusión
Pasos críticos dentro del protocolo
Se sabe que la generación de ratones modificados genéticamente es técnicamente difícil. Sin embargo, el protocolo presentado aquí es un método optimizado y simplificado que permite dominar y solucionar problemas de la técnica en tiempo récord. Hay dos pasos necesarios para la finalización exitosa de la técnica. En primer lugar, la síntesis de plantillas de ADN lineal (para la síntesis de sgRNAs) se puede lograr sin cloruro de magnesio (MgCl ...
Divulgaciones
Los autores proporcionan servicios de transgénesis académica en ratones a través de la Universidad de Nueva Gales del Sur Mark Wainwright Analytical Center.
Agradecimientos
Los autores agradecen al personal de la instalación de animales (BRC) por su apoyo continuo. Este trabajo fue financiado por el Consejo Nacional de Salud y de Investigación Médica y el Consejo Australiano de Investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 ul | Eppendorf | 4920000016 | |
| Micropipette 2-20 ul | Eppendorf | 4920000040 | |
| Micropipette 20-200 ul | Eppendorf | 4920000067 | |
| Micropipette 100-1000 ul | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
Referencias
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. . The Monk in the Garden. , (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- . Resuspension Calculator Available from: https://sg.idtdna.com/calc/resuspension/ (2017)
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49 (2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538 (2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88 (2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431 (2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479 (2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados