JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
난 모세포의 미세 주입을 통한 유전자 조작 마우스의 생성
요약
마우스 oocytes의 microinjection는 일반적인 transgenesis ( 즉, transgenes의 무작위 통합) 및 CRISPR 매개 유전자 타겟팅 모두에 일반적으로 사용됩니다. 이 프로토콜은 품질 관리 및 유전자 타이핑 전략에 중점을두고 마이크로 인젝션의 최신 개발 상황을 검토합니다.
초록
유전자 조작 마우스의 사용은 생체 내 및 병리학 적 생체 내 과정 모두에 대한 연구에 크게 기여했다. 수정 된 난 모세포 내로의 DNA 발현 구조물의 전 핵 주입은 과발현을위한 형질 전환 쥐를 생성하는 가장 보편적 인 기술로 남아있다. 유전자 표적화를위한 CRISPR 기술이 도입됨에 따라 수정 된 난 모세포에 전핵을 주입하여 knockout과 knockin 마우스를 생성 할 수있게되었다. 이 연구는 유전자 타겟팅을위한 사출 용 DNA의 준비와 CRISPR 가이드의 생성을 기술하고 있으며 특히 품질 관리에 중점을두고 있습니다. 잠재적 인 창시자를 확인하는 데 필요한 유전형 분석 절차가 중요합니다. CRISPR의 "멀티플렉싱"기능을 활용하는 혁신적인 유전자형 전략이 여기에 제시됩니다. 수술 절차도 요약되어 있습니다. 함께, 프로토콜의 단계는 세대의 생성을 허용합니다면역학, 신경 과학, 암, 생리학, 발달 및 기타를 포함한 수많은 연구 분야에서 마우스 식민지를 확립하는 데 사용됩니다.
서문
척추 동물과 무척추 동물의 동물 모델은 알츠하이머 병과 같은 인간의 병태 생리학을 검사하는 도구가되어왔다. 그들은 질병 치료제를 찾고 궁극적으로 완치를위한 새로운 치료 전략을 개발할 수있는 귀중한 도구이기도합니다. 각 모델에는 본질적인 한계가 있지만, 전신 모델로 동물을 사용하는 것은 생물 의학 연구에 필수적입니다. 이것은 신진 대사와 복잡한 생리 환경이 조직 배양에서 완전히 모의 될 수 없기 때문입니다.
지금까지 마우스는 유전자 조작에 사용되는 가장 일반적인 포유류 종으로 남아 있기 때문에 몇 가지 장점이 있습니다. 질병과 관련된 생리적 과정과 유전자는 생쥐와 인간 사이에서 매우 잘 보존되어 있습니다. 마우스는 인간 게놈보다 일년 전에 (2002 년) 전체 유전체 염기 서열을 갖는 최초의 포유 동물이었다.나 (2003). 이 풍부한 유전자 정보 외에, 번식 능력이 좋고 발달주기가 빠르며 (수정으로부터 이유식까지 6 주) 적당한 크기입니다. 뚜렷한 외투 색상 (교차 전략에 필요)과 같은 생리적 인 지표와 결합 된 이러한 모든 장점은 마우스를 유전자 조작을위한 매력적인 모델로 만들었습니다. 주목할 만하게, 현대 유전학의 아주 이른 나이에서는, Gregor Mendel는 식물 3으로 움직이기 전에 쥐에 종사 시작했다.
유전자 전달 기술은 바이러스 성 전달을 이용하여 처음 생성 된 30 년 전의 첫 번째 형질 전환 마우스의 생성을 가져왔다. 그러나 연구자들은 곧 마우스 전이의 주요 과제 중 하나가 외인성 DNA의 운명을 제어 할 수 없다는 것을 깨달았습니다. 마우스 난 모세포로 형질 전환 유전자를 바이러스로 전달하면 게놈에 무작위로 여러 복제물이 통합되기 때문에,후속 형질 전환 계통을 확립하는 것이 제한적이었다.
이러한 한계 중 하나는 Gordon et al. microinjection 5 , 6 에 의한 최초의 형질 전환 마우스 라인을 생성했다. 이것은 재조합 DNA 기술의 시대를 열었고 마이크로 인젝션 세션의 결과에 영향을 미치는 매개 변수가 널리 연구되었습니다 7 . 마이크로 인젝션 (microinjection)은 형질 도입 유전자의 통합 부위에 대한 제어를 허용하지 않지만 (결과적으로 각 창 마우스에 대한 특이적인 발현 수준을 유도 함), 전 핵 마이크로 인젝션의 주요 이점은 컨 테이너 (concatemer)의 형성이다 ( 즉 , 게놈 통합 이전에 시리즈로 링크 됨) 5 . 이러한 특성은 수년 동안 관심있는 유전자를 과발현하는 수천 개의 트랜스 제닉 마우스 라인을 수립하는데 사용되었습니다. 그 이후로 유전자 변형,유기체 게놈의 인공 수정은 질병 발생시 단일 유전자의 역할을 확인하는 데 광범위하게 사용되었습니다.
마리오 카 페치 (Mario Capecchi)가 생쥐의 단일 유전자를 성공적으로 파괴하여 유전자 표적화 시대를 열었을 때 마우스 게놈을 조작하는 데있어 중요한 성과를 달성했습니다. 그러나 ES 세포 배양의 어려움, 약간의 가변성의 키메라 (chimerism) 정도, 과정의 길이 ( 즉, 마우스를 얻는 데 최소 12-18 개월)를 비롯하여 ES 세포 기반 유전자 표적화에서 주요 단점이 빠르게 나타났다. .
최근에, ZFN, TALEN 및 CISPR / Cas9와 같은 신기술의 진보가 대체 방법으로 등장했다. 마이크에서 유전자 타겟팅 과정을 가속화한다.e 9 , 10 . 이 endonucleases는 microinjection에 의해 마우스 난 모세포에 쉽게 주입 될 수 있으며, 6 주 이내에 유전자 표적 마우스를 생성 할 수 있습니다.
게놈 편집을위한 CRISPR 사용에 관한 첫 번째 보고서 이후이 박테리아 적응 면역 시스템은 ZFN과 TALEN을 대체했으며 그 이유는 합성의 용이함과 동시에 여러 유전자좌를 표적으로하는 능력 ( "멀티플렉싱 "). CRISPR은 생쥐 12 번에서 유전자 타겟팅에 처음 사용되었으며 이후 식물에서 사람 13,14 로 무수한 종에 적용되었습니다. 현재까지 CRISPR 게놈 편집에 저항하는 단일 종에 대한보고는 없다.
유전자 변형 생쥐의 생성의 두 가지 주요 제한 단계는 난 모세포의 주입과 재 이식이 난 모세포를 가짜 임신 한 암컷으로 이 기술은 우리와 15 에 의해 기술되었지만 최근의 쥐 발생학 및 유전자 전달 기술의 기술적 향상은 유 전적으로 변형 된 쥐를 생성하는 과정에 혁명을 일으켰습니다. 이러한 개선 사항은 여기에 설명됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 절차는 뉴 사우스 웨일즈 동물 보호 및 윤리위원회의 승인을 받았습니다.
1. Transgene의 준비 (Random Integration)
- 분석 아가 로스 겔 전기 영동.
- 제조자의 권고 사항을 따르는 thermocycler에서 적절한 효소 (1 시간 배양) 또는 빠른 분해 효소 (15 ~ 30 분 배양)를 사용하여 도입 유전자를 제거하기 위해 플라스미드를 분해하십시오 ( 그림 2A 및 그 전설 참조).
- 0.5 ~ 1.0 μg / ML ethidium bromide (EtBr)로 염색 한 1 % 트리스 - 아세테이트 - 에틸렌 디아민 테트라 아세트산 (EDTA) (TEA) 아가로 오스 겔을 주조합니다.
참고 : EtBr을 사용할 때는주의하십시오. 그것은 유력한 돌연변이 원입니다. 적절한 개인 보호 장비를 사용하십시오 (물질 안전 보건 자료 참조). - 1 kb 분자량 마커를로드하십시오.
- 선형화 된 조각 ( 즉, 도입 유전자 및 백본)을로드하십시오.
- 전기 영동을 100V에서 45 분 동안 실행합니다.
- 자외선 (UV) 투과 조명기에서 젤을 시각화하여 소화가 완료되었는지 확인하고 트랜스 진 ( 즉, 7,338 bp, 그림 2A 참조 )의 정확한 크기를 확인하십시오.
- 준비 아가로 오스 겔 전기 영동.
- 저독성 젤 얼룩으로 염색 된 1 % TAE 아가 로즈 겔을 주조하십시오. 분자량 마커가없는 직선화 된 도입 유전자 8 개 (각 1 μg)를 넣고 45 분 동안 100 V에서 전기 영동하십시오. 선형화 된 도입 유전자에 해당하는 8 개의 모든 밴드를 제거하려면 메스를 사용하십시오.
- 제조사의 권고 사항에 따라 젤 추출 키트를 사용하여 DNA를 추출합니다 ( 재료 표 참조).
- 적어도 15 분 동안 1.5 ML 튜브 50 ° C에서 겔 조각을 녹여. 이소프로판올로 침전시킨 다음 결합 버퍼를 첨가하십시오.
- 전체 D 조 합치기모든 것을 하나의 컬럼으로 피펫 팅하여 NA. 뉴 클레아제가없는 마이크로 인젝션 완충액 (8 mM Tris-HCl 및 0.15 mM EDTA)으로 용출시킨다. 0.22 μm의 미세 원심 분리 필터를 거쳐 12,000 x g에서 60 초 동안 원심 분리하십시오.
- 분광 광도계를 사용하여 DNA의 농도와 품질을 측정하십시오. A260 / A280 비율이 1.8 ( 즉, 단백질에 의한 오염 없음)이고 A260 / A230 비율이 2.0 이상 ( 즉, 유기 용제에 의한 오염 없음)인지 점검하십시오. nuclease-free 마이크로 인젝션 버퍼, 분액 (20-50 μL)에서 3 ng / μL로 희석하고 -20 ° C에서 동결하십시오.
2. CRISPR 성분의 합성 (유전자 표적화)
- Cas9 mRNA.
- nuclease-free 마이크로 인젝션 버퍼에 1 μg / μL의 농도로 Cas9 mRNA (상업용 소스에서 얻음, Table of Materials 참조)를 희석 하십시오.
- 2 μL 및 무료로 나누어지는 -80 ° C에서하십시오.
- 단일 가이드 RNA (SgRNA).
- 최소한의 잠재적 인 목표 외 활동을 허용하는 컴퓨터 설계 도구를 사용하여 원하는 두 표적 게놈 서열 (지침)을 확인하십시오.
- 유전자 녹아웃의 경우, 반대 방향으로 수백 개의 염기쌍 (bp) 떨어져있는 두 개의 가이드를 체계적으로 선택하고 관심 유전자의 시작 코돈을 포함시킵니다. 상 동성 직접 수리의 경우, 가능한 한 두 개의 중첩 가이드를 반대 방향으로 선택하십시오.
참고 : 예를 들어, 다음 안내서는 최근 TPM4.2 유전자의 첫 번째 엑손을 파괴하기 위해 성공적으로 공동 주입되었습니다 :
가이드 1 : 5 'CGCCATCCAGTTCGCGCTGC 3';
가이드 2 : 5 'CAGAACGATTGAGCTATGGC 3'
- 유전자 녹아웃의 경우, 반대 방향으로 수백 개의 염기쌍 (bp) 떨어져있는 두 개의 가이드를 체계적으로 선택하고 관심 유전자의 시작 코돈을 포함시킵니다. 상 동성 직접 수리의 경우, 가능한 한 두 개의 중첩 가이드를 반대 방향으로 선택하십시오.
- 표 1 에 설명 된대로 프라이머 세트를 주문하십시오.
- 선형 DNA 템플릿을 합성합니다.
- 희석 px330Nuclease-free water에서 10 ng / μL까지 플라스미드를 교체하십시오.
- 표 1 에 표시된대로 마스터 믹스를 준비합니다. 마지막에 폴리머 라제를 첨가하고 마스터 믹스를 얼음에 보관하십시오.
- 이를 8 개의 PCR 튜브 (19 μL / 튜브)로 나누고 나누십시오. 튜브당 px330 1 μL를 추가하고 다음 조건에서 PCR을 실행하십시오 : 98 ° C에서 1 분; 98 ℃에서 10 초, 64 ℃에서 30 초, 72 ℃에서 15 초의 40주기; 및 72 ℃에서 5 분 동안의 최종 신도. 4 ° C에서 유지.
- PCR 정제 키트 (물질 표 참조), 다기관 및 진공 원 (빠른 처리를 위해)을 사용하여 PCR 생성물을 정제하십시오. 최대 진공 강도 ( 예 : 8 mbar)를가하십시오.
- PCR 샘플 1 볼륨에 결합 버퍼의 5 볼륨 (100 μL)을 추가하고 섞는다.
- 원심 분리를 위해 2-mL 수집 튜브 (제공) 또는 진공 공정을위한 매니 폴드에 (제공 한) 실리카 멤브레인 스핀 컬럼을 놓습니다ing. DNA를 바인딩하려면 8 개의 시료를 모두 컬럼에 연속적으로 넣고 60 초 동안 진공 또는 12,000 xg로 원심 분리합니다.
- 세척을 위해 0.75 mL의 세척 완충액 (완충액 PE)을 컬럼에 넣고 12,000 x g에서 60 초 동안 진공 또는 원심 분리한다. 잔류 에탄올을 제거하기 위해 12,000 xg에서 60 초 동안 컬럼을 원심 분리하십시오.
- 컬럼을 깨끗한 1.5 mL 미세 원심 분리 튜브에 넣으십시오. DNA를 용리시키기 위해 멤브레인의 중심에 30 μl의 nuclease가없는 물을 넣고 컬럼을 1 분 동안 방치 한 다음 12,000 g에서 60 초 동안 원심 분리하십시오.
- 분광 광도계를 사용하여 농도를 측정하십시오. 일반적으로 농도는 100 ng / μL 이상이어야합니다. A260 / A280 비율이 1.8 ( 즉, 단백질에 의한 오염 없음)이고 A260 / A230 비율이 2.0 이상 ( 즉, 유기 용제에 의한 오염 없음)인지 점검하십시오.
- T7 RNA 합성 키트를 이용한 시험관 전사.
- 준비하기그는 표 1 에 표시된대로 마스터 믹스하고 thermocycler에서 37 ° C에서 3 시간 품어. nuclease-free 물 28 μL와 DNase I 2 μL를 넣고 37 ℃에서 15 분 더 incubate하십시오.
- 스핀 컬럼을 이용한 RNA 정제.
- 제공된 스핀 컬럼에 담긴 파우더를 nuclease-free microinjection buffer 650 μL에 녹여 모든 기포를 조심스럽게 제거합니다. 튜브에 뚜껑을 덮고 실온에서 5-15 분 동안 수화시킵니다.
- 하단의 파란색 캡을 제거하고 컬럼을 2 mL 튜브에 넣으십시오. 750 XG 및 실온에서 2 분 동안 원심 분리기. 칼럼을 새로운 1.5-mL 튜브에 넣고 칼럼 벽을 건드리지 않고 50㎕의 RNA 용액을 가운데에 적가한다. 칼럼을 750 x g에서 2 분간 돌린다.
- 분광 광도계를 사용하여 RNA 농도를 측정하십시오 (한 반응의 일반적인 수율은 30 - 50 μg입니다). A260 / A280 비율이2.0 ( 즉, 단백질에 의한 오염이 없음)이고 A260 / A230 비는 2.0 이상 ( 즉, 유기 용제에 의한 오염 없음)이다. 사용하기 전까지 -80 ° C에서 sgRNA를 보관하십시오.
- DNA 전기 영동을 위해 일상적으로 사용되는 1 % TAE 젤을 사용하여 RNA의 품질을 평가하십시오. 200-400 ng의 DNA 주형과 해당 sgRNA를 동시에 실행하십시오. RNA 밴드 (≈ 100 bp)는 DNA 밴드보다 약간 커야합니다 ( 그림 3A 참조 ).
- 최소한의 잠재적 인 목표 외 활동을 허용하는 컴퓨터 설계 도구를 사용하여 원하는 두 표적 게놈 서열 (지침)을 확인하십시오.
3. 기증자 템플릿
- 점 돌연변이 또는 50bp 이하의 작은 서열의 통합을 위해 상업적으로 합성 된 1 본쇄 올리고 뉴클레오티드 (ssOligos, 표 2 참조)를 주문하십시오. 상 동성 암은 전형적으로 60-90 bp이다.
- 더 큰 삽입을 위해, 기증자 플라스미드를 주형으로 사용하십시오. 고전적인 클로닝 방법을 사용하여 적절한 플라스미드를 생성하거나상업적 출처.
참고 : 상 동성 암당 최소 800 bp를 권장합니다. 백본의 크기는 상 동성 직접 수선 (HDR)의 효율성에 영향을 미치지 않습니다.
4. 사출 성형
- 유전자 녹아웃 실험을 위해 nuclease-free microinjection buffer를 사용하여 Cas9 mRNA를 50 ng / μL로 희석하고 sgRNA를 12.5 ng / μL (총 25 ng / μL)로 희석한다. 상 동성 직접 수리를 기반으로 게놈 편집 실험 200 ng / μL의 농도에서 기증자 템플릿 (ssOligo 또는 플라스미드)를 추가합니다.
참고 : 희석액은 재 계산기 18 과 같은 온라인 도구를 사용하여 쉽게 결정할 수 있습니다. - microinjection 세션 동안 얼음에 각 나누어지는 유지하고 나중에 폐기 (주입 믹스를 다시 동결하지 마십시오).
5. 음낭 정관 절제술
참고 : 두 종류의 정관 수술은 일반적으로 생쥐에서 수행됩니다 : 복부 및 음낭. 후자의덜 침략적이며 이전에 설명되었습니다 15 .
- 모든 스테인레스 스틸 수술기구를 고압 증기 멸균하십시오.
- 체중계를 사용하여 마우스의 무게를 결정하고 주사 마비 (케타민 100 MG / kg, xylazine 10 MG / kg)와 intraperitoneal (IP) 주사하여 남성을 마취.
- 발가락 핀치 반사의 손실을 모니터하고 마우스가 진정되면 발열 패드 위에 올려 놓습니다.
- 클로르헥시딘과 70 % 에탄올과 같은 국소 소독제를 번갈아 사용하여 고환 주위의 피부를 소독합니다.
- 고환을 음낭 안으로 밀어 넣고 메스로 피부 절개를하십시오.
- testis, cauda epididymis 및 vas deferens를 시각화하십시오.
- 집게로 유리관을 잡고, 잡고, 집게의 3mm를 제거하기 위해 집게 양쪽을 소성합니다.
- 두 번째 testis에 동일한 절차를 수행하십시오.
- 상처 클립으로 피부 절개 부를 닫고완전히 회복 될 때까지 마우스를 가까이서 누릅니다.
6. Superovulation (난자 기증자)과 Time-mating (의사 임신 한 여성)
주 : 적절한 수의 수정 된 난 모세포를 생성하고 재 이식을 위해 위탁 암컷을 막는 기술은 다른 곳에서 기술되어있다.
- 1 일 12 시경 약 5 IU의 임산부의 혈청 생식샘 자극 호르몬 (PMSG; 100 μL)을 10 명의 여성에게 투여한다.
- 46 ~ 48 시간 후 (3 일 오전 11 시경) 5 IU의 인간 chorionic 성선 자극 호르몬 (hCG, 100 μL)을 투여합니다.
- 하룻밤 사이에 한 마리의 수컷 남성과 암컷을 즉시 교배하십시오.
7. 전핵 (무작위 통합)과 세포질 (유전자 타겟팅) 주사
- 이전에 설명한 바와 같이, 자궁 경부 탈구로 과식 배란 된 마우스를 뽑아 내고, 복부를 노출시키고, 난소와 난관에 접근하십시오. 오해입체 시야 (stereomicorscope)하에 적운 - 난 모세포 복합체 (cumulus-oocyte-complexes, COCs)를 수확합니다. 전통적인 방법 15에 따라 아미노산 (KSOMaa)가 보충 된 칼륨 심플 렉스 최적화 배지 1 방울에 넣으십시오.
- 흡인기 입 조각을 사용하여 KSOMaa 매체의 방울에 hyaluronidase (10 밀리그램 / ML)의 approximally 1μL를 추가하여 oocytes을 정화하고 1 분에 30 초 동안 37 ° C / 5 % CO 2 배양기에 접시를 놓습니다.
- 흡인기 마우스 조각을 사용하여 KSOMaa 매체 4 신선한 방울과 Oocytes을 씻어 KSOMaa 매체의 최종 드롭에 전송 미네랄 오일 (약 2 ML)와 중첩. oocytes가 주사 준비가 될 때까지 37 ° C / 5 % CO 2 배양기에 접시를 놓습니다.
- 원핵 주입 (무작위 통합).
- 입체 현미경으로 알을 시각화하고 약 50 개의 알을 주입 챔버 (droM 배지에 미네랄 오일을 중층 한 것).
- 사출 챔버를 거꾸로 현미경으로 옮기고 수정 핵 세포 (두 개의 보이는 전핵)에 주사 핵산을 타겟팅하는 몇 가지 피코 리터를 주입합니다 (전핵의 표적이 될 수 있음). 전핵의 부종을 관찰하여 성공적인 주사를 시각화하십시오.
- 세포질 주사 (유전자 표적화).
- 마우스 조각을 사용하여 5 μg / ML Cytochalasin B를 포함 KSOMaa의 방울로 약 50 계란을 전송하고 37에서 5 분 동안 품어 ° C / 5 % CO 2 배양기.
- 마우스 피스를 사용하여 주입 챔버에 알을 옮긴다.
- 가능한 경우 자동 마이크로 인젝터의 보정 압력을 사용하여 매우 낮은 압력 (50-100 hPa)에서 세포질에 주사 믹스를 몇 피코 리터 주입하십시오.
- 주사 후, 난 모세포를 한 방울의 KSOMaa (마우스 피스를 사용)를 37 ° C / 5 % CO 2 인큐베이터에 보관하여 의사 임신 여성의 난관으로 재 주입합니다.
8. 이식
- 모든 스테인레스 스틸 수술기구를 고압 증기 멸균하십시오.
- 체중계를 사용하여 마우스의 무게를 결정하고 주 사용 마취제 (ketamine 100 MG / kg, xylazine 10 MG / kg)와 intraperitoneal (IP) 주사하여 여성을 마취.
- 발가락 핀치 반사의 손실을 모니터하고 마우스가 진정되면 발열 패드 위에 올려 놓습니다.
- 여성 마우스의 지느러미 중간 선 주위에 모피의 넓은 부분을 자르십시오.
- 클로르헥시딘 (chlorhexidine)과 70 % 에탄올 (ethanol)과 같은 국소 소독제를 번갈아 사용하여 노출 된 피부를 소독하십시오.
- 전통적인 방법 15에 따라 생식 기관을 드러내십시오. 지느러미 정중선과 평행 한 1cm 길이의 피부 절개를 만들고 근육을 자르고 지방 패드를 잡습니다.th 포셉, 그럼 부드럽게 첨부 난관과 자궁이 명확하게 볼 때까지 난소를 꺼내.
- 지방 패드를 혈관 클램프로 고정하십시오. 입체 현미경으로 난관을 시각화하고 한 쌍의 마이크로 가위를 사용하여 관의 몇 밀리미터 상류에있는 난관의 벽을 절개합니다.
- 입체 현미경으로 마우스 피스에 연결된 유리 모세관에 25 개의 미세 주입 된 계란을 넣습니다 (모세 혈관의 내경은 약 120 μm 여야합니다). oviduct에 유리 모세관을 도입하고 공기 방울이 ampulla 내부에 보일 때까지 뺍니다.
- 부드럽게 유리 모세관을 제거하고 복부로 생식 기관을 다시 놓습니다. 3-0 비 흡수성 외과 봉합으로 절개를 봉합 한 다음 상처 클립으로 닫습니다. 전체 복구가 완료 될 때까지 마우스를 면밀히 모니터링하십시오.
9. 유전자 타이핑 전략 / 시퀀싱
참고 : 게놈 분리관련 동물 윤리 규정에 따라 2-mm 꼬리 또는 귀 생검에서 얻은 DNA.
- 빠른 게놈 DNA 추출 (무작위 통합).
- 알칼리 용해 시약 (25 MM 수산화 나트륨 및 0.2 MM EDTA, 산도 = 12)의 100 μL에서 1 시간 95 ° C에서 조직 샘플 (~ 2 mm)을 Lyse.
- 중화 시약 (40 mM Tris-HCl, pH = 5) 100 μL를 넣는다.
- 12,000 g 및 4 ° C에서 5 분간 원심 분리하십시오.
- 고품질 게놈 DNA 추출 (유전자 표적화).
- 꼬리 버퍼 (50 MM 트리스, 산도 = 8, 100 MM EDTA, 산도 = 8, 100 MM NaCl, 1 % SDS, 0.5 MG / ML proteinase K, 갓 추가)의 500 μL를 추가합니다.
- 55 ° C에서 밤새 품어 둡니다.
- 반전하여 5 분 동안 혼합하십시오 (vortex하지 마십시오).
- 포화 NaCl (6 M) 250 μL를 첨가하고 반전시켜 5 분 동안 혼합한다 (vortex하지 않는다).
- 12,000 xg 및 4 ° C에서 5-10 분 동안 스핀하고 상층 액을 새 튜브에 붓습니다.
- 500 μl의 이소프로판올을 첨가하고 반전시켜 5 분 동안 혼합한다 (볼텍트하지 마라).
- 12,000 xg 및 실온에서 10 분간 회전합니다.
- 상층 액을 따라 내고 (펠릿은 보이지 않고 튜브에 달라 붙는다).
- 70 % 에탄올 1 mL로 씻으십시오.
- 12,000 xg 및 실온에서 5-10 분 동안 스핀. 흰색 펠렛이 더 이상 끈적 거리지 않고 분실 될 수 있으므로 조심스럽게 상등액을 제거하십시오.
- 약 1 시간 동안 공기를 건조시킵니다.
- TE 버퍼 (10 MM 트리스와 1 MM EDTA, 산도 = 8)의 400 μL를 추가합니다.
- 2 시간 동안 55-60 ° C에서 DNA를 녹입니다.
- 프라이머 디자인.
- 전산 도구를 사용하여 최소 20bp의 프라이머를 디자인하십시오 19 .
참고 : 무작위 통합의 경우, 프라이머는 도입 유전자와 혼성화하여 200-800 bp의 분명한 단편을 생성해야합니다. 유전자 타겟팅의 경우 프라이머를 게놈 DNA와 혼성화되도록 디자인하여 뚜렷한 f잘라내는 사이트 주위에 백 백 bp를 분열. 큰 삽입의 경우, 프라이머는 도입 유전자 상에 놓일 수 있지만, 표적 통합의 확인은 프라이머 워킹 (primer walking) 또는 유사한 기술을 사용하여 수행되어야한다.
- 전산 도구를 사용하여 최소 20bp의 프라이머를 디자인하십시오 19 .
- PCR genotyping.
- 각 게놈 변형에 대해 새로운 PCR 프로토콜을 설계하고 경험적으로 테스트하십시오. 생성 된 단편의 길이와 각 쌍의 프라이머의 용융 온도 (Tm)를 고려하십시오.
- 시퀀싱.
- 유전자 타겟팅의 경우 PCR 제품을 생거 시퀀싱 서비스 제공 업체에 보내십시오.
Access restricted. Please log in or start a trial to view this content.
결과
아래에서, 무작위 통합 및 CRISPR 매개 유전자 타겟팅의 경우 microinjection에 대한 워크 플로우가 설명됩니다 ( 그림 1 ).
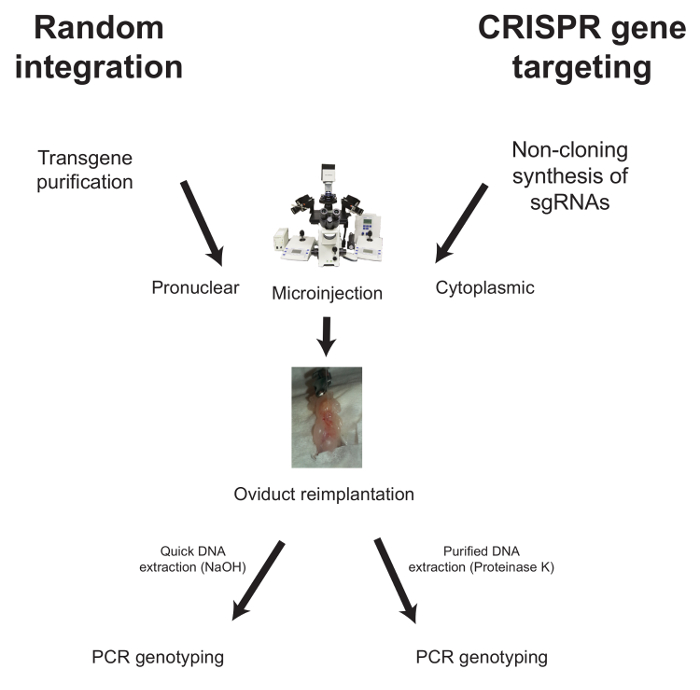
그림 1 : 유전자 조작 마우스의 일반적인 워크 플로. 무작위 적으로 통합하기 위해 정화 된 형질 도입 유?...
Access restricted. Please log in or start a trial to view this content.
토론
프로토콜 내 중요 단계
유전자 변형 마우스의 생성은 기술적으로 어려운 것으로 알려져 있습니다. 그러나 여기에 제시된 프로토콜은 기록적인 시간에 기술을 마스터하고 문제를 해결할 수 있도록 최적화되고 단순화 된 방법입니다. 이 기술을 성공적으로 완료하려면 두 단계가 필요합니다. 첫째, 염화 마그네슘 (MgCl 2 )없이 선형 DNA 템플릿 (sgRNA 합성 용)의 합성이 가능?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 University of New South Wales의 Mark Wainwright Analytical Center를 통해 마우스에서 학술적 전이 서비스를 제공합니다.
감사의 말
저자들은 지속적인 지원을 위해 동물 시설 (BRC) 직원에게 감사를드립니다. 이 작품은 국가 건강 및 의학 연구 협의회 (National Health and Medical Research Council)와 호주 연구위원회 (Australian Research Council)의 지원을 받았다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 μL | Eppendorf | 4920000016 | |
| Micropipette 2 - 20 μL | Eppendorf | 4920000040 | |
| Micropipette 20 - 200 μL | Eppendorf | 4920000067 | |
| Micropipette 100 - 1,000 μL | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1 kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
참고문헌
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. The Monk in the Garden. , Mariner books. (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- CRISPR DESIGN. , Available from: http://crispr.mit.edu (2017).
- Integrated DNA Technologies. Resuspension Calculator. , Available from: https://sg.idtdna.com/calc/resuspension/ (2017).
- BioTools at UMass Medical School. Primer3: WWW primer tool. , Available from: http://biotools.umassmed.edu/bioapps/primer3_www.cgi (2017).
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49(2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88(2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431(2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479(2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유