A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדור של עכברים השתנה גנטית דרך Microinjection של ביציות
In This Article
Summary
Microinjection של ביציות העכבר משמש בדרך כלל עבור transgenesis קלאסי ( כלומר, שילוב אקראי של transgenes) ו CRISPR בתיווך גישור המיקוד. פרוטוקול זה סוקר את ההתפתחויות האחרונות microinjection, עם דגש מיוחד על בקרת איכות אסטרטגיות genotyping.
Abstract
השימוש בעכברים מהונדסים גנטית תרם באופן משמעותי למחקרים על תהליכים פיזיולוגיים ופתולוגיים בתהליכי vivo . הזרקת pronuclear של ביטוי דנ"א בונה לתוך ביציות מופרות נשאר הטכניקה הנפוצה ביותר לייצר עכברים מהונדס overexpression. עם כניסתה של טכנולוגיית CRISPR עבור מיקוד גנים, הזרקת pronuclear לתוך ביציות מופרות הורחב לדור של שני נוקאאוט ועכברים נוקין. עבודה זו מתארת את הכנת ה- DNA להזרקה ואת הדור של מדריכים CRISPR עבור מיקוד גנים, עם דגש מיוחד על בקרת איכות. ההליכים הגנוטיפיים הדרושים לזיהוי המייסדים הפוטנציאליים הם קריטיים. אסטרטגיות גנוטיפינג חדשניות המנצלות את יכולות ה"רב-ריבוב "של CRISPR מוצגות כאן. הליכים כירורגיים מתוארים גם. יחד, השלבים של הפרוטוקול יאפשר את הדור של genעכברים מותאמים באופן מהותי עבור הקמתם הבאים של מושבות עכבר עבור שפע של תחומי מחקר, כולל אימונולוגיה, מדעי המוח, סרטן, פיזיולוגיה, פיתוח, ועוד.
Introduction
מודלים של בעלי חיים, הן בחולייתנים והן בחסרי חוליות, שימשו כלי עזר לבחינת הפתופיזיולוגיה של מצבים אנושיים כגון מחלת אלצהיימר 1 , 2 . הם גם כלים שלא יסולאו בפז כדי לחפש מחליפי מחלות ובסופו של דבר לפתח אסטרטגיות טיפול חדש בתקווה של תרופה. למרות שלכל מודל יש מגבלות פנימיות, השימוש בבעלי חיים כמודלים מערכתיים שלמים הוא חיוני למחקר ביו-רפואי. הסיבה לכך היא כי הסביבה הפיזיולוגית מטבולית ומורכבת לא ניתן לדמות לחלוטין בתרבית רקמות.
עד כה, העכבר נשאר המין היונקים הנפוצים ביותר המשמשים מניפולציה גנטית כי זה כולל מספר יתרונות. תהליכים פיזיולוגיים וגנים הקשורים למחלות הם שמורים מאוד בין עכברים ובני אדם. העכבר היה יונק הראשון יש רצף הגנום המלא שלה (2002), שנה אחת לפני geno האדםלי (2003). מלבד זה עושר של מידע גנטי, העכבר יש יכולות הרבייה טובה, מחזור פיתוח מהיר (6 שבועות מן ההפריה לגמילה), וגודל סביר. כל היתרונות הללו, בשילוב עם אינדיקטורים פיזיולוגיים, כגון צבעי מעיל נפרדים (נדרש לחצות אסטרטגיות), הפכו את העכבר למודל אטרקטיבי עבור מניפולציה גנטית. יש לציין, בגיל מוקדם מאוד של גנטיקה מודרנית, גרגור מנדל התחיל לעבוד על עכברים לפני המעבר צמחים 3 .
טכניקות העברת גנים גרמו לדור של העכבר המהונדס הראשון מעל לפני שלושה עשורים 4 , נוצר בתחילה באמצעות משלוח ויראלי. עם זאת, החוקרים הבינו עד מהרה כי אחד האתגרים העיקריים של transgenesis העכבר היה חוסר היכולת לשלוט על גורלו של ה- DNA אקסוגני. בגלל המסירה ויראלי של transgenes לתוך הביציות העכבר הביא עותקים מרובים משולבים באופן אקראי לתוך הגנום, possibilitY של הקמת קווים מהונדסים שלאחר מכן היה מוגבל.
מגבלה אחת כזו היתה להתגבר כאשר גורדון et al. שנוצר קו העכבר מהונדס הראשון על ידי microinjection 5 , 6 . זה התחיל את העידן של טכנולוגיית DNA רקומביננטי, ואת הפרמטרים המשפיעים על התוצאה של הפגישה microinjection נחקרו באופן נרחב 7 . למרות microinjection אינו מאפשר שליטה על אתר האינטגרציה של transgene (אשר בסופו של דבר תוצאות רמות ביטוי ספציפי עבור כל עכבר מייסד), היתרון העיקרי של microinjection pronuclear נשאר היווצרות של concatemers ( כלומר, מערכים של עותקים מרובים של transgene, מקושר בסדרה) לפני שילוב גנומי 5 . מאפיין זה שימש במשך השנים להקים אלפי שורות עכבר מהונדס כי overexpress גן עניין. מאז, transgenesis, אשינוי מלאכותי של הגנום של האורגניזם, נעשה שימוש נרחב כדי לזהות את התפקיד של גנים בודדים בהתרחשות של מחלות.
הישג מפתח נוסף על מניפולציה של הגנום העכבר הגיע כאשר מריו Capecchi בהצלחה שיבשו גן אחד בעכבר, פתיחת עידן של הגן מיקוד 8 . עם זאת, החסרונות העיקריים שהגיחו במהירות ממיקוד גנים המבוסס על תאי גזע ES, כולל האתגרים של תאי ES מתורבתים, מידת השתנות מסוימת של קימברליות ואורך התהליך ( כלומר, 12-18 חודשים, מינימום, כדי להשיג את העכבר) .
לאחרונה, ההתקדמות בטכנולוגיות חדשות, כגון אנדונואלאסים מהונדסים ( למשל, נוקלאזות אצבע אבץ (ZFN), גרעיני אפקט מניע כמו activator (TALEN), וקבוצות חוזרות ונשנות של פליינדרומיס מקובצים בקביעות (CRISPR / Cas9) התפתחו כשיטות חלופיות להאיץ את תהליך המיקוד הגנטי ב- micE 9 , 10 . אלה endonucleases יכול בקלות להיות מוזרק לתוך ביציות העכבר על ידי microinjection, המאפשר לדור של עכברים ממוקד תוך פחות מ 6 שבועות.
מאז הדו"ח הראשון על השימוש CRISPR עבור עריכת הגנום 11 , מערכת חיסונית חיידקית אדפטיבית זו החליפה ZFN ו TALEN בשל היתרונות הרבים שלה, כולל את הקלות של סינתזה ואת היכולת למקד לוקוסים מרובים בבת אחת (המכונה "ריבוב" "). CRISPR שימש לראשונה עבור מיקוד גנים בעכברים 12 ומאז הוחל על מינים אינספור, מן הצמחים לבני אדם 13 , 14 . עד כה, אין דיווח על מין אחד עמיד לעריכת הגנום CRISPR.
שני השלבים המגבילים העיקריים של הדור של עכברים מהונדסים הם הזרקה של ביציות ואת ההשתלה מחדששל הביציות האלה לתוך נקבות מדומות בהיריון. למרות טכניקה זו תוארה על ידינו 15 ועוד 16 , שיפורים טכניים האחרונות עכבר embryology וטכניקות העברת הגן יש מהפכה בתהליך של יצירת עכברים מהונדסים גנטית. שיפורים אלה יתוארו כאן.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים אושרו על ידי אוניברסיטת ניו סאות 'ויילס טיפול בבעלי חיים ואתיקה הוועדה.
1. הכנת הטרנסג'ן (אינטגרציה אקראית)
- ג 'ל אלקטרופורזה אקרוטית אנליטית.
- לעכל את הפלסמיד כדי לסתום את transgene באמצעות אנזימים המתאימים (דגירה 1 שעה) או אנזים מהיר digest (15 עד 30 דקות הדגירה) ב thermocycler בעקבות המלצות היצרן (ראה איור 2 א ואת האגדה שלה).
- משתתפות 1% tris- אצטט-ethylenediaminetetraacetic חומצה (EDTA) (תה) agarose ג'ל, מוכתם 0.5-1.0 מיקרוגרם / מ"ל אתיד ברומיד (EtBr).
הערה: יש לנקוט משנה זהירות בעת השימוש ב- EtBr; זה mutagen עוצמה. השתמש בציוד מגן אישי מתאים (עיין בגיליון נתוני בטיחות החומר). - טען 1 קילו סמן משקל מולקולרי.
- טען את שברי linearized ( כלומר, transgene ואת עמוד השדרה). הפעל את אלקטרופורזה ב 100 V במשך 45 דקות.
- דמיינו את הג'ל על transilluminator אולטרה סגול (UV) כדי לבדוק כי העיכול הושלמה לאשר את הגודל הנכון של transgene ( כלומר, 7,338 bp, ראה איור 2 א ).
- ג 'ל אלקטרופורזה agarose מתכונן.
- משתתפות 1% TAE agarose ג'ל מוכתם בכתם ג'ל רעילות נמוכה. טען 8 aliquots (1 מיקרוגרם כל) של transgene לינארית ללא סמן משקל מולקולרי ולהפעיל אלקטרופורזה ב 100 V במשך 45 דקות. השתמש באזמל כדי לסתום את כל 8 להקות המתאים transgene לינארית.
- חלץ את ה- DNA באמצעות ערכת מיצוי ג'ל על ידי ביצוע המלצות היצרן (ראה טבלה של חומרים ).
- ממיסים את שברי ג'ל ב 50 מעלות צלזיוס צינורות 1.5 מ"ל לפחות 15 דקות. להאיץ אותו עם isopropanol ולאחר מכן להוסיף את המאגר מחייב.
- שלב את כל DNA על ידי pipetting הכל לתוך עמודה אחת. Elute למאגר noclease ללא חיץ microinjection (8 מ"מ Tris-HCl ו 0.15 מ"מ EDTA). מסנן דרך מסנן microcentrifuge מיקרומטר 0.22 ו צנטריפוגה עבור 60 s ב 12,000 x גרם.
- למדוד את הריכוז ואת האיכות של ה- DNA באמצעות ספקטרופוטומטר. בדוק כי היחס A260 / A280 הוא סביב 1.8 ( כלומר, ללא זיהום על ידי חלבונים) ואת יחס A260 / A230 הוא לפחות 2.0 ( כלומר, לא זיהום על ידי ממיסים אורגניים). לדלל עד 3 ng / μL ב nuclease ללא חיץ microinjection חינם, aliquot (20-50 μL), להקפיא ב -20 מעלות צלזיוס.
2. סינתזה של רכיבי CRISPR (מיקוד גנטי)
- Cas9 mRNA.
- לדלל את mRNA Cas9 (המתקבל ממקור מסחרי, ראה טבלה של חומרים ) לריכוז של 1 מיקרוגרם / μL במאגר microinjection חינם nuclease.
- Aliquot ב 2 μL ללא תשלום Ze ב -80 ° C.
- מדריך יחיד RNA (SgRNA).
- זהה את הרצף הגנמי הרצוי של שני היעדים (מדריכי) באמצעות כלי תכנון חישובי המאפשר פעילות מינימלית של פעילות לא ממוצעת 17 .
- עבור נוק אאוט גן, בחר שיטתי שני מדריכים הממוקם כמה מאות זוגות (bp) בנפרד, בכיוונים מנוגדים, וכוללים את קודון ההתחלה של הגן של עניין. עבור תיקון ישיר הומולוגיה, בחר שני מדריכים חופפים (בכל הזדמנות אפשרית), בכיוונים מנוגדים.
הערה: כדוגמה, לאחרונה המדריכים הבאים בהצלחה משותפת מוזרק כדי לשבש את האקסון הראשון של הגן TPM4.2 :
מדריך 1: 5 'CGCCATCCAGTTCGCGCTGC 3';
מדריך 2: 5 'CAGAACGATTGAGCTATGGC 3'
- עבור נוק אאוט גן, בחר שיטתי שני מדריכים הממוקם כמה מאות זוגות (bp) בנפרד, בכיוונים מנוגדים, וכוללים את קודון ההתחלה של הגן של עניין. עבור תיקון ישיר הומולוגיה, בחר שני מדריכים חופפים (בכל הזדמנות אפשרית), בכיוונים מנוגדים.
- להזמין סט של פריימרים כמתואר בטבלה 1 .
- לסנתז תבנית DNA לינארית.
- מדולל px330Ref "> 12 פלסמיד עד 10 ng / μL במים nuclease ללא.
- הכינו את התמהיל הראשי כפי שצוין בטבלה 1 . מוסיפים את הפולימראז בסוף ולשמור את התמהיל הראשי על הקרח.
- מערבבים ו לפצל את זה לתוך 8 צינורות PCR (19 μL / צינור). הוסף 1 μL של px330 לכל צינור ולהפעיל את ה- PCR בתנאים הבאים: 1 דקות ב 98 מעלות צלזיוס; 40 מחזורים של 98 מעלות צלזיוס למשך 10 שניות, 64 מעלות צלזיוס למשך 30 שניות, ו- 72 מעלות צלזיוס למשך 15 שניות; ו התארכות הסופי ב 72 מעלות צלזיוס במשך 5 דקות. החזק ב 4 ° C.
- לטהר את מוצרי ה- PCR באמצעות ערכת טיהור PCR (ראה טבלה של חומרים ), סעפת, ומקור ואקום (לעיבוד מהיר יותר). החל את כוח ואקום מקסימלי ( כלומר, 8 mbar).
- הוסף 5 כרכים (100 μL) של חיץ מחייב נפח 1 של המדגם PCR ומערבבים.
- מניחים (מסופקת) סיליקה הממברנה ספין טור ב (מסופקים) 2-מ"ל צינור אוסף צנטריפוגה, או על סעפת לתהליך ואקום. כדי לקשור DNA, להחיל ברציפות את כל 8 דגימות לעמודה ואקום או צנטריפוגה עבור 60 s ב 12,000 XG עבור כל העומס.
- כדי לשטוף, להוסיף 0.75 מ"ל של חיץ לשטוף (חיץ PE) לעמודה ואקום או צנטריפוגה עבור 60 s ב 12,000 x גרם. צנטריפוגה טור עבור 60 s ב XG 12,000 לחסל אתנול שיורית.
- מניחים את העמודה צינור נקי 1.5 מ"ל microcentrifuge. כדי elute הדנ"א, להוסיף 30 μL של מים nuclease חינם למרכז הממברנה, לתת לעמוד לעמוד 1 דקות, צנטריפוגות עבור 60 ים ב 12,000 גרם.
- למדוד את הריכוז באמצעות ספקטרופוטומטר; בדרך כלל, הריכוז צריך להיות 100 ng / μL או גבוה יותר. בדוק כי היחס A260 / A280 הוא סביב 1.8 ( כלומר, ללא זיהום על ידי חלבונים) ואת יחס A260 / A230 הוא לפחות 2.0 ( כלומר, לא זיהום על ידי ממיסים אורגניים).
- שעתוק במבחנה באמצעות ערכת T7 RNA סינתזה.
- הכן את tהוא תערובת הורים, כפי שצוין בטבלה 1 , ו דגירה במשך 3 שעות ב 37 מעלות צלזיוס ב thermocycler. הוסף 28 μL של מים ללא nuclease ו 2 μL של DNase אני ו דגירה עוד 15 דקות ב 37 מעלות צלזיוס thermocycler.
- טיהור RNA באמצעות עמודות ספין.
- ממיסים את אבקת הכלול בעמודה הספין בתנאי μL 650 של חיץ microocjection nuclease ללא חינם, להסיר בזהירות את כל בועות אוויר. מכסה את הצינור ואת מימה במשך 5 - 15 דקות בטמפרטורת החדר.
- הסר את הכובע הכחול בתחתית ומקום את העמודה בצינור 2 מ"ל. צנטריפוגה עבור 2 דקות ב 750 xg וטמפרטורת החדר. מניחים את הטור בצינור 1.5 מ"ל טרי ולהחיל 50 μL של הפתרון RNA dropwise למרכז, בלי לגעת בקיר העמודה. ספין את הטור עבור 2 דקות ב 750 x גרם.
- למדוד את ריכוז RNA באמצעות ספקטרופוטומטר (התשואה האופיינית של תגובה אחת היא 30 - 50 מיקרוגרם). בדוק כי היחס A260 / A280 הואסיבוב 2.0 ( כלומר, ללא זיהום על ידי חלבונים) ויחס A260 / A230 הוא לפחות 2.0 ( כלומר, לא זיהום על ידי ממיסים אורגניים). חנות sgRNAs ב -80 מעלות צלזיוס עד לשימוש.
- להעריך את האיכות של ה- RNA באמצעות 1% ג'ל TAE המשמש באופן שגרתי עבור אלקטרופורזה DNA. הפעל 200-400 ng של תבנית ה- DNA ואת המקביל sgRNA במקביל. הלהקה RNA (≈ 100 נ"ב) צריך להיות קצת יותר גדול הלהקה דנ"א (ראה איור 3 א ).
- זהה את הרצף הגנמי הרצוי של שני היעדים (מדריכי) באמצעות כלי תכנון חישובי המאפשר פעילות מינימלית של פעילות לא ממוצעת 17 .
3. תבנית התורם
- להזמין מסונתז יחיד oligonucleotides מסוממת (ssOligos, לראות את לוח החומרים ) עבור מוטציות נקודה או שילוב של רצפים קטנים עד 50 BP; זרועות הומולוגיה הם בדרך כלל 60-90 bp ארוך.
- עבור החדירות גדול, להשתמש פלסמיד התורם כתבנית. יצירת פלסמיד מתאים באמצעות או בשיטת שיבוט קלאסי או סינתזה דה novo ממקור מסחרי.
הערה: מומלץ מינימום של 800 bp לכל זרוע הומולוגיה. גודל עמוד השדרה אין השפעה על היעילות של תיקון ישיר הומולוגיה (HDR).
4. תערובת הזרקת
- לדלל את mRNA Cas9 ל 50 ng / μL ו sgRNAs ל 12.5 ng / μL (25 ng / μL בסך הכל) באמצעות חיץ noclease ללא microinjection עבור ניסויים גנום knockout. הוסף את התבנית התורם (ssOligo או פלסמיד) בריכוז של 200 ng / μL עבור ניסויים עריכת הגנום מבוסס על תיקון ישיר הומולוגיה.
הערה: אמצעי אחסון דילול ניתן לקבוע בקלות באמצעות כלים מקוונים, כגון מחשבון resuspension 18 . - שמור על כל aliquot על הקרח במהלך הפגישה microinjection וזורקים לאחר מכן (לא להקפיא מחדש את תערובת ההזרקה).
5. כריתת כיס מרה
הערה: שני סוגים של vasectomy מבוצעות בדרך כלל בעכברים: בטן ו scrotal. האחרוןהוא פחות פולשני ותואר לעיל 15 .
- החיטוי כל כלי כירורגי נירוסטה.
- קביעת משקל העכבר באמצעות סולם לשקול להרדים את הזכרים על ידי הזרקת intraperitoneal (IP) עם הרדמה הזרקת (קטמין 100 מ"ג / ק"ג, xylazine 10 מ"ג / ק"ג).
- צג את ההפסד של רפרפת קמצוץ הבוהן ופעם העכבר הוא מסומם במקום זה על גבי כרית חימום.
- לחטא את העור סביב האשכים עם מגבונים לסירוגין של חיטוי מקומי כגון chlorhexidine ו 70% אתנול.
- לדחוף את האשכים לתוך שק האשכים ולעשות חתך בעור עם אזמל.
- דמיינו את המבחן, את האפידידימיס, ואת הכאב.
- תפוס את VAS דפרנס עם מלקחיים, להחזיק אותו, לצרוב על כל צד של מלקחיים כדי להסיר 3 מ"מ של דחיית ואס.
- בצע את אותו הליך על testis השני.
- סגור את החתכים בעור עם קליפים הפצע ולעקוב אחרהעכבר מקרוב עד התאוששות מלאה.
6. Superovulation (ביציות התורמים) ו-הזדווגות זמן (פסאודו בהריון נקבות)
הערה: הטכניקה לייצר מספר מתאים של ביציות מופרות ו נקשר נקבה נקבות עבור השתלה תוארה במקום אחר 15 .
- להזריק 10 נקבות IP עם 5 IU של gonadotropin של סוסה בהריון של סוסה (PMSG; ב 100 μL) בסביבות השעה 12:00 ביום 1.
- להזריק את הנקבות IP עם 5 IU של גונדוטרופין כוריוני האדם (hCG, ב 100 μL) 46-48 שעות מאוחר יותר (בסביבות 11:00 בבוקר ביום 3).
- מיד להזדווג את הנקבות עם זכר אחד שוכנו בן לילה.
7. Pronuclear (אקראי שילוב) ו cytoplasmic (Gene- מיקוד) הזרקות
- לסלק את עכברים superovulated ידי נקע בצוואר הרחם, לחשוף את הבטן, לגשת השחלות oviducts, כפי שתואר לעיל 15 . לנתח את oViducts ומסיק את קומולוס, ביציות, מתחמי (COCs) תחת stereomicorscope 15 . מניחים אותם ירידה של אשלגן סימפלקס אופטימיזציה בינוני בינוני עם חומצות אמינו (KSOMaa) בעקבות השיטה המסורתית 15 .
- לטהר את הביציות על ידי הוספת 1 μL בקירוב של hyaluronidase (10 מ"ג / מ"ל) לירידה של מדיום KSOMaa באמצעות חתיכת פה אספירטור ומניחים את המנה ב 37 מעלות צלזיוס / 5% CO 2 חממה למשך 30 שניות עד 1 דקות.
- לשטוף את הביציות עם 4 טיפות טריות של מדיום KSOMaa באמצעות חתיכת הפה aspirator ולהעביר אותם לירידה הסופית של KSOMaa בינוני עם שמן מינרלי (סביב 2 מ"ל). מניחים את המנה ב 37 ° C / 5% CO 2 באינקובטור עד הביציות מוכנים להזרקת.
- הזרקה פרו - גרעינית (אינטגרציה אקראית).
- לדמיין את הביצים תחת מיקרוסקופ stereoscopic ולהעביר כ 50 ביצים לתא ההזרקה (א droP של בינוני M2 עם שמן מינרלי) באמצעות חתיכת הפה aspirator.
- מעבירים את החדר ההזרקה למיקרוסקופ הפוכה להזריק את הביציות מופרות (שני pronuclei גלוי) עם כמה picoliters של תערובת ההזרקה, מיקוד pronucleus (כל pronuclei יכול להיות ממוקד). דמיינו הזרקת מוצלח על ידי התבוננות בנפיחות של פרונוקליוס.
- הזרקת ציטופלסמה (מיקוד גנטי).
- העברת כ 50 ביצים לירידה של KSOMaa המכיל 5 מיקרוגרם / מ"ל Cytochalasin B באמצעות חתיכת הפה דגירה של 5 דקות ב 37 ° C / 5% CO 2 חממה.
- מעבירים את הביצים לחדר הזריקה באמצעות פיסת הפה.
- להזריק כמה picoliters של תערובת ההזרקה לתוך הציטופלסמה בלחץ נמוך מאוד (50-100 hPa), באמצעות לחץ פיצוי של microinjector אוטומטית היכן שניתן.
- לאחר ההזרקה, להעביר את הביציות בחזרה לתוך ירידה של KSOMaa (באמצעות פיסת הפה) ולשמור אותם 37 ° C / 5% CO 2 חממה, עד טעון להשתלה לתוך אובידוקט של נשים פסאודו בהריון.
8. השתלה
- החיטוי כל כלי כירורגי נירוסטה.
- לקבוע את המשקל של העכבר באמצעות סולם לשקול להרדים את הנקבות על ידי הזרקת intraperitoneal (IP) עם הרדמה הזרקת (קטמין 100 מ"ג / ק"ג, xylazine 10 מ"ג / ק"ג).
- צג את ההפסד של רפרפת קמצוץ הבוהן ופעם העכבר הוא מסומם במקום זה על גבי כרית חימום.
- קליפ שטח גדול של הפרווה סביב קו האמצע הגבי של העכבר הנשי.
- לחטא את העור חשוף עם מגבונים לסירוגין של חיטוי מקומי כגון chlorhexidine ו 70% אתנול.
- לחשוף את דרכי הרבייה בשיטה המסורתית 15 . הפוך 1 ס"מ ארוך חתך העור במקביל לקו האמצע הגב, לחתוך את השרירים לתפוס את כרית שומן wiמ מלקחיים, ולאחר מכן בעדינות למשוך את השחלה החוצה עד oviduct שלה מחובר הרחם נראים בבירור.
- תקן את כרית שומן עם מהדק כלי. דמיינו את oviduct תחת מיקרוסקופ stereoscopic ושימוש זוג מיקרו מספריים לעשות חתך לתוך הקיר של אובידוק כמה מילימטרים במעלה הזרם של ampulla.
- תחת מיקרוסקופ stereoscopic, לטעון 25 ביצים microinjected לתוך הזכוכית נימי מחובר פיסת הפה (הקוטר הפנימי של נימי צריך להיות סביב 120 מיקרומטר רחב). הציגו את הזכוכית נימי לתוך oviduct ו לגרש עד בועה אוויר גלוי בתוך ampulla.
- הסר בעדינות את נימי הזכוכית והנח את דרכי הרבייה בחזרה אל הבטן. תפר את החתך עם sutures 3-0 שאינם ניתוחים absorbable, ולאחר מכן לסגור עם קליפים הפצע. לפקח על העכבר מקרוב עד להחלמה מלאה.
9. גנוטיפינג אסטרטגיות / רצף
הערה: לבודד את הגנוםDNA מ 2 מ"מ זנב או ביופסיות אוזניים, בעקבות תקנות אתיקה בעלי חיים רלוונטיים.
- מיצוי דנ"א מהיר (שילוב אקראי).
- Lyse דגימות רקמות (~ 2 מ"מ) ב 95 מעלות צלזיוס למשך 1 שעות μL 100 של מגיב תמוגה אלקליין (25 מ"מ נתרן hydroxide ו 0.2 מ"מ EDTA, pH = 12).
- הוסף 100 μL של מגיב ניטרול (40 מ"מ Tris-HCl, pH = 5).
- צנטריפוגה 5 דקות ב 12,000 גרם ו 4 ° C.
- מיצוי דנ"א באיכות גבוהה (מיקוד גנטי).
- הוספת 500 μL של חיץ זנב (50 מ"מ טריס, pH = 8, 100 מ"מ EDTA, pH = 8, 100 מ"מ NaCl, 1% SDS, ו 0.5 mg / מ"ל proteinase K, נוספה טרי).
- דגירה לילה ב 55 מעלות צלזיוס.
- מערבבים במשך 5 דקות על ידי היפוך (לא מערבולת).
- הוסף 250 μL של NaCl רווי (6 M) ומערבבים במשך 5 דקות על ידי היפוך (לא מערבולת).
- ספין עבור 5-10 דקות ב 12,000 XG ו 4 ° C ויוצקים את supernatant לתוך צינור חדש. הוסף 500 μL של isopropanol ומערבבים במשך 5 דקות על ידי היפוך (לא מערבולת).
- ספין במשך 10 דקות ב 12,000 xg וטמפרטורת החדר.
- ממלאים את supernatant (גלולה הוא בלתי נראה ומקלות על הצינור).
- לשטוף עם 1 מ"ל של אתנול 70%.
- ספין עבור 5-10 דקות ב 12,000 xg וטמפרטורת החדר. הסר את supernatant עם טיפול, כמו גלולה לבן הוא לא דביק עוד יכול להיות אבוד.
- אוויר זה יבש עבור ~ 1 ח.
- הוסף 400 μL של חיץ TE (10 מ"מ טריס ו 1 מ"מ EDTA, pH = 8).
- ממיסים את ה- DNA ב 55-60 מעלות צלזיוס למשך 2 שעות.
- עיצוב פריימר.
- עיצוב primers מינימום של 20 bp ארוך באמצעות כלי חישובי 19 .
הערה: עבור אינטגרציה אקראית, primers צריך הכלאה עם transgene, יצירת שבר ברור של 200-800 bp. עבור מיקוד גנטי, עיצוב primers כך שהם הכלאה עם ה- DNA הגנומי, יצירת f נפרדRagment כמה מאות BP סביב האתרים לחתוך. עבור החדירות הגדולות, primers יכול לשבת על transgene, אבל אישור של אינטגרציה ממוקד לאחר מכן צריך להתבצע באמצעות הליכה פריימר או טכניקה דומה.
- עיצוב primers מינימום של 20 bp ארוך באמצעות כלי חישובי 19 .
- PCR גנוטיפינג.
- עבור כל שינוי גנומי, עיצוב פרוטוקול PCR חדש ולבדוק אותו באופן אמפירי. שקול את אורך השבר שנוצר ואת טמפרטורת ההיתוך (Tm) של כל זוג primers.
- סידור.
- עבור מיקוד גנים, שלח מוצרי PCR לספק שירות של סידור רצף.
Access restricted. Please log in or start a trial to view this content.
תוצאות
להלן, זרימות עבודה עבור microinjection במקרה של אינטגרציה אקראית CRISPR בתיווך גנים מיקוד מתוארים ( איור 1 ).
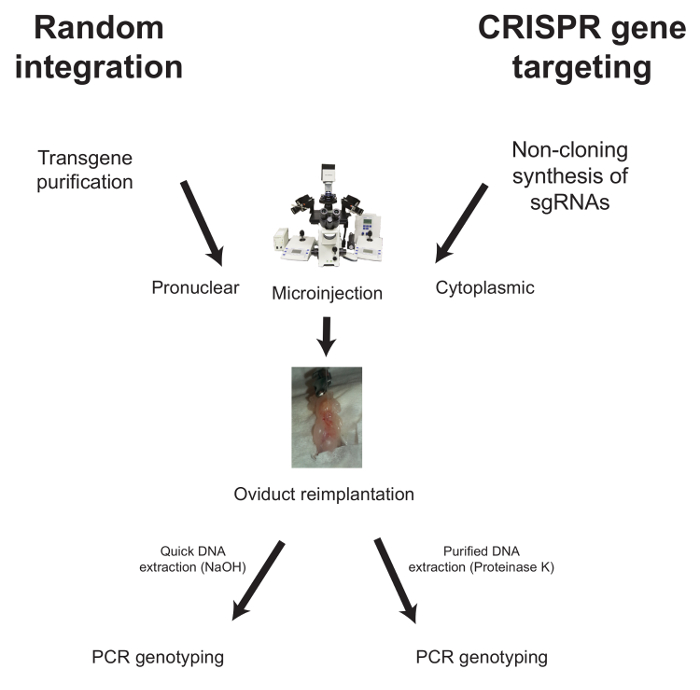
איור 1: זרימת עבודה אופי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
צעדים קריטיים בתוך הפרוטוקול
הדור של עכברים מהונדסים גנטית ידוע להיות מאתגר מבחינה טכנית. עם זאת, הפרוטוקול המוצג כאן היא שיטה אופטימיזציה ופשוט המאפשר אחד לשלוט ולפתור את הטכניקה בזמן שיא. ישנם שני שלבים הכרחיים להשלמת הטכניקה ב?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מספקים שירותי transgenesis אקדמי בעכברים באמצעות אוניברסיטת ניו סאות 'ויילס מארק ויינרייט אנליטית מרכז.
Acknowledgements
המחברים מודים לצוות של מתקן החיות (BRC) על תמיכתם המתמשכת. עבודה זו מומנה על ידי המועצה הלאומית למחקר רפואי רפואי ומועצת המחקר האוסטרלית.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Micropipette 0.1-2.5 μL | Eppendorf | 4920000016 | |
| Micropipette 2 - 20 μL | Eppendorf | 4920000040 | |
| Micropipette 20 - 200 μL | Eppendorf | 4920000067 | |
| Micropipette 100 - 1,000 μL | Eppendorf | 4920000083 | |
| Molecular weight marker | Bioline | BIO-33025 | HyperLadder 1 kb |
| Molecular weight marker | Bioline | BIO-33056 | HyperLadder 100 bp |
| Agarose | Bioline | BIO-41025 | |
| EDTA buffer | Sigma-Aldrich | 93296 | 10x - Dilute to 1x |
| Ethidium bromide | Thermo Fisher Scientific | 15585011 | |
| SYBR Safe gel stain | Invitrogen | S33102 | |
| Gel extraction kit | Qiagen | 28706 | |
| PCR purification kit (Qiaquick) | Qiagen | 28106 | |
| Vacuum system (Manifold) | Promega | A7231 | |
| Nuclease-free microinjection buffer | Millipore | MR-095-10F | |
| Ultrafree-MC microcentrifuge filter | Millipore | UFC30GV00 | |
| Cas9 mRNA | Sigma-Aldrich | CAS9MRNA | |
| CRISPR expressing plasmid (px330) | Addgene | 42230 | |
| Nuclease free water | Sigma-Aldrich | W4502 | |
| Phusion polymerase | New England Biolabs | M0530L | |
| T7 Quick High Yield RNA kit | New England Biolabs | E2050S | |
| RNA purification spin columns (NucAway) | Thermo Fisher Scientific | AM10070 | |
| ssOligos | Sigma-Aldrich | OLIGO STANDARD | |
| Donor plasmid | Thermo Fisher Scientific | GeneArt | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| KSOMaa embryo culture medium | Zenith Biotech | ZEKS-100 | |
| Mineral oil | Zenith Biotech | ZSCO-100 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Mouthpiece | Sigma-Aldrich | A5177 | |
| Glass microcapillaries | Sutter Instrument | BF100-78-10 | |
| Proteinase K | Applichem | A3830.0100 | |
| Dumont #5 forceps | Fine Science Tools | 91150-20 | |
| Iris scissors | Fine Science Tools | 91460-11 | |
| Vessel clamp | Fine Science Tools | 18374-43 | |
| Wound clips | Fine Science Tools | 12040-01 | |
| Clips applier | Fine Science Tools | 12018-12 | |
| Micro-scissors | Fine Science Tools | 15000-03 | |
| Cauterizer | Fine Science Tools | 18000-00 | |
| Non-absorbable surgical sutures (Ethilon 3-0) | Ethicon | 1691H | |
| 5% CO2 incubator | MG Scientific | Galaxy 14S | |
| Spectrophotometer | Thermo Fisher Scientific | Nanodrop 2000c | |
| Thermocycler | Eppendorf | 6321 000.515 | |
| Electrophoresis set up | BioRad | 1640300 | |
| UV Transilluminator | BioRad | 1708110EDU | |
| Thermocycler | Eppendorf | 6334000069 | |
| Stereoscopic microscope | Olympus | SZX7 | |
| Inverted microscope | Olympus | IX71 | |
| 2x Micromanipulators | Eppendorf | 5188000.012 | |
| Oocytes manipulator | Eppendorf | 5176000.025 | |
| Microinjector (Femtojet) | Eppendorf | 5247000.013 | |
| Mice C57BL/6J strain | Australian BioResources | C57BL/6JAusb |
References
- Ittner, L. M. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell. 142 (3), 387-397 (2010).
- Ittner, A. Site-specific phosphorylation of tau inhibits amyloid-beta toxicity in Alzheimer's mice. Science. 354 (6314), 904-908 (2016).
- Marantz Henig, R. The Monk in the Garden. , Mariner books. (2000).
- Jaenisch, R., Mintz, B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 71 (4), 1250-1254 (1974).
- Gordon, J. W., Ruddle, F. H. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 214 (4526), 1244-1246 (1981).
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proc Natl Acad Sci U S A. 77 (12), 7380-7384 (1980).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Yagle, M. K., Palmiter, R. D. Factors affecting the efficiency of introducing foreign DNA into mice by microinjecting eggs. Proc Natl Acad Sci U S A. 82 (13), 4438-4442 (1985).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6 (6), 507-512 (2005).
- Carbery, I. D. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186 (2), 451-459 (2010).
- Sung, Y. H. Knockout mice created by TALEN-mediated gene targeting. Nat Biotechnol. 31 (1), 23-24 (2013).
- Jinek, M. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kang, X. Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. J Assist Reprod Genet. 33 (5), 581-588 (2016).
- Liang, P. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6 (5), 363-372 (2015).
- Ittner, L. M., Götz, J. Pronuclear injection for the production of transgenic mice. Nat Protoc. 2 (5), 1206-1215 (2007).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9 (8), 1956-1968 (2014).
- CRISPR DESIGN. , Available from: http://crispr.mit.edu (2017).
- Integrated DNA Technologies. Resuspension Calculator. , Available from: https://sg.idtdna.com/calc/resuspension/ (2017).
- BioTools at UMass Medical School. Primer3: WWW primer tool. , Available from: http://biotools.umassmed.edu/bioapps/primer3_www.cgi (2017).
- Auerbach, A. B. Strain-dependent differences in the efficiency of transgenic mouse production. Transgenic Res. 12 (1), 59-69 (2003).
- Merriman, J. A., Jennings, P. C., McLaughlin, E. A., Jones, K. T. Effect of aging on superovulation efficiency, aneuploidy rates, and sister chromatid cohesion in mice aged up to 15 months. Biol Reprod. 86 (2), 49(2012).
- Nakagawa, Y., et al. Ultra-superovulation for the CRISPR-Cas9-mediated production of gene-knockout, single-amino-acid-substituted, and floxed mice. Biol Open. 5 (8), 1142-1148 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538(2012).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J Endocrinol. 13 (4), 399-404 (1956).
- Ye, S., Dhillon, S., Ke, X., Collins, A. R., Day, I. N. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res. 29 (17), E88(2001).
- Yoshimi, K., et al. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes. Nat Commun. 7, 10431(2016).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. , (2016).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21, 70-71 (1999).
- Liu, X., et al. A targeted mutation at the known collagenase cleavage site in mouse type I collagen impairs tissue remodeling. J Cell Biol. 130 (1), 227-237 (1995).
- Ke, Y. D. Short-term suppression of A315T mutant human TDP-43 expression improves functional deficits in a novel inducible transgenic mouse model of FTLD-TDP and ALS. Acta Neuropathol. 130 (5), 661-678 (2015).
- Auerbach, A. B. Production of functional transgenic mice by DNA pronuclear microinjection. Acta Biochim Pol. 51 (1), 9-31 (2004).
- Iyer, V., et al. Off-target mutations are rare in Cas9-modified mice. Nat Methods. 12 (6), 479(2015).
- Zhou, Y. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Brinster, R. L., Chen, H. Y., Trumbauer, M. E., Avarbock, M. R. Translation of globin messenger RNA by the mouse ovum. Nature. 283 (5746), 499-501 (1980).
- Pinkert, C. A., Irwin, M. H., Johnson, L. W., Moffatt, R. J. Mitochondria transfer into mouse ova by microinjection. Transgenic Res. 6 (6), 379-383 (1997).
- Biggers, J. D., Summers, M. C. Choosing a culture medium: making informed choices. Fertil Steril. 90 (3), 473-483 (2008).
- Nakagata, N. Embryo transfer through the wall of the fallopian tube in mice. Jikken Dobutsu. 41 (3), 387-388 (1992).
- Truett, G. E. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29 (1), 52-54 (2000).
- Richardson, C. D., Ray, G., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat Biotechnol. 34 (3), 339-344 (2016).
- Delerue, F., Ittner, L. M. Genome Editing in Mice Using CRISPR/Cas9: Achievements and Prospects. Clon. Transgen. 4, (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved