A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام جهاز ميكروفلويديكس لتحفيز الميكانيكية وتصوير قرار عالية من C. ايليجانس
* These authors contributed equally
In This Article
Summary
أدوات جديدة للبحوث ميتشانوبيولوجي هناك حاجة لفهم كيف الميكانيكية الإجهاد ينشط المسارات البيوكيميائية ويتسبب الاستجابات البيولوجية. هنا، نحن عرض طريقة جديدة لتحفيز الميكانيكية الانتقائي للحيوانات المعطل تداولها مع فخ موائع جزيئية السماح بتصوير عالي الدقة من الاستجابات الخلوية.
Abstract
هدف مركزي واحد من ميتشانوبيولوجي فهم متبادل أثر الإجهاد الميكانيكي على البروتينات والخلايا. على الرغم من أهميته، هو ما زالت غير مفهومة تأثير الإجهاد الميكانيكي على وظيفة الخلوية. في جزء منه، وجود هذه الفجوة في المعرفة نظراً لعدد قليل من أدوات تمكين تشوه المتزامن للأنسجة والخلايا، وتصوير الأنشطة الخلوية في الحيوانات الحية، وكفاءة تقييد الحركة في الكائنات نموذج خلاف كثيري التنقل، مثل ديدان أسطوانية ايليجانس كاينورهابديتيس. صغر حجم C. ايليجانس يجعلها مباراة ممتازة للأجهزة المستندة إلى ميكروفلويديكس للبحث، وقد عرضت حلولاً للتثبيت باستخدام أجهزة موائع جزيئية. على الرغم من أن هذه الأجهزة تسمح لتصوير عالي الدقة، هو المغطى الحيوان كاملا في بولي دايمثيل سيلوكسان (PDMS)، والزجاج، ويحد من الوصول الفعلي لتسليم القوة الميكانيكية أو التسجيلات الكهربية. في الآونة الأخيرة، قمنا بإنشاء جهاز يدمج المحركات الهوائية مع تصميم ملائمة متوافق مع الفحص المجهري الفلورية ذات الدقة العالية. قناة يشتغل مفصولة من القناة الملائمة دودة غشاء PDMS رقيقة. هو نحيد هذا الحاجز إلى الجانب من دودة بتطبيق ضغط من مصدر خارجي. الجهاز يمكن استهداف الخلايا العصبية ميتشانوسينسيتيفي الفردية. تنشيط هذه الخلايا العصبية يتم تصويرها في الاستبانة مع مؤشرات الكالسيوم المرمزة وراثيا. تقدم هذه المقالة طريقة عامة استخدام سلالات C. ايليجانس معربا عن مؤشر النشاط المراعية للكالسيوم (GCaMP6s) في هذه الخلايا العصبية مستقبلات اللمس (ترنس). ومع ذلك، الأسلوب، لا يقتصر ترنس ولا أجهزة استشعار الكالسيوم كتحقيق، بل يمكن توسيعها للخلايا الحساسة ميكانيكيا أو أجهزة استشعار أخرى.
Introduction
حاسة اللمس توفر الحيوانات مع معلومات حاسمة عن بيئتهم. ويعتبر اللمس اعتماداً على القوة التطبيقية، حميدة، ممتعة، أو مؤلمة. تم الكشف عن تشوه النسيج خلال اتصال بالخلايا ميتشانوريسيبتور المتخصصة جزءا لا يتجزأ من الجلد التي تعبر عن البروتينات مستقبلات، قنوات أيون الأكثر شيوعاً. خطوات ربط مفهوم القوة بايون قناة التنشيط خلال اللمس والألم ليست مفهومة تماما. ومن المعروف حتى أقل حول كيف فلاتر تشوه الميكانيكية وميتشانوريسيبتورس ما إذا كان الكشف عن تغييرات في إجهاد أنسجة الجلد أو التشديد على1،،من23. وتنشأ هذه الفجوة في التفاهم، في جزء منه، من الافتقار إلى الأدوات المناسبة لتطبيق التحفيز الميكانيكية الدقيقة على سطح الجلد من الحيوانات الحية حين رصد الاستجابات على المستوى الخلوي. بينما مجهر القوة الذرية وقد استخدمت على نطاق واسع لتطبيق وقياس القوى في الخلايا المعزولة4،5 ، وأيضا لتنشيط مستقبلات Piezo1 في المعيشة الخلايا6، تجارب مماثلة باستخدام الحيوانات الحية، وخاصة C. ايليجانس، كان التحدي المعروف بسبب الحركة الجوهرية لهذا الموضوع. تقليديا يتم التحايل على هذا التحدي باستخدام الغراء cyanoacrylate الصف البيطرية أو الجراحية لشل الحيوانات الفردية في أجار منصات1،7،،من89. وهذا النهج قد تم منتجة، لكن القيود المتصلة بالمهارات المطلوبة للتثبيت بالالتصاق والسطح أجار الناعمة على الامتثال الميكانيكية. استراتيجية ميكروفلويديكس هو بديل مجاني أن يتجنب بعض المضاعفات المرتبطة بالالتصاق.
ديدان أسطوانية C. ايليجانس هو كائن نموذج وراثية مع نظام عصبي معين تماما أنه، نظراً لحجم الحيوان، يكون مناسباً للتكنولوجيا ميكروفلويديكس. عرض الأجهزة المستندة إلى ميكروفلويديكس وميزة أن الحيوانات خلاف ذلك الغاية متنقلة يمكن ضبط النفس أثناء إجراء تصوير عالي الدقة والتسليم من المحفزات العصبية مودولاتوري ذات الصلة. مع المساعدة من موائع جزيئية يمكن معطلة التكنولوجيات، تعيش الحيوانات دون ضرر10،11، مما يتيح رصد النشاط السلوكية على مدى ال12،عمر كامل13 وعالية الدقة تصوير نشاط الخلايا العصبية14،15،،من1617. علاوة على ذلك، العديد من الخلايا العصبية ميتشانوريسيبتور اللازمة للاحساس باللمس والألم يمكن أن تتسم بها الفسيولوجية1،8، الميكانيكية4،،من1819، والجزيئية مستوى20،،من2122.
C. ايليجانس الحواس لطيف المنبهات الميكانيكية لجدار الجسم باستخدام ترنس ستة، ثلاثة منها يعصب للحيوان الأمامي (المل/R، والألغام المضادة للمركبات) وثلاثة منها يعصب مؤخرة الحيوان (بلمل/R و PVM). وقد درست أيون قناة الجزيئات اللازمة ترانسدوسينج قوة المطبقة في إشارة بيوكيميائية على نطاق واسع في ترنس8. تعرض هذه المقالة منصة موائع جزيئية23 التي تمكن الباحثين من تطبيق قوي ميكانيكية دقيقة على الجلد المعطل تداولها C. ايليجانس الدودة، أثناء تلاوته التشوه في الأنسجة الداخلية بالتصوير الضوئي. بالإضافة إلى تقديم محفزات ميكانيكية محددة تحديداً جيدا، يمكن تسجيلها في الخلايا العصبية ميتشانوريسيبتور مع قرار سوبسيلولار الكالسيوم العابرين ويرتبط بالخصائص المورفولوجية والتشريحية. الجهاز يتكون من قناة محاصرة المركزي الذي يحمل حيوانا واحد وتعرض الجلد إلى جانب ست قنوات يشتغل هوائية (الشكل 1 و الشكل 2). القنوات الست المتوضعة على طول القناة الملائمة لتقديم المحفزات الميكانيكية لكل من ترنس الست للدودة. يتم فصل هذه القنوات من الدائرة الملائمة أغشية PDMS رقيقة، التي يمكن أن تكون مدفوعة بمصدر ضغط جوي خارجي (الشكل 1). ونحن معايرة انحراف فيما يتعلق بالضغط وتوفير القياسات في هذه المقالة. ويمكن تناولها على حدة كل صمام والمستخدمة لتحفيز ميتشانوريسيبتور الاختيار. الضغط هو تسليم باستخدام مضخة ضغط يحركها بيزو ولكن يمكن استخدام أي جهاز بديل. نظهر أن بروتوكول ضغط يمكن استخدامها لتنشيط ترنس في فيفو وإظهار التشغيل أجهزة مناسبة لتقديم محفزات ميكانيكية للكبار C. ايليجانس، تحميل الحيوانات الكبار في الأجهزة، والقيام بتصوير الكالسيوم التجارب، وتحليل النتائج. تصنيع جهاز يتألف من خطوتين أساسيتين: 1) التصويرية لجعل العفن من سو-8؛ و 2) صب PDMS جعل جهاز. توخياً للإيجاز والوضوح، يحال القراء إلى سبق نشرها مقالات والبروتوكولات24،25 للحصول على إرشادات حول كيفية إعداد قوالب والأجهزة.
Protocol
1. تصنيع الجهاز
- تنزيل الملف المرفق قناع (تكميلية ملف 1) وإنشاء قناع كروم باستخدام خدمة تجارية أو مرفق داخلي. كما البعد أصغر على الجهاز هو 10 ميكرون (سمك الغشاء المحرك)، ضمان أن القناع بدقة عالية بما فيه الكفاية، داخل ± 0.25 ميكرومتر، لإنتاج موثوق الميزات.
-
اتباع أساليب الطباعة الحجرية التصويرية سو-8 القياسية (مثلاً، مراجع24،25،26) اختﻻق العفن الإنتاج اللاحقة للأجهزة PDMS؛ يتم سرد موجز للخطوات أدناه-
ملاحظة: سو-8 مادة حساس، الذي كروسلينكس عند التعرض للضوء فوق البنفسجي (استيعاب الحد الأقصى ~ 365 نانومتر). استخدام تعليمات الشركة المصنعة كنقطة انطلاق لتحديد معايير تجهيز خبز لينة, التعرض (الأشعة فوق البنفسجية)، وبعد الخبز.- إيداع سو--8 عام 2002 على رقاقة السيليكون، ومعطف تدور على سماكة تقريبية 2 ميكرومتر، لالتصاق أفضل الهياكل الصغيرة. خبز لينة على صفيحة ساخنة لمدة 1 دقيقة عند 95 درجة مئوية، قليلاً الإفراط في فضح السطح (الأشعة فوق البنفسجية) الكامل (~ 100 مللي جول/سم2)، وبعد الخبز على طبق ساخن لمدة 2 دقيقة في 95 درجة مئوية.
- زيادة ونقصان-معطف طبقة سميكة 47-ميكرومتر من سو--8 عام 2050 لتحديد ملامح الجهاز. استخدام سرعة دوران 500 لفة في الدقيقة 15 s (130 تسريع دورة في الدقيقة/s) وثم لفة في الدقيقة 2,000 ل 90 s (تسريع دورة في الدقيقة/s 260). إذا لزم الأمر، كرر وضبط سرعة الدوران للحصول على سمك مناسب مقاوم الضوء.
- خبز لينة على طبق ساخن لمدة 2 دقيقة عند 65 درجة مئوية، ومن ثم لمدة 7 دقائق في 95 درجة مئوية. كشف مقاوم الضوء طبقاً لتعليمات الشركة المصنعة (~ 160 مللي جول/سم2) باستخدام عامل تصفية قناع وتمرير طويل كروم لضمان الجدران الجانبية على التوالي.
- إزالة يفر وبعد الخبز على طبق ساخن لمدة 1 دقيقة عند 65 درجة مئوية، ودقيقة 7 عند 95 درجة مئوية.
- حل سو-8 لم يتعرضوا مع المطور، وتنظيف مع 2-بروبانول.
- خبز يفر على هوتبلت عند 180 درجة مئوية مدة 30 دقيقة (الثابت خبز) لتثبيت ميزات مقاوم الضوء.
-
إنشاء نسخة متماثلة PDMS من طراز سو-8 باستخدام النسخة المتماثلة القياسية صب أساليب27.
- علاج العفن سو-8 بالبخار تريتشلوروميثيلسيلاني (تكمس) لتقليل التصاق PDMS (سيلانيزيشن).
تنبيه: تكمس السامة والمياه-القائم على رد الفعل.- مكان يفر منقوشة في رف ويفر داخل مجفف فراغ جرة بيل في غطاء دخان خالية من المياه أو المواد الكاشفة للذوبان في الماء.
- تحت غطاء محرك السيارة، استخدام قطارة لتطبيق 1 قطره تكمس على طبق زجاج ومكان داخل مجففة.
- إغلاق الغطاء مجففة والسماح لبخار TCMS معطف يفر لمدة 20 دقيقة على الأقل.
- تنفيس، ثم قم بفتح في مجففة. افتح غطاء جرة بيل وإزالتها استخدام ملاقط بلاستيكية ويفر. وضع في طبق بتري أو الألومنيوم إحباط قارب صب النسخ المتماثلة PDMS. التخلص من المواد المغلفة تكمس في النفايات الخطرة السليم.
- باستخدام مزيج PDMS (نسبة 10:1) ز 40 قاعدة البوليمر و 4 ز PDMS علاج عامل.
- صب الخليط على القالب سو-8 وديغا الخليط لمدة 30 دقيقة على الأقل في فراغ غرفة.
- علاج على الأقل 6 ح عند 70 درجة مئوية في فرن.
- علاج العفن سو-8 بالبخار تريتشلوروميثيلسيلاني (تكمس) لتقليل التصاق PDMS (سيلانيزيشن).
- رفع PDMS قبالة يفر بالإعداد يفر أفقية على سطح مستو وعناية يسقط في PDMS. لا ينحني يفر صعودا أثناء هذه الخطوة، كما أنها يمكن أن كسر القالب.
ملاحظة: يمكن أن يؤدي التصاق ناقصة من سو-8 على رقاقة أو سيلانيزيشن غير مكتملة في تدمير هياكل سو-8 أثناء هذه الخطوة. - قطع PDMS حول الأجهزة إلى رقائق الفردية مثل احتواء الأجهزة على ساترة 24 مم × 60 مم.
- استخدام لكمه خزعة 1 ملم، جعل ثقوب في المدخل ومنافذ اثنين وستة المشغلات استخدام لكمه خزعة 1 ملم. وتهدف للدوائر مم 2 حول حواف الجهاز.
-
رقائق PDMS السندات بكشوف غطاء الزجاج.
- فضح كل الأسطح إلى 80 ث الأكسجين البلازما (30 ثانية).
- بلطف ضع السطح PDMS مكشوفة على سطح مكشوف لكشف الغطاء عن ختم امتثالي.
- يصلب الجهاز على لوحة الساخن (100 درجة مئوية، 10 دقيقة).
ملاحظة: الربط غير كافية يمكن أن يؤدي إلى فشل الجهاز بسبب التسرب.
2-إعداد المجهر
ملاحظة: الحيوانات المحورة وراثيا: نعرب عن مؤشر كالسيوم مثل GCaMP6s28 أو أخرى مسبار النشاط وراثيا مرمزة في neuron(s) للفائدة (مثلاً، اختصرت)؛ شارك إكسبريس بروتين فلورسنت مستقلة عن النشاط التي تنبعث منها في طول موجه مختلفة لتصحيح الجانبية الصغيرة والقطع الأثرية الحركة خارج نطاق التركيز التي تنشأ بسبب التحفيز الميكانيكي. البرنامج الآلي تحليل المسارات ويعوض عن التغيرات المستحثة بالحركة في كثافة النشاط التحقيق. 23 سلالات GN692 دودة (أو AQ323629) التعبير عن GCaMP6s (أو GCaMP6m) وتاجرفب الكالسيوم مستقلة تخضع لسيطرة وزارة التعليم-7 مروج. بالإضافة إلى ذلك، يحتوي GN692 على lite-1(ce314)الطفرة التي تمنع تنشيط ترنس نظراً لاستشعار الضوء الأزرق لايت 130 أثناء الإثارة من الأسفار GCaMP6s23.
-
قم بإعداد نظام مجهر للإثارة المتزامنة جكامب، وطلب تقديم العروض.
- استخدام أما من مصدر ضوء مستمر وعامل تصفية إثارة فرقة مزدوج الذي ينقل الضوء الأصفر والسماوي فقط، أو استخدام مصدر ضوء التي تنبعث من الأطوال الموجية فقط في عرض النطاق ترددي محددة مثل السماوي المتزامنة (0.77 ميغاواط) والأصفر (1.21 ميغاواط) مصادر الإثارة الصمام ل الإثارة المتزامنة من الأسفار المعتمدة على الكالسيوم ومستقلة، على التوالي.
- استخدام كاميرا رقمية لتمكين تسجيل الصور مجهرية.
ملاحظة: معظم الكاميرات تأتي مع برامج للحصول على الصور. بدلاً من ذلك، هناك البرمجيات المتاحة بحرية التي يمكن استخدامها للتحكم في الكاميرا، ويحتمل أن تكون أيضا أجزاء أخرى من نظام الفحص المجهري. - ضبط كثافة الإثارة استناداً إلى كثافة الأسفار لتجنب التشبع الكاميرا.
-
استخدام مكعب الأسفار تبعاً لاختيار مصدر الإثارة تحتاج إلى أن تكون مجهزة بعامل تصفية إثارة.
ملاحظة: 488 نانومتر بروتينات فلورية خضراء ومتشيري 580 نانومتر واستخدمت فلتر الإثارة هنا.- إضافة شعاع مقسم إلى المكعب لتعكس الضوء السماوي والأصفر وتحيل الضوء الأخضر والأحمر.
- تجهيز المجهر مع 10 × الهدف وهدف عالية التكبير (مثلاً، 63 X/1.32 غ زيت) لتركيز الضوء على العينة الإثارة.
- جبل الخائن شعاع أمام الكاميرا لتسجيل متزامنة في جكامب وإشارة مستقلة عن الكالسيوم. ضمان أن التقسيم شعاع مرآة مزدوج اللون (تمر فترة طويلة، وقف إنتاج المواد الانشطارية في 570 نانومتر) لفصل الضوء الأخضر والأحمر باستخدام عامل تصفية واحد من الانبعاثات للأخضر (passband تركزت في 525 نانومتر مع 50 نانومتر العرض) وتصفية واحد انبعاث للضوء الأحمر (passband تركزت في 632 نانومتر مع 60 شمال البحر الأبيض المتوسط العرض).
- المشروع ومضان أخضر وأحمر على النصف العلوي (الأخضر)، وأقل من نصف (أحمر)، على التوالي من الكاميرا رقاقة (انظر الشكل 3). هذا التوجه شرط مسبق لبرمجيات التحليل المتوفر.
3-إعداد الحيوان
- إعداد مزامنة سن الشباب البالغين أو الكبار يوم واحد C. ايليجانس، كما هو موضح مسبقاً قبل بورتا-دي-لوس أنجليس--ريفا et al. 31
- تعد رقاقة موائع جزيئية.
- الاتصال الخزان تدفق الجاذبية (~ 60 سم فوق مستوى رقاقة) تتضمن تصفية العازلة M9 (تصفية حقنه بولييثيرسولفوني 0.2 ميكرون) إلى منفذ واحد للرقاقة. الاتصال بالمأخذ الأخرى إلى منفذ واحد اثنين-مخرج حاوية نفايات، أي، قارورة عامل تصفية. قم بتوصيل منفذ آخر لحاوية النفايات مضخة تمعجية.
ملاحظة: استخدام أنابيب البولي إيثيلين (PE) لكافة الاتصالات واستخدام تجهيزات أنابيب معدنية لتوصيل أنابيب PE إلى شرائح. بهذه الطريقة سوف مسح نفاد الرقاقة حلول جميع النفايات وجمعها في حاوية النفايات. يخلق التدفق من خلال القنوات منفذاً شفط لطيف التي سوف تبقى الدودة دافئ خلال عملية محاصرة لاحقاً. - إعداد اتصال وصلتي تتألف من 50 ملم طويلة PE أنابيب (OD 0.9652 ملم، ومعرف 0.5842 ملم) مع الأنابيب المعدنية (قياس حجم 23TW، 0.635 ملم OD) على طرفي. الصحافة تناسب هذه اتصال وصلتي في كل من أصابع يشتغل ستة وفي مدخل دودة (انظر الشكل 1). ترك هذه إينتيركونيكتورس في الشريحة، كما يؤدي إزالة المتكررة على ارتداء الثقوب PDMS.
- الاتصال الخزان تدفق الجاذبية (~ 60 سم فوق مستوى رقاقة) تتضمن تصفية العازلة M9 (تصفية حقنه بولييثيرسولفوني 0.2 ميكرون) إلى منفذ واحد للرقاقة. الاتصال بالمأخذ الأخرى إلى منفذ واحد اثنين-مخرج حاوية نفايات، أي، قارورة عامل تصفية. قم بتوصيل منفذ آخر لحاوية النفايات مضخة تمعجية.
- ضع الرقاقة في المجهر. الديدان 2 – 5 بيك إلى قطره من تصفية العازلة M9 (0.2 ميكرون فلتر المحاقن) واستخدام المحاقن 1 مل لوضع لهم في أنابيب PE (OD 0.9652 ملم، ومعرف 0.5842 ملم) متصل بحقنه 1 مل عن طريق سحب الزناد برفق. الحفاظ الحيوانات في أنبوب PE وليس في المحاقن.
ملاحظة: عدد كبير جداً من الديدان أو الحلول غير المصفى في الرقاقة يمكن أن يؤدي إلى انسداد. - قم بتوصيل أنابيب PE من المحاقن للتواصل في مدخل دودة (الشكل 1 و الشكل 2) للرقاقة. تنشيط تدفق الجاذبية عن طريق فتح الصمام وتبدأ مضخة تمعجية. ثم اضغط برفق المكبس حقنه من المحاقن لنقل الحيوانات إلى القناة الملائمة مع مراعاة القناة تحت مجهر مع عدسة X 10 في وضع برايتفيلد.
ملاحظة: تظهر أحياناً فقاعات الهواء لا تشكل مشكلة؛ فيتم نقلها عادة تلقائياً إلى المنفذ. يمكن 'متوقفة' في قاعة انتظار العديد من الحيوانات وتستخدم تسلسلياً.- بعد تحميل الحيوان إلى القناة الملائمة (انظر أيضا الشكل 2)، وتعديل موقفها بلطف دفع أو سحب المكبس للمحاقن لتحديد موضع رأس الحيوان في الشكل مدبب للجزء الأمامي القناة.
- تأكد من وجود الدودة (الكبار اليوم 1) الحجم الصحيح أن المحاصرين في الشريحة.
- إذا كان الفيروس المتنقل لا تملأ كامل المقطع العرضي للقناة من الآنف إلى قرب نهاية الجسم (بما في ذلك عدم غيض الذيل) أو الدودة تتحرك على طول محور القناة دون تحريك المكبس المحاقن ، إزالة الفيروس المتنقل بضغط المكبس المحاقن حتى يختفي من القناة الملائمة وتحميل واحد جديد (راجع الخطوة 3، 8).
- قم بالتبديل إلى وضع الأسفار المجهر وعدسة تكبير أعلى (40 X أو أعلى) والتحقق من ما إذا كان نورت من الخلايا العصبية التي تهم يأتي الكذب عبر الحجاب الحاجز واحد من المحركات. إذا لم يكن الأمر كذلك، ضبط موضع الحيوان عن طريق سحب أو دفع المكبس. إذا كان هذا لا يساعد، إزالة الفيروس المتنقل وتحميل واحد جديد.
- تركز على جسم الخلية العصبية للفائدة والاتصال ربط صمام الأقرب إلى العصبية على الجانب الأمامي من جسم الخلية بمضخة ضغط قابلة لبرمجة باستخدام أنابيب PE.
- إذا كانت التجربة يتطلب قياس المسافة بين الخلايا العصبية، وصمام نقل مجال الرؤية بحيث كلاهما في مجال الرؤية وتشانيلوال مواز للحافة العليا والسفلي للصورة.
- تعريف بروتوكول ضغط باستخدام مضخة الضغط القابلة للبرمجة.
ملاحظة: يمكن تعديل هذا البروتوكول للتجربة المرجوة.- ابدأ بضغط مستمر من الجيش الشعبي الكوري 0 لوقت المقابلة للصور على الأقل 50 من تسلسل الصورة (ضرورية للتطبيع). لتصوير بمعدل 10 هرتز هذا يناظر 5 س. إضافة الموجي حافز المطلوب والضغط وتحديد طول التحفيز كخطوة ثانية.
ملاحظة: لحفز ترنس، ينصح الموجي جيبية (أي، 75 كيلو باسكال، 10 هرتز) فرضه بخطوة (أي، 275 كيلوباسكال) كما أنه يولد استجابة الخلايا العصبية كبيرة. - إذا كانت التجربة يتطلب حوافز إضافية، تشمل فترة على الأقل 10 s بضغط مستمر من الجيش الشعبي الكوري 0 ما بين المحفزات. قبل تبديل مضخة الضغط، تأكد من الضغط الصك في الجيش الشعبي الكوري 0 مستمر لتجنب التحفيز عرضي للدودة قبل التجربة الفعلية.
- ابدأ بضغط مستمر من الجيش الشعبي الكوري 0 لوقت المقابلة للصور على الأقل 50 من تسلسل الصورة (ضرورية للتطبيع). لتصوير بمعدل 10 هرتز هذا يناظر 5 س. إضافة الموجي حافز المطلوب والضغط وتحديد طول التحفيز كخطوة ثانية.
- تشغيل البروتوكول التصوير والضغط.
- في البرنامج الحصول على الصور من الكاميرا، قم بإعداد تسلسل صورة في 10 هرتز باستخدام وقت تعرض لمرض التصلب العصبي المتعدد 100 لمدة البروتوكول الضغط. ضبط شدة الإثارة مثل الزيادة القصوى الأسفار لا تشبع الكاميرا. حفظ الصور كملف *.tif مع الصور على الأقل 50 قبل أن الحافز الأول للتطبيع.
- بدء تشغيل البروتوكول التصوير في صورة اقتناء البرمجيات وبروتوكول الضغط في البرمجيات مضخة قابلة للبرمجة. أثناء التسجيل، مراقبة عما إذا كانت الخلايا العصبية التي تهم هو ألمع بقعة في مساحة 10 × 10 بكسل وعدم المضي أبعد من 10 بكسل في صور متسلسلة ويبقى في مجال الرؤية أثناء التسجيل.
ملاحظة: إذا لم يتم ذلك، سوف تفشل البرمجيات التحليل. النقاط المضيئة (أي أوتوفلوريسسينسي) حول الخلايا العصبية تجعل تنظيف التسجيلات من الخلايا العصبية صعبة. لتصحيح هذه المشكلة، إزالة الفيروس المتنقل من الفخ وتحميل دودة جديدة إلى الرقاقة. إذا الدودة تتحرك كثيرا، حاول تسجيل جديد من دودة نفسه ومراقبة حركة الدودة. إذا استمرت المشكلة قد تكون الدودة صغيرة جداً أن المحاصرين. في هذه الحالة، إزالة هذا الفيروس المتنقل وتحميل دودة أكبر قليلاً في الفخ. - إذا رغبت في ذلك، تسجيل الإشارات من الخلايا العصبية متعددة في مجال الرؤية في وقت واحد طالما يتم فصل الخلايا العصبية بكسل على الأقل 10 أثناء تسجيل كامل.
- للتحقيق في التعود، إجراء التجربة متكررة على حيوان.
- إزالة الفيروس المتنقل من القناة الملائمة.
- إذا كان ذلك هو المطلوب للحفاظ على الفيروس المتنقل للدراسات اللاحقة، قطع منافذ البيع للرقاقة اتجاه تدفق الجاذبية وحاوية النفايات. اضغط المكبس للمحاقن بلطف حتى الدودة كاملة هو توغل قناة التدفق من خلال القنوات الملائمة.
- استمر في الضغط على المكبس حقنه حتى يظهر الحيوان في معالجة تجميعية خارج الرقاقة. قطع الاتصال حقنه بما في ذلك أنابيب PE من مدخل دودة، واستخدامها لنضح الديدان في الحبرية، وأنه نقل إلى صفيحة أجار.
- إذا كان المطلوب هو عدم إبقاء الدودة، إزالة الدودة بضغط المكبس المحاقن حتى يدفع الدودة كاملة من خلال القنوات الملائمة إلى قناة تدفق؛ وسيقوم تدفق الجاذبية والشفط مضخة تمعجية الحيوان من الرقائق وفي حاوية النفايات.
4-تحليل
- تحميل وتثبيت أحدث الإصدار فيجي32.
- تحميل وتثبيت أحدث نسخة جافا SDK.
ملاحظة: إذا لزم الأمر، حذف أو إعادة تسمية المجلد جافا داخل مجلد فيجي لفيجي استخدام المحول البرمجي java المثبتة حديثا. -
قم بفتح البرنامج فيجي.
- التحقق من ما إذا كان البرنامج يقوم بتشغيل المحول البرمجي java المثبتة حديثا بفتح ' الإضافات | المرافق | إيماجيج | خصائص.
- تحميل الملف pokinganalyzer*.java (https://github.com/HFehlauer/Poking-Analyzer، انظر التكميلية ملف 2).
- سحب وإسقاط ملف.java في إطار البرنامج لفتحه كالبرنامج المساعد.
-
ترجمة وتشغيل الملف pokinganalyzer*.java بالضغط على مفاتيح Ctrl + R في فيجي؛ سيتم فتح واجهة مستخدم رسومية (محلل دس) (الشكل 3).
- انقر فوق علامة التبويب "تعليمات" واقرأ عن متطلبات البرنامج وكيفية إجراء التحليل. للبدء، حدد علامة التبويب "فتح الفيديو" تحديد موقع ملف الفيديو للمحلل: انقر فوق الزر فتح شريط فيديو "، انتقل إلى موقع ملف الفيديو، وفتحه.
ملاحظة: البرنامج يبدأ بعلامة التبويب هذه فتح. إذا لم يكن مفتوحاً عند بدء تشغيل انقر فوق تحليل جديد ضمن علامة التبويب "الفيديو مفتوحة". داخليا إذا كان الفيديو بتنسيق a.tif، سيقوم البرنامج بفتح الفيديو وعرض الصورة الأولى في الجزء السفلي من الواجهة. إذا لم تكن الصورة من الفيديو الذي يحتاج إلى تحليل، انقر فوق الزر "فتح شريط فيديو" لفتح شريط فيديو آخر. - للمتابعة، انقر فوق علامة التبويب "تعريف رويس". في علامة التبويب هذه، تحديد موقف ترن. لاحظ أنه يتم عرض الصورة الأولى من الفيديو تم فتحها في الجزء السفلي من هذا التبويب انقر فوق الزر "تحديد النقل"، وانقر فوق الخلايا العصبية الحركية في الجزء العلوي من الصورة المعروضة التي يجب عرض الأسفار جكامب.
- اختياري: إذا كان صمام مرئياً في النصف العلوي من الصورة البرنامج تلقائياً تعقب المسافة بين الخلايا العصبية وصمام إذا رغبت في ذلك. لذلك، تحقق من "تعريف صمام"؟ --مربع، انقر فوق الزر "تحديد المحرك"، وانقر فوق صمام في النصف العلوي من الصورة.
- انقر فوق علامة التبويب "تحليل" تعريف معدل الحصول على الصورة. قم بإدخال رقم في الحقل أو انقر فوق الأعلى أو أسفل أزرار لزيادة أو إنقاص العدد. إذا كنت في علامة التبويب السابقة "تعريف صمام"؟ -تحديد خانة الاختيار، وتحديد حجم الخلية الكاميرا، والتكبير، ومعامل بينينج، حيث البرنامج يمكن حساب المسافة.
- انقر فوق الزر "بدء تحليل".
ملاحظة: البرنامج الآن التي سوف تتبع العصبية التي لها الأسفار في تسلسل الصورة في النصف العلوي (الكالسيوم تعتمد) وفي النصف الأسفل (الكالسيوم مستقلة) لتسلسل الصور. لحساب الحركة العصبية في الطائرة من تسجيل البرنامج ستحقق في مساحة 10 × 10 بكسل حول موقع العصبية في الصورة السابقة للعثور على موضع العصبية في الصورة التالية. فإنه سيتم حساب الأسفار في كل شطر بتصحيح للأسفار الخلفية (وحرس الحدود) قسمة fluorescence في الصور الأولى 50 (و0):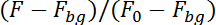
التغييرات fluorescence في قناة خضراء، وتعتمد على نشاط (وCa2 +) التي هي سبب العصبية الحركة خارج الطائرة recoding ومن ثم تصحيح باستخدام الأسفار في القناة الحمراء، مستقلة عن النشاط (و كور) والانحراف المعياري التحفيز المسبق من تعتمد على الكالسيوم (sdCa2 +) والأسفار المستقلة (sdكور) من:
- البرنامج سوف تظهر ما تحرزه من التقدم في شريط المعلومات في الجزء السفلي من الواجهة؛ عندما يصل شريط الحالة إلى 100%، انقر فوق علامة التبويب "النتائج". إذا توقف شريط الحالة قبل 100%، سيعطي البرنامج رسالة خطأ تشير إلى السبب في البرنامج لا يمكن تحليل الفيديو.
- إذا كانت إشارة إلى نسبة الضوضاء منخفضة جداً، البرنامج لا يمكن تحديد الخلايا العصبية؛ ضبط معلمات التصوير في التسجيلات اللاحقة.
- إذا كانت الخلايا العصبية يترك مجال الرؤية أثناء التسجيل، البرنامج لا يمكن تتبع ذلك بعد الآن وسوف تتوقف. للتسجيلات اللاحقة، وضع العصبية في منتصف مجال الرؤية في بداية التسجيل.
- إذا كانت بعض المناطق في مجال الرؤية هي oversaturated، التحليل الآلي سوف ينتج نتائج غير صحيحة. للتسجيلات اللاحقة، تأكد من إشارة الأسفار لا تشبع مستشعر الكاميرا.
- في علامة التبويب 'النتائج'، يتم عرض النتيجة في الجزء العلوي. حفظ ملف مفصولة بعلامات جدولة *.txt نتيجة الجدول بالنقر فوق "حفظ جدول النتيجة".
ملاحظة: هذا الجدول يتكون من الوقت بالثواني والأسفار المعتمدة على الكالسيوم طبيعية (المصوبة بالأسفار الكالسيوم مستقلة). إذا تم تعريفها مسبقاً، فإنه يحتوي أيضا على المسافة الإجمالية بين ترن وصمام في ميكرون والمسافة بين ترن وصمام عمودي على الجدار القناة في ميكرومتر. نتائج تمثيلية لشدة الأسفار زيادة بعد يتم رسم التحفيز مقابل مسافة جسم الخلية إلى صمام أقرب في الشكل 4. - إذا كان هناك العديد من الخلايا العصبية في تسجيل واحد (مفصولة بأكثر من 10 بكسل)، انقر فوق علامة التبويب "تعريف رويس" مرة أخرى والعودة إلى الخطوة 4.6.2 مع العصبية الثانية.
- انقر فوق علامة التبويب "تعليمات" واقرأ عن متطلبات البرنامج وكيفية إجراء التحليل. للبدء، حدد علامة التبويب "فتح الفيديو" تحديد موقع ملف الفيديو للمحلل: انقر فوق الزر فتح شريط فيديو "، انتقل إلى موقع ملف الفيديو، وفتحه.
النتائج
8-سو الطباعة الحجرية والترابط رقاقة
بروتوكول الطباعة الحجرية وصب PDMS اتباع الإجراءات القياسية. التفاصيل يمكن الاطلاع على أماكن أخرى23،24،،من2526. وينبغي أن تقشر PDMS يفر دون مشاكل بعد علاج. إذا را...
Discussion
هذا البروتوكول يوضح أسلوب لتقديم تحفيز ميكانيكية دقيقة لجلد الدودة المحاصرين في رقاقة موائع جزيئية. أنه يهدف إلى تسهيل اندماج المحفزات المادية للإجابة على الأسئلة البيولوجية، ويهدف إلى تنظيم عملية البحث ميتشانوبيولوجي في مختبرات بيولوجية. ويمتد هذا الأسلوب السابق فحوصات لتقييم وظيفة ا...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونشكر ساندرا نون مانوسالفاس-كينو، "لادبلي عيد البوريم"، ميمون فرح وجوبيسيتي ديفيا سانشيز فيرونيكا لتقديم الدعم في تصميم الجهاز وجيل من الحيوانات المسخ. وأيد هذا البحث بالمعاهد الوطنية للصحة منح R01EB006745 (BLP)، R01NS092099 (إلى MBG)، K99NS089942 (في الكنيست)، F31NS100318 (إلى ALN) وتلقت تمويلاً من مجلس البحوث الأوروبي (المنسق) تحت أفق 2020 للبحث والابتكار في الاتحاد الأوروبي (برنامج منح الاتفاق رقم 715243 لعضو الكنيست).
Materials
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
References
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved